- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Ашық сабақ тақырыбы: Азот, фосфор және олардың қосылыстары
Содержание
- 1. Ашық сабақ тақырыбы: Азот, фосфор және олардың қосылыстары
- 2. Сабақтың мақсаты:Білімділік: Азот және фосфордың периодтың жүйедегі орнына
- 3. №1 тапсырмаІVА топша элементеріне қандай элементтер
- 4. № 2 тапсырма Тотығу дәрежелерін табыңыздар:CH4 ,
- 5. Атом құрылысыФосфордың сыртқы энергетикалық деңгейінде 5 электрон
- 6. Слайд 6
- 7. Слайд 7
- 8. Слайд 8
- 9. Слайд 9
- 10. Слайд 10
- 11. Слайд 11
- 12. Физикалық қасиеттері
- 13. Химиялық қасиеттері1. Фосфор оттекте жанып, пентаоксид түзеді:4Р+5О2=2Р2О52.
- 14. 4. Фосфор металдармен фосфидтер түзе әрекеттеседі:3Са+2Р=Са3Р2 кальций фосфиді3Nа+Р=Na3Р натрий фосфиді5. Күрделі заттармен әрекеттеседі:5КСl3+6P=3P2O5+5KCl
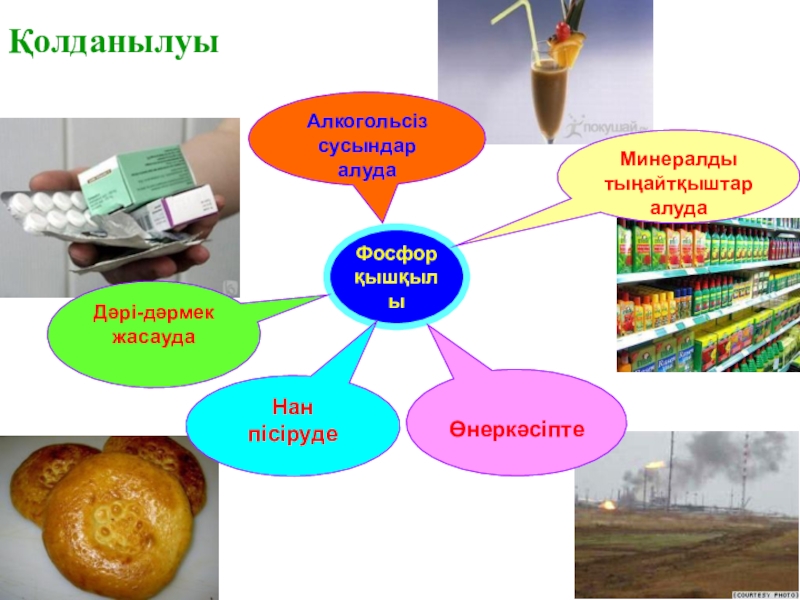
- 15. Қолданылуы
- 16. Фосфор (V) оксидіР2О5+Н2О=2НРО3 метафосфор қышқылыР2О5+2Н2О=Н4Р2О7 дифосфор қышқылыР2О5+3Н2О=2Н3РО4 ортофосфор қышқылы
- 17. АлынуыЗертханада алынуы:P2O5+3H2O=2H3PO4Өнеркәсіпте алынуы:Ca3(PO4)2+3H2SO4=3CaSO4 +2H3PO4
- 18. Химиялық қасиеттері:2H3PO4+3СаО=Ca3(PO4)2 +3H2OСа3(PO4)2+4Н3PO4=3Са(Н2РО4)2
- 19. ҚолданылуыФосфор қышқылыАлкогольсіз сусындаралуда Дәрі-дәрмек жасаудаМинералдытыңайтқыштаралудаӨнеркәсіптеНан пісіруде
- 20. Сабақты бекіту
- 21. №1 тапсырма Тотығу дәрежелерін табыңыздар:NO, NO2,
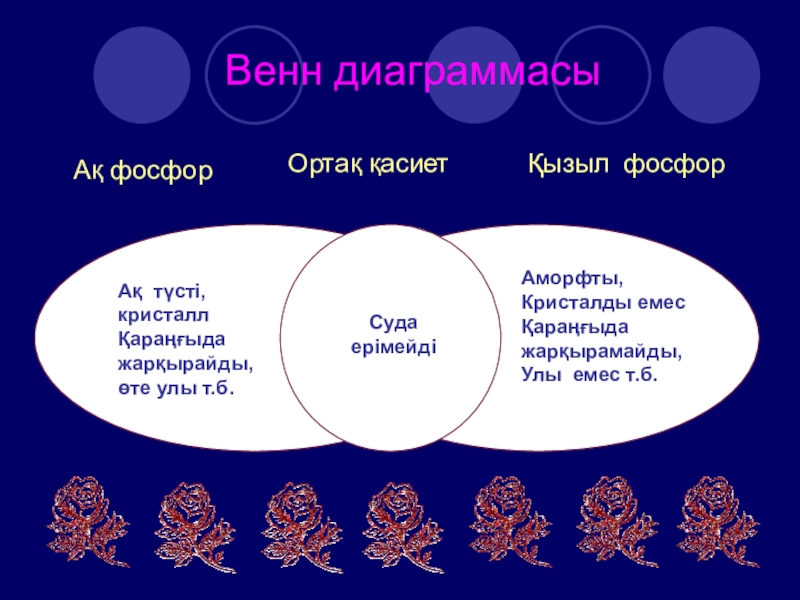
- 22. Венн диаграммасыАқ фосфорҚызыл фосфорОртақ қасиетАқ түсті, кристаллҚараңғыда
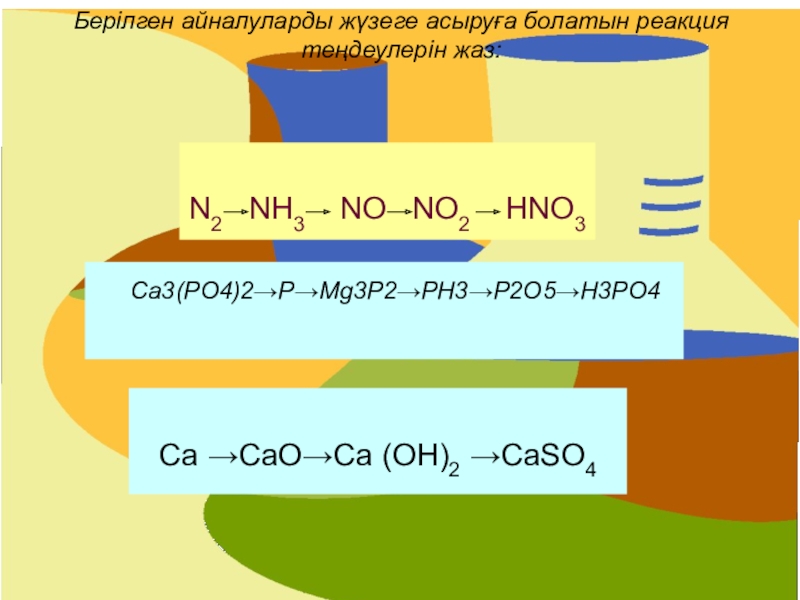
- 23. Берілген айналуларды жүзеге асыруға болатын реакция теңдеулерін
- 24. Эстафеталық ойын “Термин-синоним”
- 25. Эстафеталық ойын “Термин-синоним”
- 26. № 4 тапсырма«Иә» немесе «жоқ» деп жауап
- 27. Үйге тапсырма:§ 7.7, 7.8, 7.9. №9 237
Сабақтың мақсаты:Білімділік: Азот және фосфордың периодтың жүйедегі орнына байланысты V топ элементі ретінде сипаттау, маңызды қасиеттерімен таныстыру. Тәрбиелік: Оқушылардың пәнге деген қызығушылығын оятып, сөйлеу қабілетін дамыту. Дамытушылық: Оқушыларды табиғат байлықтарын тиімді пайдалана білуге үйрету.
Слайд 2Сабақтың мақсаты:
Білімділік:
Азот және фосфордың периодтың жүйедегі орнына байланысты V топ элементі
ретінде сипаттау, маңызды қасиеттерімен таныстыру.
Тәрбиелік:
Оқушылардың пәнге деген қызығушылығын оятып, сөйлеу қабілетін дамыту. Дамытушылық:
Оқушыларды табиғат байлықтарын тиімді пайдалана білуге үйрету.
Оқушылардың пәнге деген қызығушылығын оятып, сөйлеу қабілетін дамыту. Дамытушылық:
Оқушыларды табиғат байлықтарын тиімді пайдалана білуге үйрету.
Слайд 3 №1 тапсырма
ІVА топша элементеріне қандай элементтер жатады?
Көміртектің периодтық жүйедегі
орны және атом құрылысы?
Көміртектің тотығу дәрежелері?
Көміртектің табиғатта таралуы?
Көміртектің физикалық қасиеттерін сипаттаңыз?
Көміртектің химиялық қасиеттерін сипаттаңыз?
Кремнийдің периодтық жүйедегі орны және атом құрылысы?
Кремнийдің тотығу дәрежелері?
Кремнийдің физикалық қасиеті?
Кремнийдің химиялық қасиеті?
Силицидтер дегеніміз не?
Силанның формуласы?
Көміртектің тотығу дәрежелері?
Көміртектің табиғатта таралуы?
Көміртектің физикалық қасиеттерін сипаттаңыз?
Көміртектің химиялық қасиеттерін сипаттаңыз?
Кремнийдің периодтық жүйедегі орны және атом құрылысы?
Кремнийдің тотығу дәрежелері?
Кремнийдің физикалық қасиеті?
Кремнийдің химиялық қасиеті?
Силицидтер дегеніміз не?
Силанның формуласы?
Слайд 4№ 2 тапсырма
Тотығу дәрежелерін табыңыздар:
CH4 , CO2, CO,
SiO2, H2SiO3, SiC, Mg2Si, SiH4, SiF4, H2CO3, CaC2.
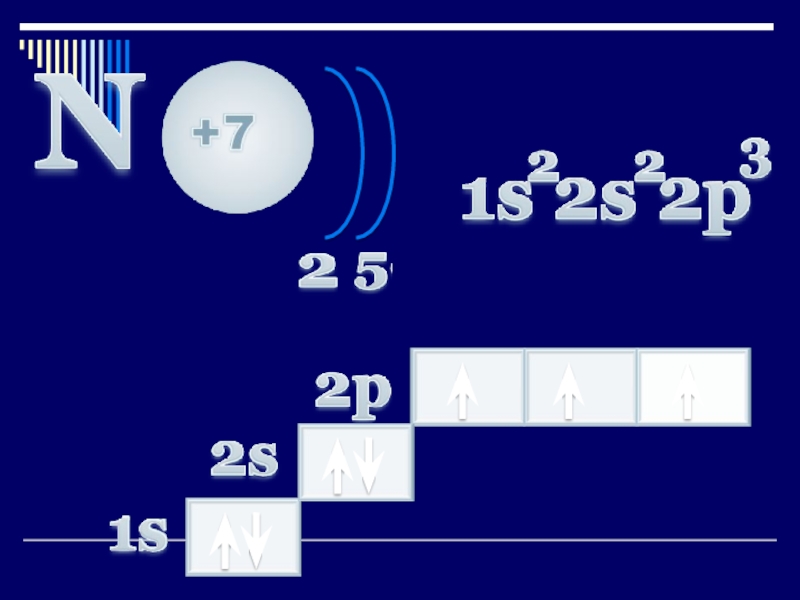
Слайд 5Атом құрылысы
Фосфордың сыртқы энергетикалық деңгейінде 5 электрон бар. Атомындағы электрондардың орналасуы:
Электрондық
құрылысы:
+15Р )2е )8е )5е
1s2 2s2 2p6 3s2 3p3
Слайд 13Химиялық қасиеттері
1. Фосфор оттекте жанып, пентаоксид түзеді:
4Р+5О2=2Р2О5
2. Фосфор хлормен ерекеттесіп, фосфор
үш хлоридін және 3000С-та фосфор пентахлоридін түзеді:
2Р+3Cl2=2РCl3
2Р+5Cl2=2РCl5
3. Фосфор сутекпен тікелей әрекеттесіп, фосфин түзеді:
2Р+3Н2=2РН3
2Р+3Cl2=2РCl3
2Р+5Cl2=2РCl5
3. Фосфор сутекпен тікелей әрекеттесіп, фосфин түзеді:
2Р+3Н2=2РН3
Слайд 144. Фосфор металдармен фосфидтер түзе әрекеттеседі:
3Са+2Р=Са3Р2 кальций фосфиді
3Nа+Р=Na3Р натрий фосфиді
5. Күрделі
заттармен әрекеттеседі:
5КСl3+6P=3P2O5+5KCl
5КСl3+6P=3P2O5+5KCl
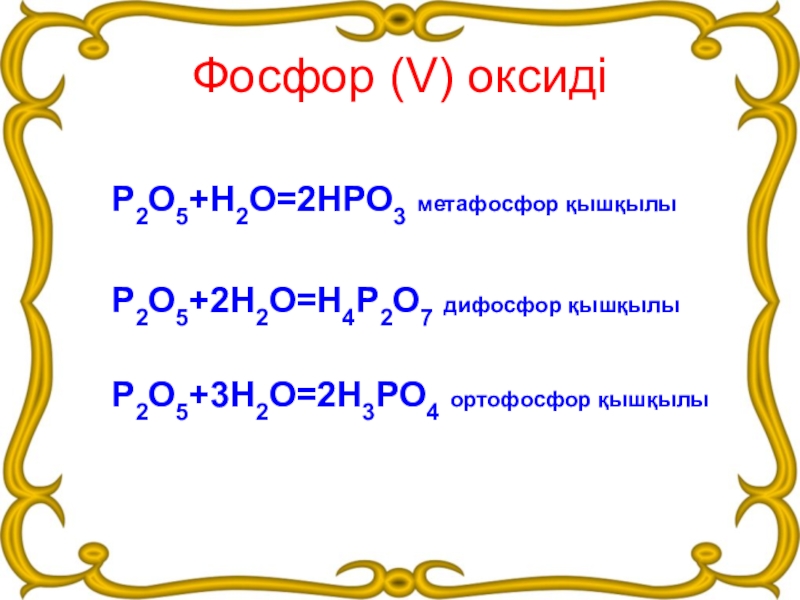
Слайд 16Фосфор (V) оксиді
Р2О5+Н2О=2НРО3 метафосфор қышқылы
Р2О5+2Н2О=Н4Р2О7 дифосфор қышқылы
Р2О5+3Н2О=2Н3РО4 ортофосфор қышқылы
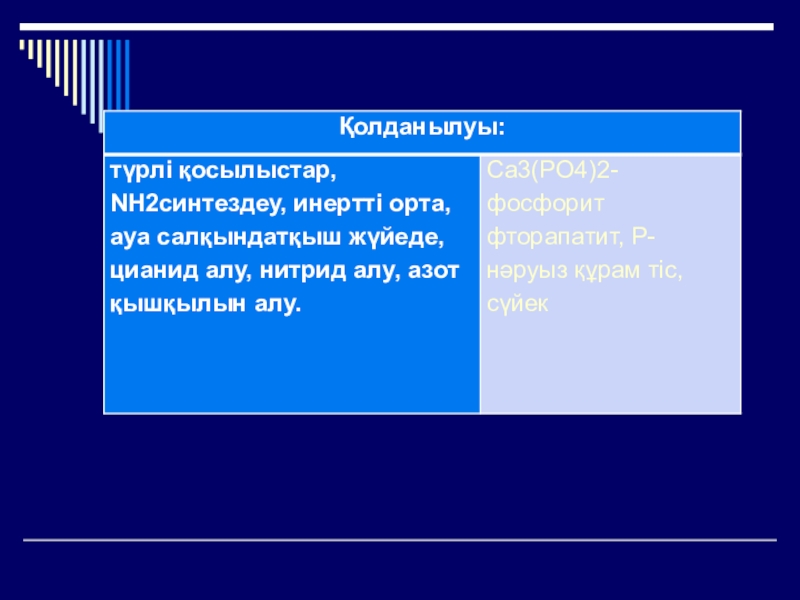
Слайд 19Қолданылуы
Фосфор
қышқылы
Алкогольсіз сусындар
алуда
Дәрі-дәрмек жасауда
Минералды
тыңайтқыштар
алуда
Өнеркәсіпте
Нан
пісіруде
Слайд 21
№1 тапсырма
Тотығу дәрежелерін табыңыздар:
NO, NO2, HNO3, NaNO3, N2O, P2O5,
H3PO4, Ag3PO4, Ca3P2, PCl3, PCl5, P Н3, Ca3P2, P4 , N2.
Слайд 22Венн диаграммасы
Ақ фосфор
Қызыл фосфор
Ортақ қасиет
Ақ түсті,
кристалл
Қараңғыда
жарқырайды,
өте улы т.б.
Аморфты,
Кристалды емес
Қараңғыда
жарқырамайды,
Улы емес т.б.
Суда
ерімейді
Слайд 23Берілген айналуларды жүзеге асыруға болатын реакция теңдеулерін жаз:
N2 NH3
NO NO2 HNO3
Ca →CaO→Ca (OH)2 →CaSO4
Ca3(PO4)2→P→Mg3P2→PH3→P2O5→H3PO4
Слайд 26№ 4 тапсырма
«Иә» немесе «жоқ» деп жауап беру
Фосфордың таңбасы «ПЭ»
Фосфордың
атом масса 31, реттік нөмері 15
Фосфордың тотығу дәрежелері +2 және +4
Азоттың таңбасы «ЭН»
Азоттың тотығу дәрежелері – 3 тен +5 ке дейн
Азоттың атом массасы 14, реттік нөмері 7
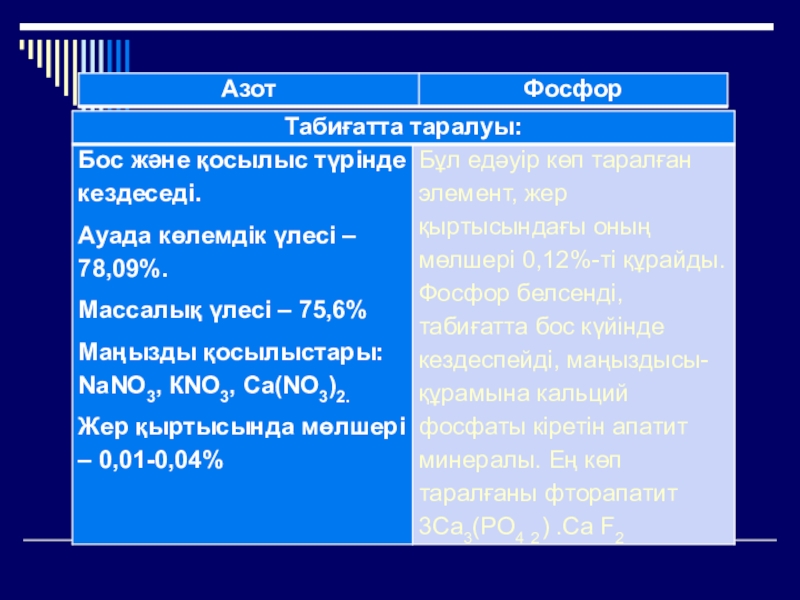
Азоттың ауа құрамындағы мөлшері – 78%
Фосфор 3 периодта, 3 қатарда V А топшасында орналасқан
Азоттың протон саны 7, нейтрон – 6, электрон – 7
Азот және фосфор химиялық қасиетінде оттекпен әрекеттеспейді
Азоттың массалық үлесі – 75,6%
Фосфор – иіссіз, түссіз, дәмсіз, ауадан жеңіл газ.
Фосфордың нейтрон саны 16, протон – 15, электрон – 15
Азотта 3 энергетикалық деңгейше
Фосфиннің формуласы РН3
Фосфордың тотығу дәрежелері +2 және +4
Азоттың таңбасы «ЭН»
Азоттың тотығу дәрежелері – 3 тен +5 ке дейн
Азоттың атом массасы 14, реттік нөмері 7
Азоттың ауа құрамындағы мөлшері – 78%
Фосфор 3 периодта, 3 қатарда V А топшасында орналасқан
Азоттың протон саны 7, нейтрон – 6, электрон – 7
Азот және фосфор химиялық қасиетінде оттекпен әрекеттеспейді
Азоттың массалық үлесі – 75,6%
Фосфор – иіссіз, түссіз, дәмсіз, ауадан жеңіл газ.
Фосфордың нейтрон саны 16, протон – 15, электрон – 15
Азотта 3 энергетикалық деңгейше
Фосфиннің формуласы РН3
Слайд 27Үйге тапсырма:
§ 7.7, 7.8, 7.9.
№9 237 бет (есеп шығару)
Аммиак, азот қышқылы және фосфор қышқылдарына шағын баяндама жазу