- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Ашық сабақ: Фосфор элементіне жалпы сипаттама. Бейметалдар және олардың қосылыстары
Содержание
- 1. Ашық сабақ: Фосфор элементіне жалпы сипаттама. Бейметалдар және олардың қосылыстары
- 2. «Кім жылдам» ойыны 1. Жезқазған, Ақтоғайдан өндірілетін
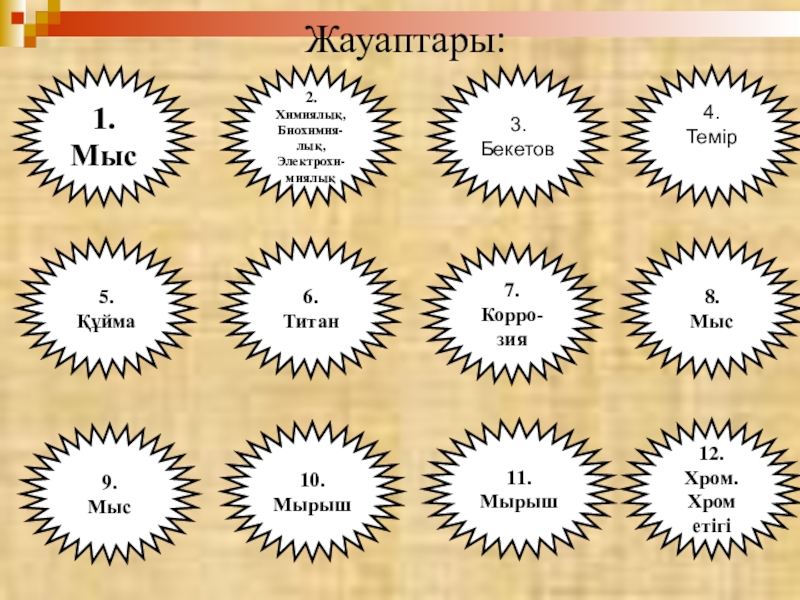
- 3. Жауаптары:1.Мыс5.Құйма2.Химиялық,Биохимия-лық,Электрохи-миялық6.Титан4. Темір3. Бекетов10.Мырыш9.Мыс7.Корро-зия12.Хром.Хром етігі8.Мыс11.Мырыш
- 4. Ойлан, тап.
- 5. Бізге бір тарихшы жұмбақ жасырды. «Гамбур алхимигі
- 6. Алхимик Хенниг Бранд
- 7. Фосфор элементтеріне жалпы сипаттама. Бейметалдар және олардың қосылыстары.
- 8. 3 периодV топНегізгі (А) топшаР +15 )2)8)5+3, +5, -3
- 9. ФОСФОРЭлектрондық формуласы: +15 Р 1s2 2s2
- 10. Салыстырмалы атомдық массасы 30,9738Реттік нөмірі 15Ядродағы протон
- 11. Слайд 11
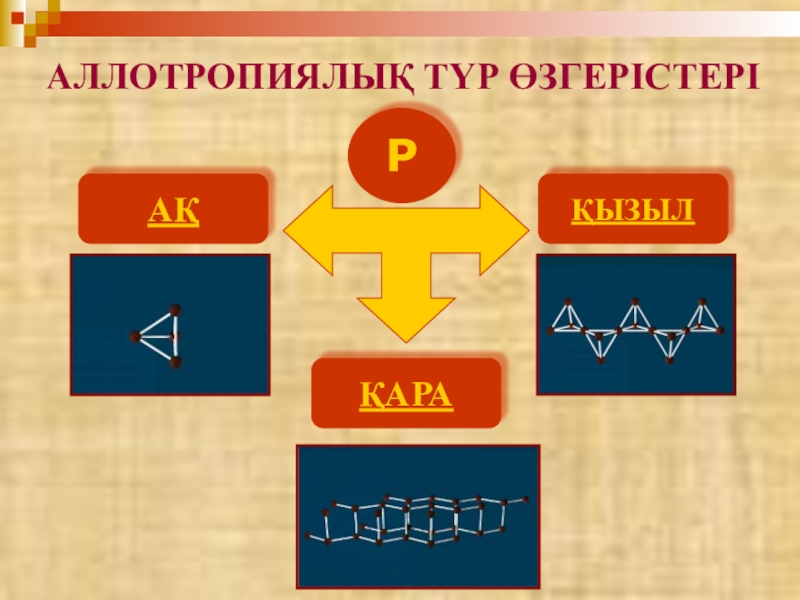
- 12. АЛЛОТРОПИЯЛЫҚ ТҮР ӨЗГЕРІСТЕРІРАҚҚЫЗЫЛҚАРА
- 13. Фосфордың аллотропиялық түрөзгерістері
- 14. P4 молекуласы тетраэдр пішінді. Ол тез
- 15. Қызыл фосфордың бірнеше пішінді түрлері бар.
- 16. Шырпының басын қорапқа үйкегенде қызыл фосфор бертолле тұзынан от алып тез тұтанады.Қалыпты жағдайда қызыл фосфор тұрақты
- 17. Қара фосфор атомдық құрылысы қатпарлы кристалдық тор
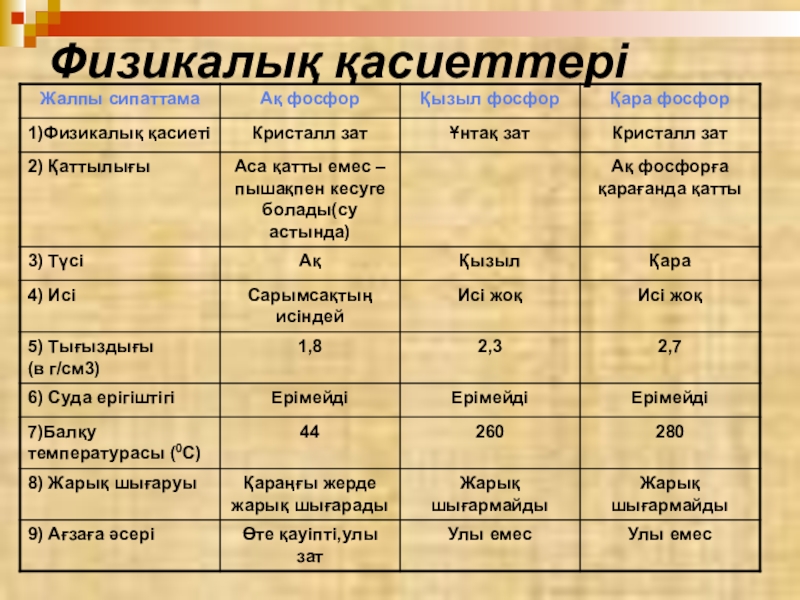
- 18. Физикалық қасиеттері
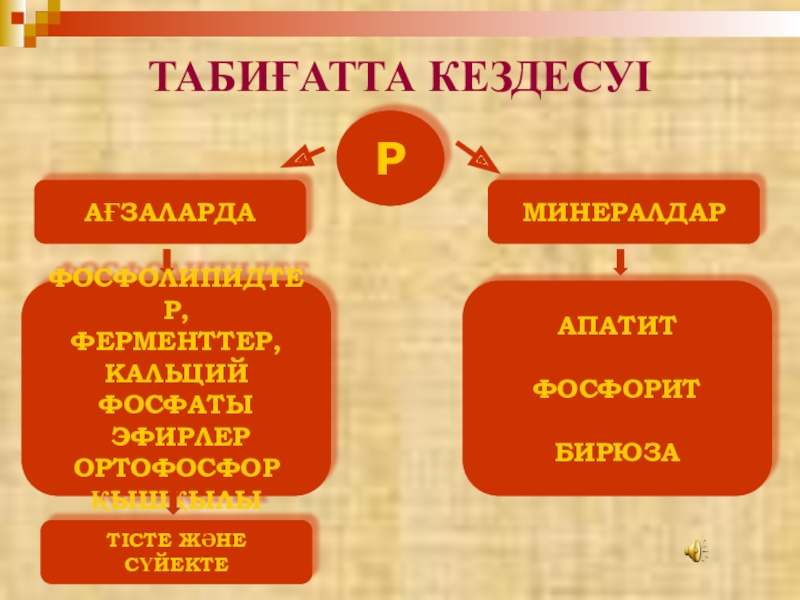
- 19. РАҒЗАЛАРДАМИНЕРАЛДАРФОСФОЛИПИДТЕР,ФЕРМЕНТТЕР,КАЛЬЦИЙ ФОСФАТЫ ЭФИРЛЕР ОРТОФОСФОР ҚЫШҚЫЛЫТІСТЕ ЖӘНЕ СҮЙЕКТЕАПАТИТФОСФОРИТБИРЮЗАТАБИҒАТТА КЕЗДЕСУІ
- 20. Адамға фосфор керек пе?
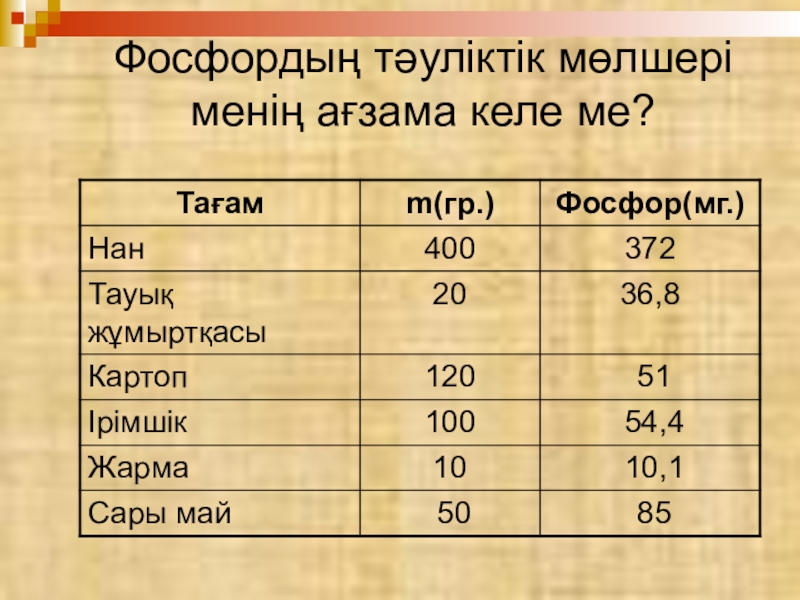
- 21. Фосфордың тәуліктік мөлшері менің ағзама келе ме?
- 22. Слайд 22
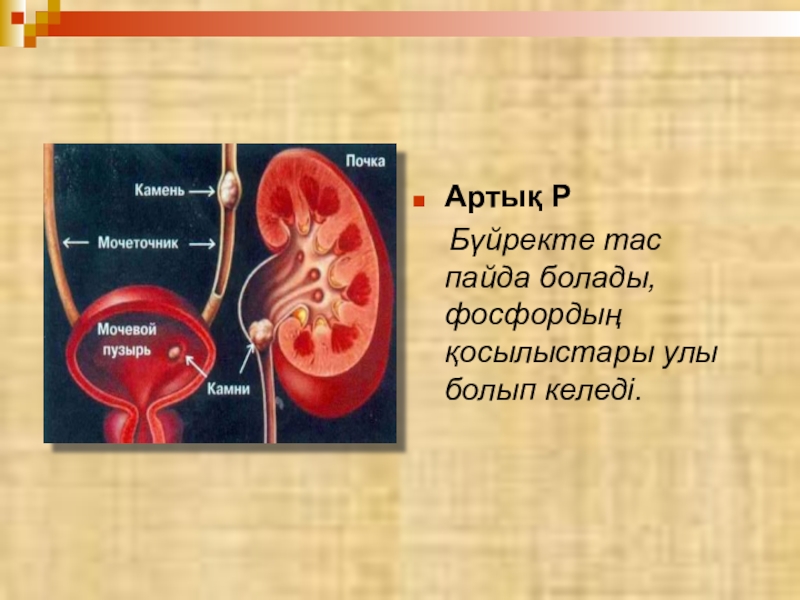
- 23. Артық Р Бүйректе тас пайда болады,фосфордың қосылыстары улы болып келеді.
- 24. Фосфордың биологиялық маңызы
- 25. Слайд 25
- 26. ФОСФОР ТЫҢАЙТҚЫШТАРЫ:Жай суперфосфат
- 27. Слайд 27
- 28. Фосфордың артық және жетіспеген жағдайда ағзаға әсері
- 29. Слайд 29
- 30. Табиғаттағы фосфор Фосфор табиғатта химиялық белсенділігіне
- 31. Химик: Фосфор - тыңайтқыш, дәрі - дәрмек,
- 32. Алынуы Бос күйіндегі фосфорды алу үшін
- 33. Химиялық қасиеттері Ақ фосфорды ауасыз
- 34. ФОСФОРДЫҢ ҚОЛДАНЫЛУЫТыңайтқыштарРЖуғыш заттарУлы химикаттарСуды жұмсартудаШырпы өндірісіндеЖемірілуден қорғайдыЖартылай өткізгішБу шығарудаБояу өндірісінде
- 35. Слайд 35
- 36. ФОСФОРДЫҢ ҚОСЫЛЫСТАРЫР2O5HPO3метафосфорқышқылыH4P2O7пирофосфорқышқылыH3PO4ОртофосфорқышқылыФОСФАТТАРCa3(PO4)2ГИДРОФОСФАТCaНPO4ДИГИДРОФОСФАТCa(Н2PO4)2
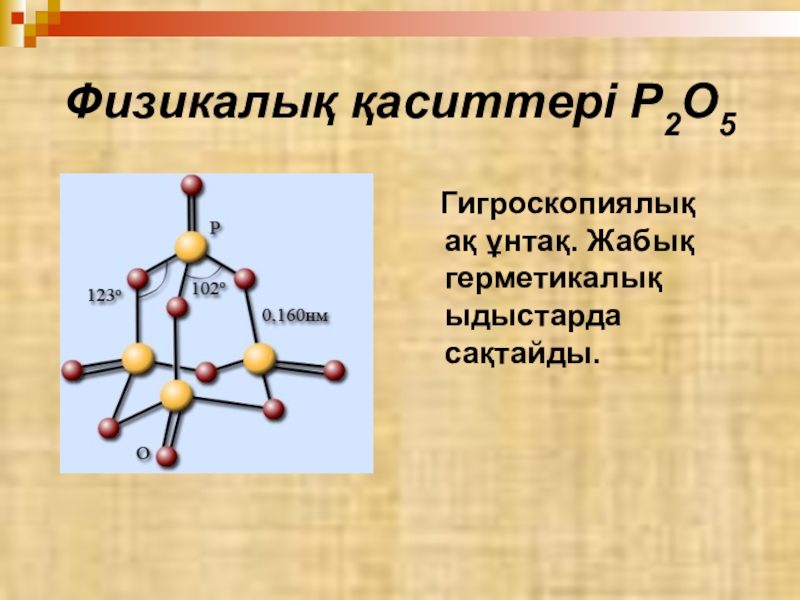
- 37. Физикалық қаситтері P2O5 Гигроскопиялық ақ ұнтақ. Жабық герметикалық ыдыстарда сақтайды.
- 38. Фосфордың азот қышқылымен әрекеттесу реакциясы: P(қатты.) +
- 39. Химиялық қасиеттері P2O5 Қышқылдық қасиет кқрсетеді. 1)
- 40. Алынуы P2O5 Фосфордың жануы кезінде түзіледі:
- 41. Қолданылуы P2O5Газдарды кептірудеСу сіңіргіш зат ретінде қолданылады
- 42. Физикалық қасиеті
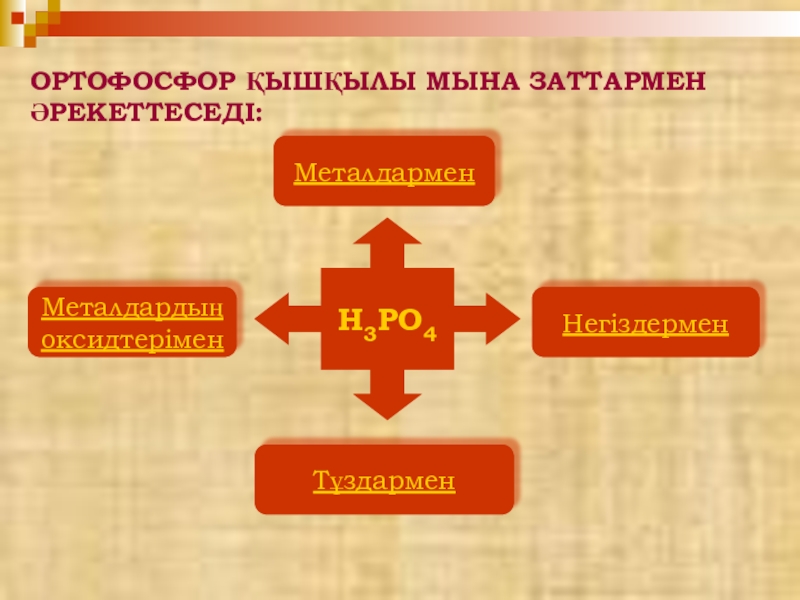
- 43. МеталдарменНегіздерменМеталдардың оксидтеріменТұздарменH3PO4ОРТОФОСФОР ҚЫШҚЫЛЫ МЫНА ЗАТТАРМЕН ӘРЕКЕТТЕСЕДІ:
- 44. Молекула құрылысы
- 45. Бөлме температурасында инертті. Температураны жоғарылатқанда көптеген металдармен әрекеттеседі.2H3PO4+3Mg =Mg3(PO4)2+3H2МеталдарменH3PO4
- 46. Бөлме температурасында инертті. Температураны жоғарылатқанда көптеген металл оксидтерімен әрекеттеседі.2H3PO4+3CaO=Ca3(PO4)2+3H2OH3PO4Металдардың оксидтерімен
- 47. Фосфор қышқылы әлсіз қышқылдардың қатарына
- 48. Фосфор қышқылы әртүрлі тұздармен әрекеттеседі. Фосфор қышқылын
- 49. Қышқылдық оксидтің фосфор(V)оксидінің сумен қосылуы:Р2 О5 + 3H2O = 2 H3PO4
- 50. Фосфор қышқылының тұздары 3ке бөлінеді1) фосфаттар Фосфор
- 51. Слайд 51
- 52. Фосфор,ағзалық элемент ретінде Негізгі
- 53. ҚорытындыФосфор қышқылы – ақ түсті, кристалл
- 54. Фосфордың маңызы Фосфор адам қаңқасы
- 55. Есептер сыры
- 56. Фосфор қышқылы, фосфор (Ү) оксиді, калий фосфаты,
- 57. 242 беттегі №6,9 есептерСа3(РО 4)2---- Р---Р2О5----Н3РО4-----СаНРО4-----Са3(РО4)2 Кальций
- 58. Нәтиже: Менің ағзама енетін фосфордың мөлшері
- 59. ҮЙГЕ ТАПСЫРМА§ 18,19.1-5 жаттығу.
Слайд 2«Кім жылдам» ойыны
1. Жезқазған, Ақтоғайдан өндірілетін металл.
2. Коррозияның түрлерін
3. Металдардың активтілік қатарын жасаған кім .
4. Өшпейтін өмір жоқ, сөнбейтін ............... жоқ.
5. Металдардың металдағы ерітіндісі.
6. IV- топтың "В"топшасындағы сынған сүйектерді бекітуге қолданатын металл.
7. Қоршаған орта әсерінен металдардың бүлінуі.
8. Тас ғасырында адамның бірінші танысқан металы.
9. Адамдар құрал жасау үшін алғаш рет қандай затты пайдаланған?
10. Қызыл қан түйіршіктерінде болатын элемент.
11. Топырақта қандай элемент жетіспесе,өсімдіктің өсуі баяулайды.
12. Қандай қосылысты тері илеуде пайдаланды.Осыдан келіп қандай атау шыққан.
Слайд 3Жауаптары:
1.
Мыс
5.
Құйма
2.
Химиялық,
Биохимия-лық,
Электрохи-миялық
6.
Титан
4.
Темір
3. Бекетов
10.
Мырыш
9.
Мыс
7.
Корро-зия
12.
Хром.
Хром етігі
8.
Мыс
11.
Мырыш
Слайд 5Бізге бір тарихшы жұмбақ жасырды. «Гамбур алхимигі Бранд «философиялық тас» алу
Слайд 10
Салыстырмалы атомдық массасы 30,9738
Реттік нөмірі 15
Ядродағы протон саны 15
Нейтрон саны
Көп жағдайда кездесетін тотығу дәрежелері +3, +5, Аз кездесетін тотығу дәрежелері -3, -2, +1, +4
Слайд 14 P4 молекуласы тетраэдр пішінді. Ол тез балқиды t(б)=44,1оС, t(қ)=275оС, жұмсақ,
АҚ ФОСФОР
Ақ фосфор – өте тұрақсыз және өте белсенді, улы зат, ауамен жанасса жанады, қараңғыда жарық шығарады.
Слайд 15 Қызыл фосфордың бірнеше пішінді түрлері бар. Олардың нақты құрылысы жоқ.
ҚЫЗЫЛ ФОСФОР
Слайд 16Шырпының басын қорапқа үйкегенде қызыл фосфор бертолле тұзынан от алып тез
Қалыпты жағдайда қызыл фосфор тұрақты
Слайд 17Қара фосфор атомдық құрылысы қатпарлы кристалдық тор түзеді. Сыртқы түрі графитке
ҚАРА ФОСФОР
Қара фосфор көп кездеседі.
Слайд 19
Р
АҒЗАЛАРДА
МИНЕРАЛДАР
ФОСФОЛИПИДТЕР,
ФЕРМЕНТТЕР,
КАЛЬЦИЙ ФОСФАТЫ
ЭФИРЛЕР
ОРТОФОСФОР
ҚЫШҚЫЛЫ
ТІСТЕ ЖӘНЕ СҮЙЕКТЕ
АПАТИТ
ФОСФОРИТ
БИРЮЗА
ТАБИҒАТТА КЕЗДЕСУІ
Слайд 22 Биолог: Фосфор адам және басқа тірі ағзалар тіршілігі үшін қажет элемент.
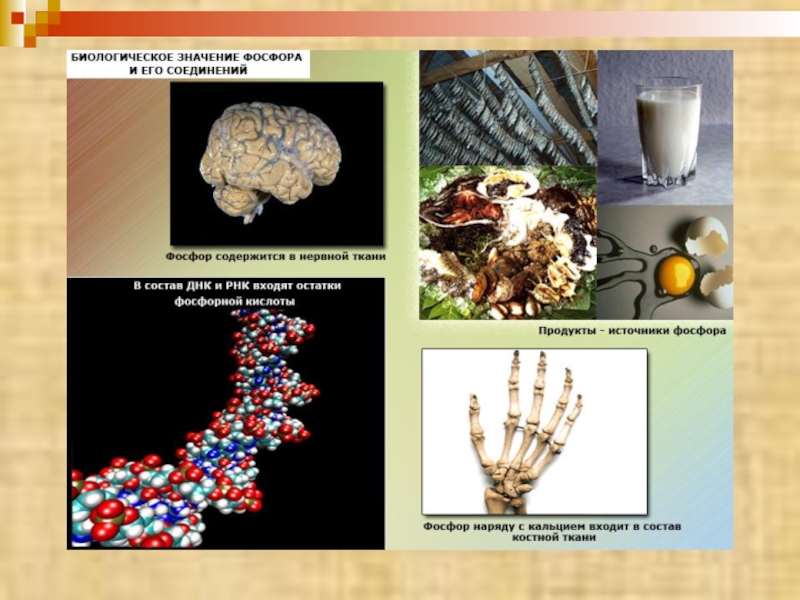
Слайд 24 Фосфордың биологиялық маңызы
Ересек адам үшін тәуліктік қажеттілік 1 грамм
Қаңқаның құрамына кіреді
Тістің құрамына енеді
Фосфордың қосылыстарын энергия алмасу кезінде қолданады
Бұлшықет және ақыл-ойды дамыту үшін қажет
Слайд 25 Агроном: Фосфор тыңайтқыштары егіс дақылдарында зерттелінді. Қаратау фосфоритінен жасалған поли және
Слайд 26ФОСФОР ТЫҢАЙТҚЫШТАРЫ:
Жай суперфосфат
Қос суперфосфат
Ca (H2 PO4)2 (40-50% P2O5)
Аммофостар
NH4H2 PO4
(NH4)2H PO4
Фосфоритті ұнтақ
Слайд 27 Дәрігер: Фосфор жануар мен адам сүйегінде, бұлшықетте, ми ұлпаларында болатыны анықталды.
Слайд 28Фосфордың артық және жетіспеген жағдайда ағзаға әсері
Жетіспесе Р
Слайд 29 Географ: Фосфордың жер қыртысындағы
Слайд 30Табиғаттағы фосфор
Фосфор табиғатта химиялық белсенділігіне байланысты тек қосылыс күйінде
Фосфор мына заттардың құрамына енеді:
фосфорит және апатит минералы,кальций фосфатының құрамында Ca3 (PO4)2;
Қазақстанда фосфорға өте бай ірі кен орындары бар.Олар:Ақтөбе,Оңтүстік Қазақстан,Жамбыл облыстары.
өсімдіктердің генеративті мүшелеріндегі нәруыздың құрамына кіреді;
адам және жануарлардың ағзасындағы жүйке жүйесі мен жұлында болады ;
Ми жасушаларында болады.
Слайд 31Химик: Фосфор - тыңайтқыш, дәрі - дәрмек, улы химикаттар, сіріңке дайындау
Слайд 32Алынуы
Бос күйіндегі фосфорды алу үшін фосфориттер мен апатиттерден ауа
Са3(РО4)2+5С+3SiO2 t 3CaSiO3+2P+5CO
Бөлінген фосфорды су астында ақ фосфор Р4 түрінде бөліп алады.
Слайд 33Химиялық қасиеттері
Ақ фосфорды ауасыз ұзақ уақыт қыздырса,ол сарғаяды
Фосфор тотықтырғыш (азоттан төмен) және тотықсыздандырғыш қасиет көрсетеді.
Фосфор – тотықсыздандырғыш:
5О2 (артық) + 4Р = 2Р2О5
3О2 (аз) + 4Р = 2Р2О3
3Сl2 + 2P = 2PCl3
PСl3 + Cl2 = PCl5
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
4P + 16H2O = 4H3PO4 + 10H2
Фосфор –тотықтырғыш:
2Р + 3Mg = Mg3P2
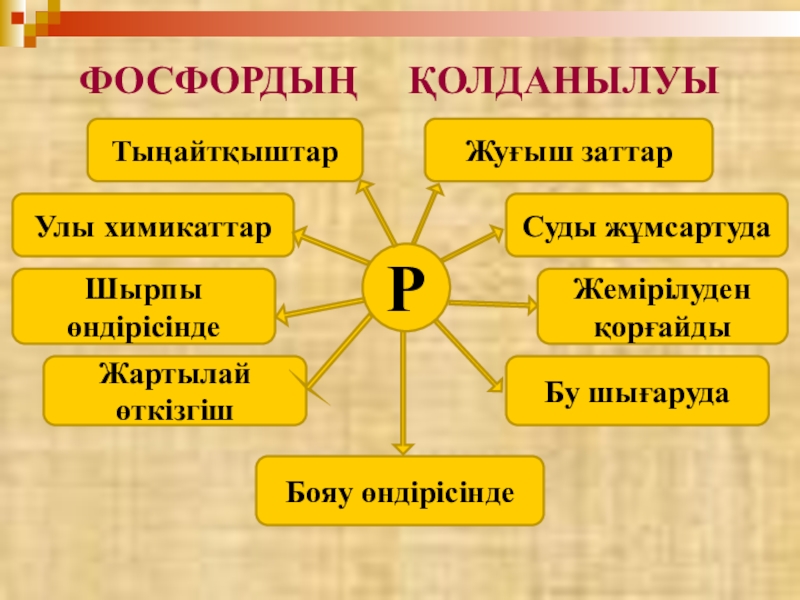
Слайд 34ФОСФОРДЫҢ ҚОЛДАНЫЛУЫ
Тыңайтқыштар
Р
Жуғыш заттар
Улы химикаттар
Суды жұмсартуда
Шырпы өндірісінде
Жемірілуден қорғайды
Жартылай өткізгіш
Бу шығаруда
Бояу
Слайд 36
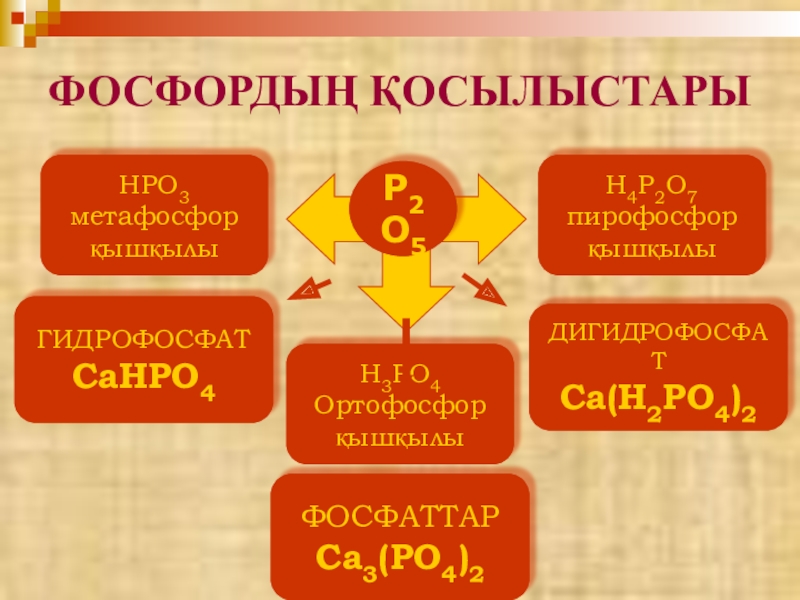
ФОСФОРДЫҢ ҚОСЫЛЫСТАРЫ
Р2O5
HPO3
метафосфор
қышқылы
H4P2O7
пирофосфор
қышқылы
H3PO4
Ортофосфор
қышқылы
ФОСФАТТАР
Ca3(PO4)2
ГИДРОФОСФАТ
CaНPO4
ДИГИДРОФОСФАТ
Ca(Н2PO4)2
Слайд 38Фосфордың азот қышқылымен әрекеттесу реакциясы:
P(қатты.) + 5HNO3 (конц.) = 2H3PO4
Фосформен жұмыс кезінде қауіпсіздік ережесін қатаң түрде ескеру керек. Себебі ақ фосфор және оның қосылыстары өте улы.
Слайд 39Химиялық қасиеттері P2O5
Қышқылдық қасиет кқрсетеді.
1) Сумен әрекеттеседі:
P2O5 + 3H2O t 2H3PO4
2) Негіздік оксидтермен әрекеттеседі:
P2O5 + 3К2O 2К3РО4
3) Сілтілермен әрекеттеседі:
P2O5 + 6NaOH 2Na3РО4 + 3H2O
Слайд 43Металдармен
Негіздермен
Металдардың
оксидтерімен
Тұздармен
H3PO4
ОРТОФОСФОР ҚЫШҚЫЛЫ МЫНА ЗАТТАРМЕН ӘРЕКЕТТЕСЕДІ:
Слайд 44Молекула құрылысы
Н-О – Р О Н О Р О
Н-О Н О
құрылымдық электрондық
формула формула
Фосфор қышқылы тотықтырғыш бола алмайды және қыздыру кезінде айырылмайды.Себебі оның тотығу дәрежесі +5 тұрақты болып келеді.
Слайд 45 Бөлме температурасында инертті. Температураны жоғарылатқанда көптеген металдармен әрекеттеседі.
2H3PO4+3Mg =Mg3(PO4)2+3H2
Металдармен
H3PO4
Слайд 46 Бөлме температурасында инертті. Температураны жоғарылатқанда көптеген металл оксидтерімен әрекеттеседі.
2H3PO4+3CaO=Ca3(PO4)2+3H2O
H3PO4
Металдардың
оксидтерімен
Слайд 47 Фосфор қышқылы әлсіз қышқылдардың қатарына жатады.Оны бейтарап алып, мысалы,
H3PO4+ NaOH=NaH2PO4+ H2O
H3PO4
Негіздермен
H3PO4+2NaOH=Na2HPO4+2H2O
Слайд 48Фосфор қышқылы әртүрлі тұздармен әрекеттеседі. Фосфор қышқылын және оның тұздарын күміс
2H3PO4+3Na2СO3=2Na3PO4+3СО2+3H2O
H3PO4
Тұздармен
H3PO4+3AgNO3=Ag3PO4↓+3HNO3
Слайд 50Фосфор қышқылының тұздары 3ке бөлінеді
1) фосфаттар
Фосфор қышқылындағы сутек атомдарының орнын
К3РО4 - калий фосфаты
(NH4)3PO4 - аммоний фосфаты
3КОН + H3PO4 К3РО4 + 3H2О
Сілтілік металдардың фосфаты суда жақсы ериді.
2) гидрофосфаттар
Қышқылдағы екі атом сутектің орнын басады
К2НРО4 – калий гидрофосфаты
(NН4)2НРО4 – аммоний гидрофосфат
2КОН + Н3РО4 К2НРО4 + 2Н2О
артық
Суда аз ериді (натрий ,калий және аммоний фосфатынан басқа).
3) дигидрофосфаттар
қышқылдағы тек бір атом сутектің орнын басады
КН2РО4 – калий дигидрофосфаты
NН4Н2РО4 – аммоний дигидрофосфаты
КОН + H3PO4 КН2РО4 + H2О
артық
Көптеген дигидрофосфаттар суда жақсы ериді.
Слайд 52Фосфор,ағзалық элемент ретінде
Негізгі тіршілік жүйесі үшін тек
Қорытынды:
Слайд 53 Қорытынды
Фосфор қышқылы – ақ түсті, кристалл зат,сумен кез келген жағдайда
Қышқылдарға тән ортақ қасиет көрсетеді .
Спецификалық қосылыстар түзеді.
Үш түрлі тұздар қатарын түзеді: фосфаттар,гидрофосфаттар, дигидрофосфаттар.
Слайд 54Фосфордың маңызы
Фосфор адам қаңқасы мен тістің негізгі
Слайд 56Фосфор қышқылы, фосфор (Ү) оксиді, калий фосфаты, натрий фосфаты және кальций
Кім жүйрік әрі математик
Слайд 57242 беттегі №6,9 есептер
Са3(РО 4)2---- Р---Р2О5----Н3РО4-----СаНРО4-----Са3(РО4)2
Кальций фосфаты--- фосфор---- Фосфор (Ү)
--- кальций гидрофосфаты ----- кальций фосфаты