- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Амины+Аминокислоты, 2010 год, но хорошие материалы
Содержание
- 1. Амины+Аминокислоты, 2010 год, но хорошие материалы
- 2. Амины — органические соединения, производные аммиака, в молекуле
- 3. К названию органических остатков, связанных с азотом,
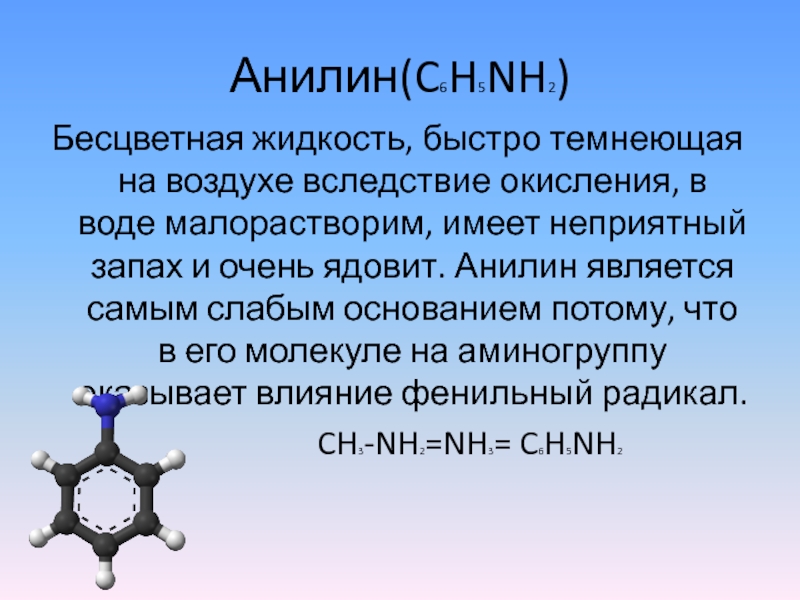
- 4. Анилин(C6H5NH2)Бесцветная жидкость, быстро темнеющая на воздухе вследствие
- 5. Слайд 5
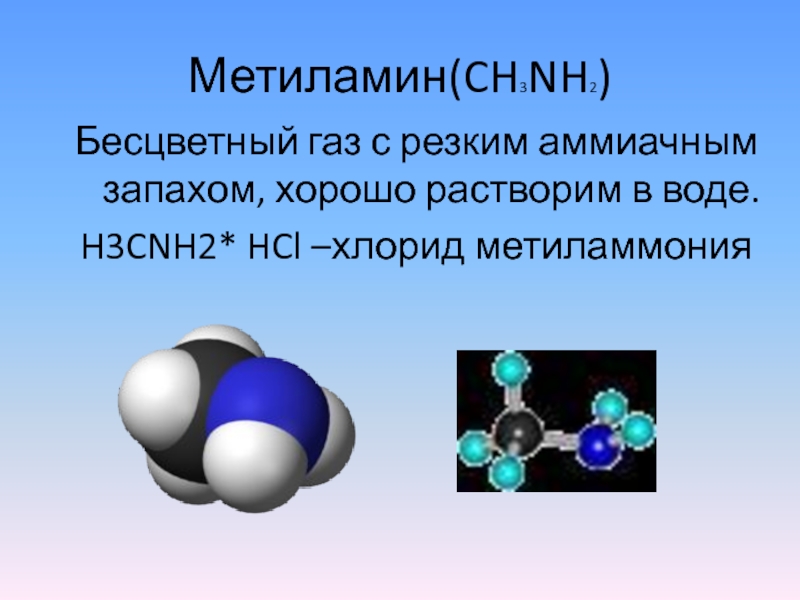
- 6. Метиламин(CH3NH2)Бесцветный газ с резким аммиачным запахом, хорошо растворим в воде.H3CNH2* HCl –хлорид метиламмония
- 7. Химические свойстваВзаимодействуют с щелочами:C2H5NH2 + H2O →
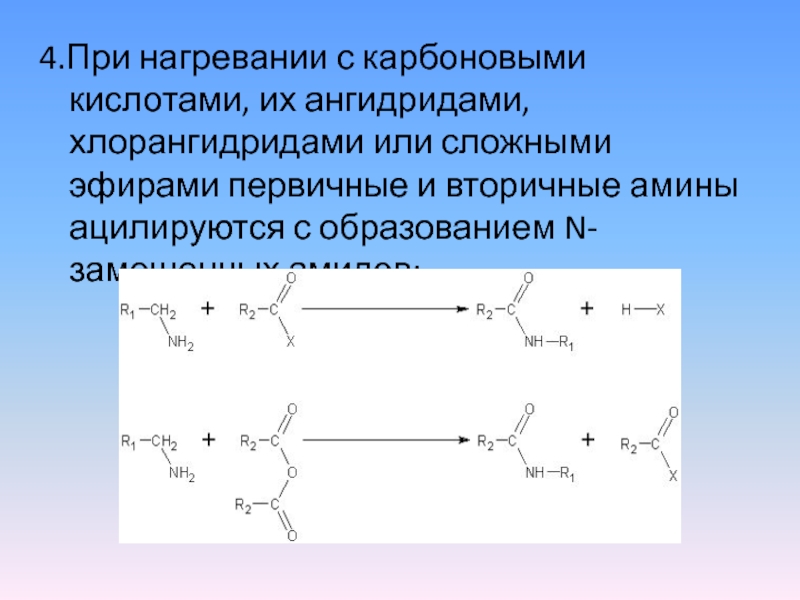
- 8. 4.При нагревании с карбоновыми кислотами, их ангидридами,
- 9. 5.Первичные и вторичные амины взаимодействуют с азотистой
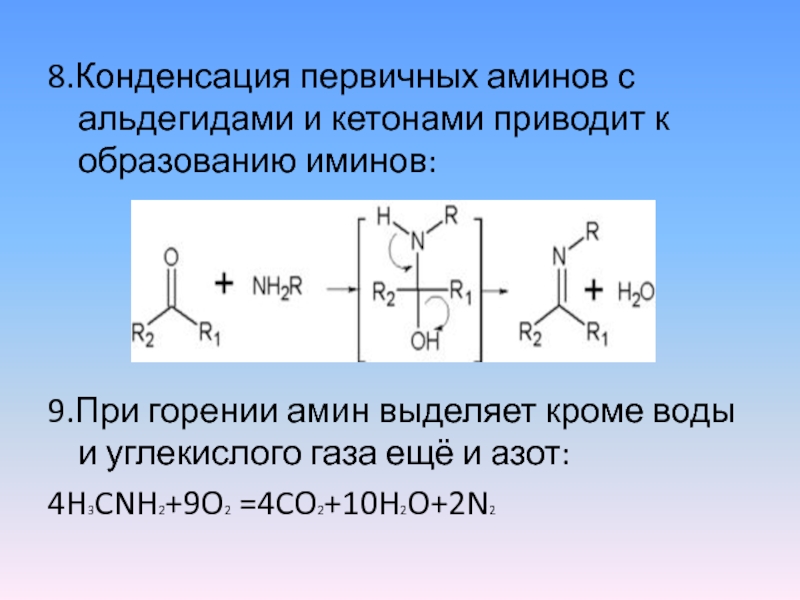
- 10. 8.Конденсация первичных аминов с альдегидами и кетонами
- 11. ПолучениеВосстановление азотсодержащих соединений:реакция Зинина(в промышленности)C6H5NO2 + 3(NH4)2S
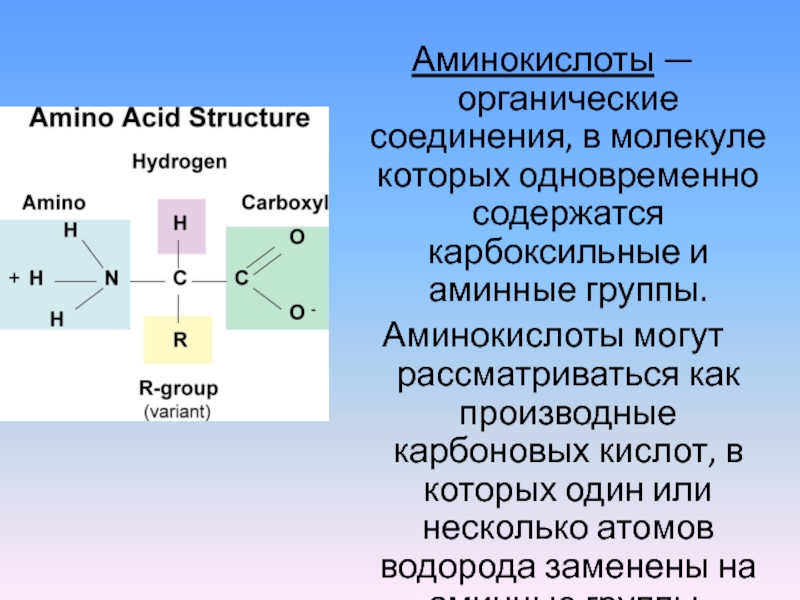
- 12. Аминокислоты — органические соединения, в молекуле которых
- 13. Химические свойстваВзаимодействуют с основаниями, образуя соль и
- 14. Реакция поликонденсации аминокислот имеет не
- 15. Аминокислоты и их производные используют в качестве
Амины — органические соединения, производные аммиака, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.
Слайд 2Амины — органические соединения, производные аммиака, в молекуле которого один, два или
три атома водорода замещены на углеводородные радикалы.
Слайд 3К названию органических остатков, связанных с азотом, добавляют слово «амин», упоминая
группы в алфавитном порядке: CH3NHC3Н7 — метилпропиламин, CH3N(С6Н5)2 — метилдифениламин.
Для высших аминов название составляется, взяв за основу углеводород, с прибавлением приставки «амино», «диамино», «триамино», указывая числовой индекс атома углерода:
2-аминопентан
Для высших аминов название составляется, взяв за основу углеводород, с прибавлением приставки «амино», «диамино», «триамино», указывая числовой индекс атома углерода:
2-аминопентан
Слайд 4Анилин(C6H5NH2)
Бесцветная жидкость, быстро темнеющая на воздухе вследствие окисления, в воде малорастворим,
имеет неприятный запах и очень ядовит. Анилин является самым слабым основанием потому, что в его молекуле на аминогруппу оказывает влияние фенильный радикал.
CH3-NH2=NH3= C6H5NH2
CH3-NH2=NH3= C6H5NH2
Слайд 6Метиламин(CH3NH2)
Бесцветный газ с резким аммиачным запахом, хорошо растворим в воде.
H3CNH2* HCl
–хлорид метиламмония
Слайд 7Химические свойства
Взаимодействуют с щелочами:
C2H5NH2 + H2O → [C2H5NH3]+ + OH-
2.Взаимодействуя с
кислотами, амины образуют алкиламиновые соли:
RNH2 + HCl → [RNH3]Cl-
3.Амины присоединяют галогеналканы RCl, с образованием донорно-акцепторной связи N-R
RNH2 + HCl → [RNH3]Cl-
3.Амины присоединяют галогеналканы RCl, с образованием донорно-акцепторной связи N-R
Слайд 84.При нагревании с карбоновыми кислотами, их ангидридами, хлорангидридами или сложными эфирами
первичные и вторичные амины ацилируются с образованием N-замещенных амидов:
Слайд 95.Первичные и вторичные амины взаимодействуют с азотистой кислотой:
C2H5NH2 + HNO2 →
C2H5OH + N2 +H2O
6.Вторичные амины образуют с азотистой кислотой желтые, трудно растворимые нитрозамины — соединения
(C2H5)2NH + HNO2 → (C2H5)2N-N=O + H2O
7.Третичные амины при обычной температуре с азотистой кислотой не реагируют
6.Вторичные амины образуют с азотистой кислотой желтые, трудно растворимые нитрозамины — соединения
(C2H5)2NH + HNO2 → (C2H5)2N-N=O + H2O
7.Третичные амины при обычной температуре с азотистой кислотой не реагируют
Слайд 108.Конденсация первичных аминов с альдегидами и кетонами приводит к образованию иминов:
9.При
горении амин выделяет кроме воды и углекислого газа ещё и азот:
4H3CNH2+9O2 =4CO2+10H2O+2N2
4H3CNH2+9O2 =4CO2+10H2O+2N2
Слайд 11Получение
Восстановление азотсодержащих соединений:
реакция Зинина(в промышленности)
C6H5NO2 + 3(NH4)2S → C6H5NH2 + 6NH3
+ 3S + 2H2O
нитрилов, оксимов, амидов.
Алкилирование аммиака (реакция Гофмана)
нитрилов, оксимов, амидов.
Алкилирование аммиака (реакция Гофмана)
Слайд 12Аминокислоты — органические соединения, в молекуле которых одновременно содержатся карбоксильные и
аминные группы.
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы.
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы.
Слайд 13Химические свойства
Взаимодействуют с основаниями, образуя соль и воду:
Как карбоновые кислоты, они
взаимодействуют со спиртами, образую сложные эфиры:
Как основания, они реагируют с кислотами, образую соли:
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков и нейлона-66
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Как основания, они реагируют с кислотами, образую соли:
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков и нейлона-66
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Слайд 14 Реакция поликонденсации аминокислот имеет не только большое биологическое значение,
но также и важное народнохозяйственное значение. Аминокислоты и их производные используют многие отросли промышленности:
пищевая,
медицинская,
микробиологическая,
химическая.
пищевая,
медицинская,
микробиологическая,
химическая.
Слайд 15Аминокислоты и их производные используют в качестве лекарственных средств в медицине,
например глицин в таблетках, лизин, метионин.




![Амины+Аминокислоты, 2010 год, но хорошие материалы Химические свойстваВзаимодействуют с щелочами:C2H5NH2 + H2O → [C2H5NH3]+ + OH-2.Взаимодействуя с Химические свойстваВзаимодействуют с щелочами:C2H5NH2 + H2O → [C2H5NH3]+ + OH-2.Взаимодействуя с кислотами, амины образуют алкиламиновые соли: RNH2](/img/thumbs/3faf4319865f7415bd438f6aeeecdb3a-800x.jpg)