- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Амины. Перед белками вспоминаем
Содержание
- 1. Амины. Перед белками вспоминаем
- 2. ОпределениеАминокислоты (аминокарбоновые кислоты) — органические соединения, в
- 3. Общие химические свойства1. Аминокислоты могут проявлять как
- 4. Общие химические свойстваЦвиттер-ионом называют молекулу аминокислоты, в
- 5. Общие химические свойстваНекоторые аминокислоты имеют несколько аминогрупп
- 6. Общие химические свойства2. Изоэлектрической точкой аминокислоты называют
- 7. Общие химические свойства3. Важной особенностью аминокислот является
- 8. Оптическая изомерияВсе входящие в состав живых организмов
- 9. Оптическая изомерияДанную особенность «живых» аминокислот весьма трудно
- 10. D-аминокислоты в живых организмахОптические изомеры аминокислот претерпевают
- 11. D-аминокислоты в живых организмахВ состав некоторых пептидов
- 12. D-аминокислоты в живых организмахСходным образом образуются пептидные
- 13. Классификация стандартных аминокислотПо R-группам:Неполярные: аланин, валин, изолейцин,
- 14. Классификация стандартных аминокислотПо функциональным группам:Алифатические Моноаминомонокарбоновые: аланин,
- 15. По аминоацил-тРНК-синтетазамКласс I:лейцин, изолейцин, валин, цистеин, метионин,
ОпределениеАминокислоты (аминокарбоновые кислоты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы.
Слайд 2Определение
Аминокислоты (аминокарбоновые кислоты) — органические соединения, в молекуле которых одновременно содержатся
карбоксильные и аминные группы.
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы.
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы.
Слайд 3Общие химические свойства
1. Аминокислоты могут проявлять как кислотные свойства, обусловленные наличием
в их молекулах карбоксильной группы -COOH, так и основные свойства, обусловленные аминогруппой -NH2. Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов.
Слайд 4Общие химические свойства
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в
виде -NH3+, а карбоксигруппа — в виде -COO-. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Слайд 5Общие химические свойства
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для
этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
Слайд 6Общие химические свойства
2. Изоэлектрической точкой аминокислоты называют значение pH, при котором
максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
Слайд 7Общие химические свойства
3. Важной особенностью аминокислот является их способность к поликонденсации,
приводящей к образованию полиамидов, в том числе пептидов, белков и нейлона-66.
4. Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
4. Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
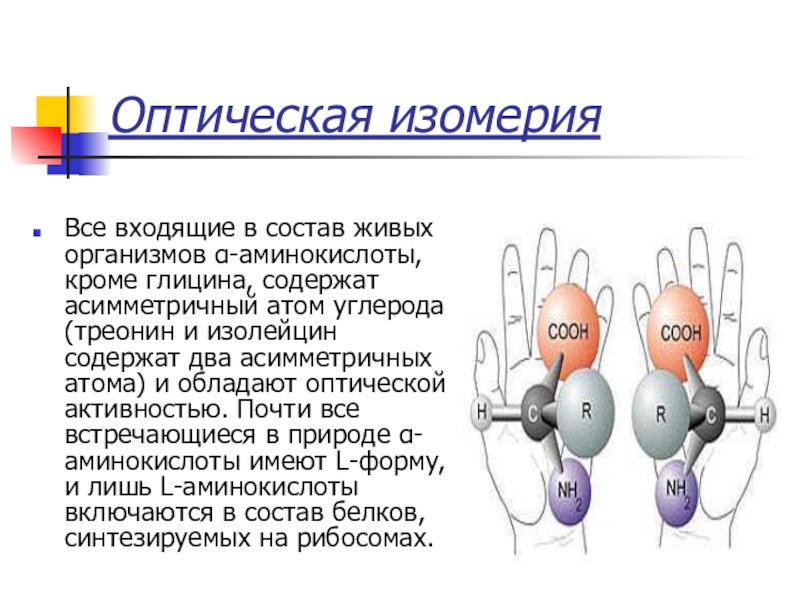
Слайд 8Оптическая изомерия
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат
асимметричный атом углерода (треонин и изолейцин содержат два асимметричных атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-форму, и лишь L-аминокислоты включаются в состав белков, синтезируемых на рибосомах.
Слайд 9Оптическая изомерия
Данную особенность «живых» аминокислот весьма трудно объяснить, так как в
реакциях между оптически неактивными веществами или рацематами (которыми, видимо, были представлены органические молекулы на древней Земле) L и D-формы образуются в одинаковых количествах. Возможно. выбор одной из форм (L или D) — просто результат случайного стечения обстоятельств: первые молекулы, с которых смог начаться матричный синтез, обладали определенной формой, и именно к ним "приспособились" соответствующие ферменты.
Слайд 10D-аминокислоты в живых организмах
Оптические изомеры аминокислот претерпевают медленную самопроизвольную неферментативную рацемизацию.
Например, в белке дентине (входит в состав зубов) L-аспартат переходит в D-форму со скоростью 0,1 % в год, что может быть использовано для определения возраста биологических объектов.
С развитием следового аминокислотного анализа D-аминокислоты были обнаружены сначала в составе клеточных стенок некоторых бактерий (1966), а затем и в тканях высших организмов. Так, D-аспартат и D-метионин предположительно являются нейромедиаторами у млекопитающих.
С развитием следового аминокислотного анализа D-аминокислоты были обнаружены сначала в составе клеточных стенок некоторых бактерий (1966), а затем и в тканях высших организмов. Так, D-аспартат и D-метионин предположительно являются нейромедиаторами у млекопитающих.
Слайд 11D-аминокислоты в живых организмах
В состав некоторых пептидов входят D-аминокислоты, образующиеся при
посттрансляционной модификации. Например, D-метионин и D-аланин входят в состав опиоидных гептапептидов кожи южноамериканских амфибий филломедуз (дерморфина, дермэнкефалина и делторфинов). Наличие D-аминокислот определяет высокую биологическую активность этих пептидов как анальгетиков.
Сходным образом образуются пептидные антибиотики бактериального происхождения, действующие против грамположительных бактерий — низин , субтилин и эпидермин.
Сходным образом образуются пептидные антибиотики бактериального происхождения, действующие против грамположительных бактерий — низин , субтилин и эпидермин.
Слайд 12D-аминокислоты в живых организмах
Сходным образом образуются пептидные антибиотики бактериального происхождения, действующие
против грамположительных бактерий — низин , субтилин и эпидермин.
Гораздо чаще D-аминокислоты входят в состав пептидов и их производных, образующихся путем нерибосомного синтеза в клетках грибов и бактерий. Видимо. в этом случае исходным материалом для синтеза служат также L-аминокислоты. которые изомеризуются одной из субъединиц ферментного комплекса, осуществляющего синтез пептида.
Гораздо чаще D-аминокислоты входят в состав пептидов и их производных, образующихся путем нерибосомного синтеза в клетках грибов и бактерий. Видимо. в этом случае исходным материалом для синтеза служат также L-аминокислоты. которые изомеризуются одной из субъединиц ферментного комплекса, осуществляющего синтез пептида.
Слайд 13Классификация стандартных аминокислот
По R-группам:
Неполярные: аланин, валин, изолейцин, лейцин, метионин, пролин, триптофан,
фенилаланин, глицин;
Полярные незаряженные (заряды скомпенсированы) при pH=7: аспарагин, глутамин, серин, тирозин, треонин, цистеин;
Полярные заряженные отрицательно при pH=7: аспарагиновая кислота, глутаминовая кислота;
Полярные заряженные положительно при pH=7: аргинин, гистидин, лизин.
Полярные незаряженные (заряды скомпенсированы) при pH=7: аспарагин, глутамин, серин, тирозин, треонин, цистеин;
Полярные заряженные отрицательно при pH=7: аспарагиновая кислота, глутаминовая кислота;
Полярные заряженные положительно при pH=7: аргинин, гистидин, лизин.
Слайд 14Классификация стандартных аминокислот
По функциональным группам:
Алифатические
Моноаминомонокарбоновые: аланин, валин, глицин, изолейцин, лейцин;
Оксимоноаминокарбоновые:
серин, треонин;
Моноаминодикарбоновые: аспарагиновая кислота, глутаминовая кислота, за счёт второй карбоксильной группы несут в растворе отрицательный заряд;
Амиды Моноаминодикарбоновых: аспарагин, глутамин;
Диаминомонокарбоновые: аргинин, гистидин, лизин, несут в растворе положительный заряд;
Серосодержащие: цистеин (цистин), метионин;
Ароматические: фенилаланин, тирозин;
Гетероциклические: триптофан, гистидин, пролин (также входит в группу иминокислот);
Иминокислоты: пролин (также входит в группу гетероциклических).
Моноаминодикарбоновые: аспарагиновая кислота, глутаминовая кислота, за счёт второй карбоксильной группы несут в растворе отрицательный заряд;
Амиды Моноаминодикарбоновых: аспарагин, глутамин;
Диаминомонокарбоновые: аргинин, гистидин, лизин, несут в растворе положительный заряд;
Серосодержащие: цистеин (цистин), метионин;
Ароматические: фенилаланин, тирозин;
Гетероциклические: триптофан, гистидин, пролин (также входит в группу иминокислот);
Иминокислоты: пролин (также входит в группу гетероциклических).
Слайд 15По аминоацил-тРНК-синтетазам
Класс I:
лейцин, изолейцин, валин, цистеин, метионин, аргинин, глутаминовая кислота, глутамин,
тирозин;
Класс II:
аланин, глицин, пролин, гистидин, треонин, серин, аспарагин, аспарагиновая кислота, лизин, фенилаланин.
Класс II:
аланин, глицин, пролин, гистидин, треонин, серин, аспарагин, аспарагиновая кислота, лизин, фенилаланин.