- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Амины. Материалы к уроку. 2009 год
Содержание
- 1. Амины. Материалы к уроку. 2009 год
- 2. ЧТО ТАКОЕ АМИНЫАми́ны — органические соединения, производные аммиака —
- 3. По числу замещённых атомов водорода различают соответственно
- 4. НОМЕНКЛАТУРАК названию органических остатков, связанных с азотом,
- 5. ХИМИЧЕСКИЕ СВОЙСТВА Амины, являясь производными аммиака, имеют
- 6. Водные растворы алифатических аминов проявляют щелочную реакцию,
- 7. Слайд 7
- 8. Первичные и вторичные амины взаимодействуют с азотистой
- 9. ПОЛУЧЕНИЕ АМИНОВВосстановление азотсодержащих соединений: нитросоединений(реакция Зинина). Эту
- 10. Некоторые известные аминыДиэтиламин Триэтиламин Пропиламин Этилендиамин Пропилендиамин
- 11. Вредность аминов Амины являются очень
- 12. ПРИМЕНЕНИЕ АМИНОВВ химической промышленности, для производства красителей,
ЧТО ТАКОЕ АМИНЫАми́ны — органические соединения, производные аммиака — органические соединения, производные аммиака, в молекуле — органические соединения, производные аммиака, в молекуле которого один, два или три атома — органические соединения, производные аммиака, в молекуле которого один, два или три
Слайд 2ЧТО ТАКОЕ АМИНЫ
Ами́ны — органические соединения, производные аммиака — органические соединения, производные аммиака,
в молекуле — органические соединения, производные аммиака, в молекуле которого один, два или три атома — органические соединения, производные аммиака, в молекуле которого один, два или три атома водорода — органические соединения, производные аммиака, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.
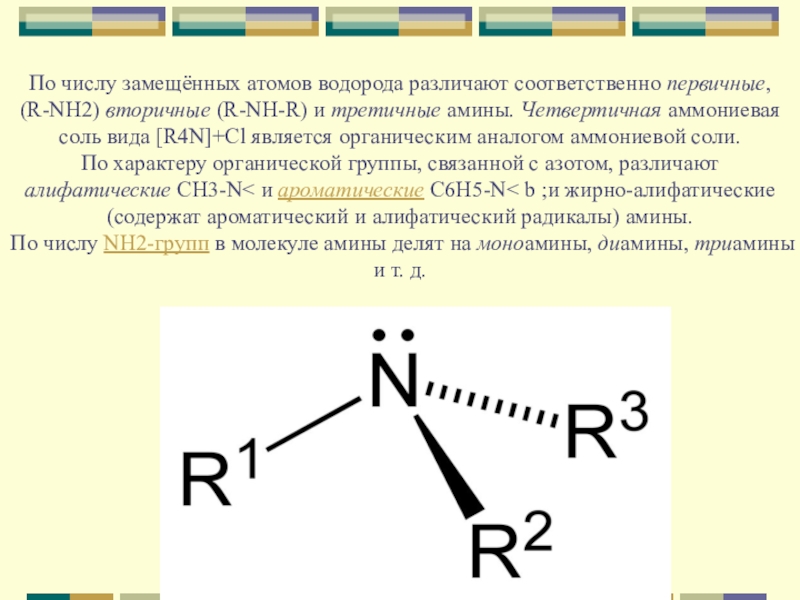
Слайд 3По числу замещённых атомов водорода различают соответственно первичные, (R-NH2) вторичные (R-NH-R)
и третичные амины. Четвертичная аммониевая соль вида [R4N]+Cl является органическим аналогом аммониевой соли.
По характеру органической группы, связанной с азотом, различают алифатические CH3-N< и ароматические С6H5-N< b ;и жирно-алифатические (содержат ароматический и алифатический радикалы) амины.
По числу NH2-групп в молекуле амины делят на моноамины, диамины, триамины и т. д.
Слайд 4НОМЕНКЛАТУРА
К названию органических остатков, связанных с азотом, добавляют слово «амин», при
этом группы упоминают в алфавитном порядке: CH3NHC3Н7 — метилпропиламин, CH3N(С6Н5)2 — метилдифениламин. Для высших аминов название составляется, взяв за основу углеводород, прибавлением приставки «амино», «диамино», «триамино», указывая числовой индекс атома углерода:
2-аминопентан
Для некоторых аминов используются тривиальные названия: С6Н5NH2 — анилин (систематическое название — фениламин).
2-аминопентан
Для некоторых аминов используются тривиальные названия: С6Н5NH2 — анилин (систематическое название — фениламин).
Слайд 5ХИМИЧЕСКИЕ СВОЙСТВА
Амины, являясь производными аммиака, имеют сходное с ним строение
и проявляют подобные ему свойства. Для них также характерно образование донорно-акцепторной связи. Азот предоставляет неподеленную электронную пару, исполняя роль донора. В качестве акцептора электоронов может выступать, например, протон Н+, образуя ион R3NH+. Возникшая ковалентная связь N-H полностью эквивалентна остальным связям N-H в амине.
Алкиламины являются сильными основаниями, ариламины менее основны.
Алкиламины являются сильными основаниями, ариламины менее основны.
Слайд 6Водные растворы алифатических аминов проявляют щелочную реакцию, так как при их
взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония:
C2H5NH2 + H2O → [C2H5NH3]+ + OH-
Взаимодействуя с кислотами, амины образуют алкиламиновые соли, в большинстве случаев растворимые в воде. Например, амины присоединяют галогеноводороды:
RNH2 + HCl → [RNH3]Cl-
Амины присоединяют галогеналканы RCl, с образованием донорно-акцепторной связи N-R, которая также эквивалентна уже имеющимся.
При нагревании с карбоновыми кислотамиПри нагревании с карбоновыми кислотами, их ангидридамиПри нагревании с карбоновыми кислотами, их ангидридами, хлорангидридамиПри нагревании с карбоновыми кислотами, их ангидридами, хлорангидридами или сложными эфирамиПри нагревании с карбоновыми кислотами, их ангидридами, хлорангидридами или сложными эфирами первичные и вторичные амины ацилируются с образованием N-замещенных амидов, соединений с фрагментом -С(О)N<:
C2H5NH2 + H2O → [C2H5NH3]+ + OH-
Взаимодействуя с кислотами, амины образуют алкиламиновые соли, в большинстве случаев растворимые в воде. Например, амины присоединяют галогеноводороды:
RNH2 + HCl → [RNH3]Cl-
Амины присоединяют галогеналканы RCl, с образованием донорно-акцепторной связи N-R, которая также эквивалентна уже имеющимся.
При нагревании с карбоновыми кислотамиПри нагревании с карбоновыми кислотами, их ангидридамиПри нагревании с карбоновыми кислотами, их ангидридами, хлорангидридамиПри нагревании с карбоновыми кислотами, их ангидридами, хлорангидридами или сложными эфирамиПри нагревании с карбоновыми кислотами, их ангидридами, хлорангидридами или сложными эфирами первичные и вторичные амины ацилируются с образованием N-замещенных амидов, соединений с фрагментом -С(О)N<:
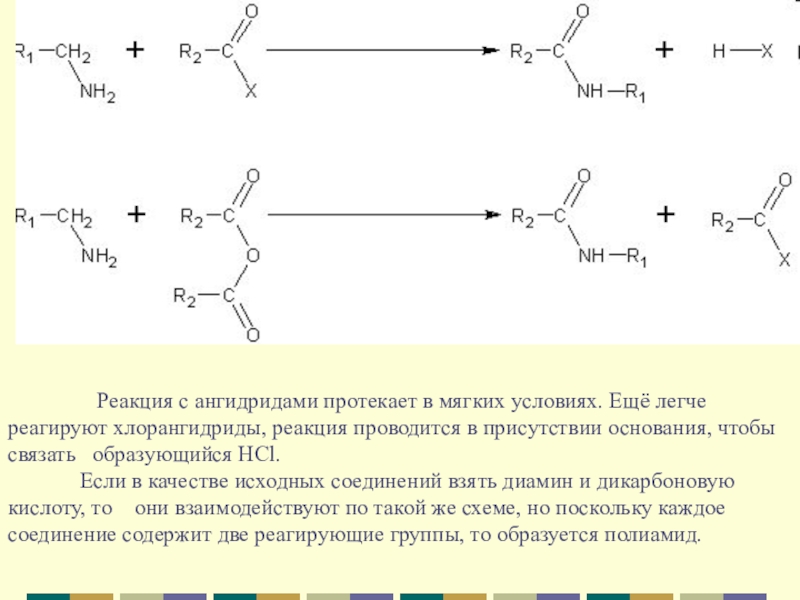
Слайд 7 Реакция
с ангидридами протекает в мягких условиях. Ещё легче реагируют хлорангидриды, реакция проводится в присутствии основания, чтобы связать образующийся HCl.
Если в качестве исходных соединений взять диамин и дикарбоновую кислоту, то они взаимодействуют по такой же схеме, но поскольку каждое соединение содержит две реагирующие группы, то образуется полиамид.
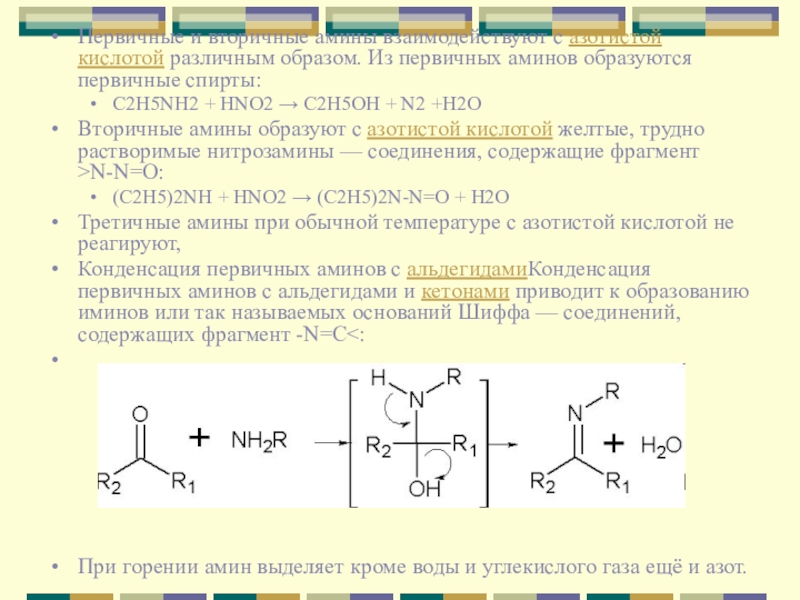
Слайд 8Первичные и вторичные амины взаимодействуют с азотистой кислотой различным образом. Из
первичных аминов образуются первичные спирты:
C2H5NH2 + HNO2 → C2H5OH + N2 +H2O
Вторичные амины образуют с азотистой кислотой желтые, трудно растворимые нитрозамины — соединения, содержащие фрагмент >N-N=O:
(C2H5)2NH + HNO2 → (C2H5)2N-N=O + H2O
Третичные амины при обычной температуре с азотистой кислотой не реагируют,
Конденсация первичных аминов с альдегидамиКонденсация первичных аминов с альдегидами и кетонами приводит к образованию иминов или так называемых оснований Шиффа — соединений, содержащих фрагмент -N=C<:
При горении амин выделяет кроме воды и углекислого газа ещё и азот.
C2H5NH2 + HNO2 → C2H5OH + N2 +H2O
Вторичные амины образуют с азотистой кислотой желтые, трудно растворимые нитрозамины — соединения, содержащие фрагмент >N-N=O:
(C2H5)2NH + HNO2 → (C2H5)2N-N=O + H2O
Третичные амины при обычной температуре с азотистой кислотой не реагируют,
Конденсация первичных аминов с альдегидамиКонденсация первичных аминов с альдегидами и кетонами приводит к образованию иминов или так называемых оснований Шиффа — соединений, содержащих фрагмент -N=C<:
При горении амин выделяет кроме воды и углекислого газа ещё и азот.
Слайд 9ПОЛУЧЕНИЕ АМИНОВ
Восстановление азотсодержащих соединений:
нитросоединений(реакция Зинина).
Эту реакцию впервые осуществил Н. Н. Зинин
в 1842 г.. Действуя на нитробензол сульфидом аммония, он получил анилин:
C6H5NO2 + 3(NH4)2S → C6H5NH2 + 6NH3 + 3S + 2H2O
нитрилов, оксимов, амидов.
Алкилирование аммиака (реакция Гофмана)
C6H5NO2 + 3(NH4)2S → C6H5NH2 + 6NH3 + 3S + 2H2O
нитрилов, оксимов, амидов.
Алкилирование аммиака (реакция Гофмана)
Слайд 10Некоторые известные амины
Диэтиламин
Триэтиламин
Пропиламин
Этилендиамин
Пропилендиамин
1,1,3,3-Тетраметилгуанидин
Анилин
N-Метиланилин
N,N-Диметиланилин
N-Этиланилин
N,N-Диэтиланилин
Пиперидин
Пиридин
2-Пиколин
Хинолин
Морфолин
N-Метил-2-пиролидон
Слайд 11Вредность аминов
Амины являются очень токсичными веществами. Опасно как
вдыхание их паров, так и контакт с кожей. Амины, например анилин, способны всасываться сквозь кожу в кровь и нарушать функции гемоглобина, что может привести к летальному исходу.
Симптомами отравления крови амином являются посинение кончиков пальцев, носа, губ, одышка, учащенное дыхание и сердцебиение, потеря сознания.
В случае попадания амина на незащищенные участки кожи необходимо быстро и аккуратно, не увеличивая площадь поражения, очистить пораженный участок кожи ваткой, смоченной в спирте, вывести пострадавшего на свежий воздух, обратиться к врачу.
Симптомами отравления крови амином являются посинение кончиков пальцев, носа, губ, одышка, учащенное дыхание и сердцебиение, потеря сознания.
В случае попадания амина на незащищенные участки кожи необходимо быстро и аккуратно, не увеличивая площадь поражения, очистить пораженный участок кожи ваткой, смоченной в спирте, вывести пострадавшего на свежий воздух, обратиться к врачу.
Слайд 12ПРИМЕНЕНИЕ АМИНОВ
В химической промышленности, для производства красителей, в качестве добавки к
моторным топливам, в лабораторном практикуме и аналитической химии.
1919 г было обнаружено, что ароматические амины повышают детонационную стойкость топлив, и с тех пор опубликовано большое число работ об антидетонаторах на основе аминов. Многие ароматические амины (метиланилин, ксилидин, смесь анилина, метил- и диметиланилина) нашли применение в ряде стран. Большой практический интерес представляет совместное применение ароматических аминов с элементоорганическими антидетонаторами
для производства ингибиторов коррозии, фармацевтических препаратов, флотореагентов, средств защиты растений, бактерицидов, текстильновспомогательных веществ, моющих средств и др.
1919 г было обнаружено, что ароматические амины повышают детонационную стойкость топлив, и с тех пор опубликовано большое число работ об антидетонаторах на основе аминов. Многие ароматические амины (метиланилин, ксилидин, смесь анилина, метил- и диметиланилина) нашли применение в ряде стран. Большой практический интерес представляет совместное применение ароматических аминов с элементоорганическими антидетонаторами
для производства ингибиторов коррозии, фармацевтических препаратов, флотореагентов, средств защиты растений, бактерицидов, текстильновспомогательных веществ, моющих средств и др.