- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Амфотерные свойства оксида и гидроксида алюминия
Содержание
- 1. Амфотерные свойства оксида и гидроксида алюминия
- 2. Дать понятие об амфотерности;Рассмотреть свойства амфотерного оксида
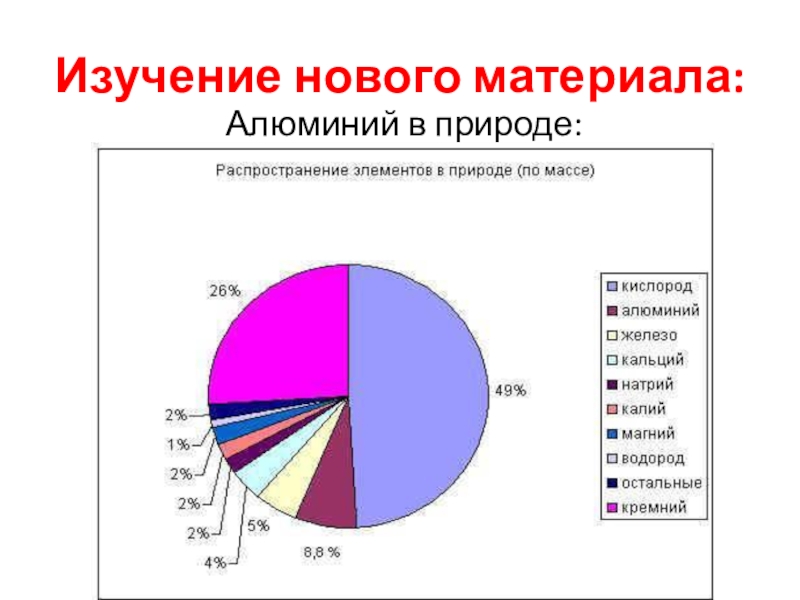
- 3. Изучение нового материала: Алюминий в природе:
- 4. Повторение изученного материала:Применение алюминия
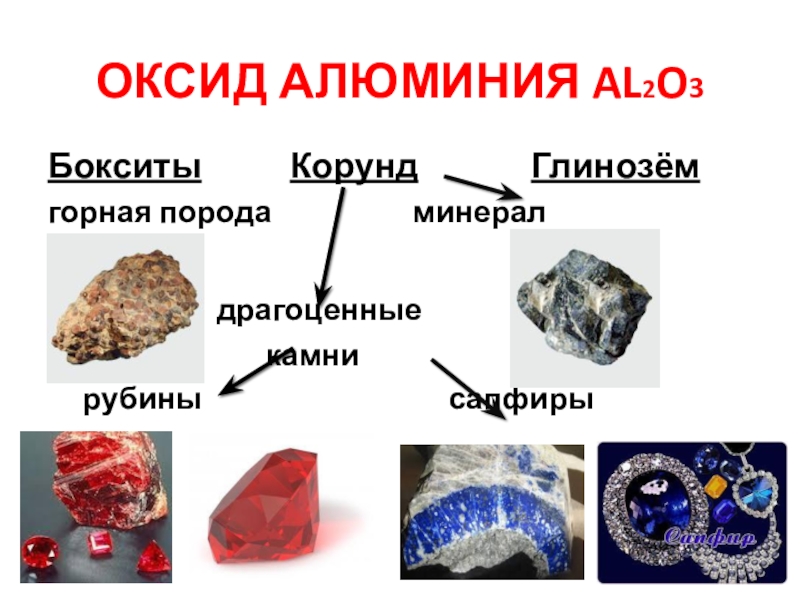
- 5. Оксид алюминия Al2O3Бокситы
- 6. В очищенном виде Al2O3 - белый тугоплавкий
- 7. Гидроксид алюминия Al(OH)3 белое гелеобразное вещество, нерастворимое
- 8. Получение гидроксида алюминияВ 2 пробирки налейте по
- 9. Доказательство амфотерности:1.Взаимодействие с кислотами В одну
- 10. Что наблюдали? Осадки гидроксида алюминия в обеих
- 11. Al(OH)3 + 3HCl = AlCl3 +3H2OAl(OH)3 +
- 12. Лабораторный опытОт перемены мест слагаемых сумма
- 13. Что наблюдали?В первой пробирке образовывался осадок, а
- 14. Генетический ряд алюминия. Осуществите превращения:
Дать понятие об амфотерности;Рассмотреть свойства амфотерного оксида и гидроксида алюминия;Повторить, закрепить и развить знания о классификации и свойствах гидроксидов и о генетической связи между классами веществ.Цели урока:
Слайд 2Дать понятие об амфотерности;
Рассмотреть свойства амфотерного оксида и гидроксида алюминия;
Повторить, закрепить
и развить знания о классификации и свойствах гидроксидов и о генетической связи между классами веществ.
Цели урока:
Слайд 5Оксид алюминия Al2O3
Бокситы Корунд
Глинозём
горная порода минерал
драгоценные
камни
рубины сапфиры
горная порода минерал
драгоценные
камни
рубины сапфиры
Слайд 6В очищенном виде Al2O3 -
белый тугоплавкий порошок, температура плавления 2044°С,
температура кипения 3530°С, плотность 4 г/см3, по твердости близок к алмазу.
Получают:
1) 4Al + 3O2 = 2 Al2O3
2) 2Al(OH)3 = Al2O3 + 3H2O
Химические свойства:
Al2O3 + 6HCl = 2AlCl3 + 3H2O;
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Al2O3 + 2NaOH = 2NaAlO2 + H2O;
Проявляет амфотерные свойства
Получают:
1) 4Al + 3O2 = 2 Al2O3
2) 2Al(OH)3 = Al2O3 + 3H2O
Химические свойства:
Al2O3 + 6HCl = 2AlCl3 + 3H2O;
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Al2O3 + 2NaOH = 2NaAlO2 + H2O;
Проявляет амфотерные свойства
Слайд 7Гидроксид алюминия Al(OH)3
белое гелеобразное вещество, нерастворимое в воде, входит в
состав многих бокситов.
типичное амфотерное соединение, свежеполученный гидроксид растворяется в кислотах и щелочах:
типичное амфотерное соединение, свежеполученный гидроксид растворяется в кислотах и щелочах:
Слайд 8Получение гидроксида алюминия
В 2 пробирки налейте по 1 мл раствора соли
алюминия
В обе пробирки прилейте по каплям раствор щелочи до появления белого осадка гидроксида алюминия:
AlCl3 + 3NaOH Al(OH)3 + 3NaCl
В обе пробирки прилейте по каплям раствор щелочи до появления белого осадка гидроксида алюминия:
AlCl3 + 3NaOH Al(OH)3 + 3NaCl
Лабораторный опыт:
Слайд 9Доказательство амфотерности:
1.Взаимодействие с кислотами
В одну пробирку с осадком прилейте
раствор соляной кислоты.
2.Взаимодействие со щелочами
В другую пробирку с осадком прилейте избыток раствора щелочи
2.Взаимодействие со щелочами
В другую пробирку с осадком прилейте избыток раствора щелочи
Лабораторный опыт:
Слайд 10Что наблюдали?
Осадки гидроксида алюминия в обеих пробирках растворяются.
Вывод: гидроксид алюминия
проявляет свойства оснований, взаимодействуя с кислотой, но он также ведет себя и как нерастворимая кислота, взаимодействуя со щелочью. Он проявляет амфотерные свойства.
Слайд 12Лабораторный опыт
От перемены мест слагаемых
сумма …. изменяется!!!
1. В одну
пробирку налейте 1 мл соли хлорида алюминия AlCl3 и добавьте 3-4 капли раствора натриевой щелочи NaOH.
2. Во вторую пробирку налейте наоборот- 1 мл натриевой щелочи NaOH и добаьте 3-4 капли соли хлорида алюминия AlCl3.
2. Во вторую пробирку налейте наоборот- 1 мл натриевой щелочи NaOH и добаьте 3-4 капли соли хлорида алюминия AlCl3.
Слайд 13Что наблюдали?
В первой пробирке образовывался
осадок, а во второй НЕТ !!!
Вывод:
для амфотерных соединений имеет большое значение, в какой последовательности проводить эксперимент!
Во втором случае изначально щелочь была в избытке:
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Во втором случае изначально щелочь была в избытке:
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
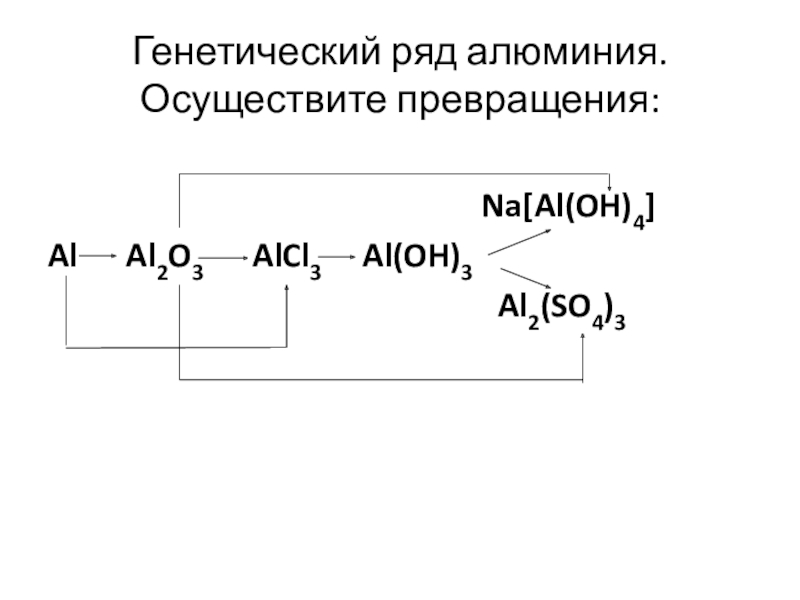
Слайд 14Генетический ряд алюминия.
Осуществите превращения:
Na[Al(OH)4]
Al Al2O3 AlCl3 Al(OH)3
Al2(SO4)3
Al Al2O3 AlCl3 Al(OH)3
Al2(SO4)3








![Амфотерные свойства оксида и гидроксида алюминия Al(OH)3 + 3HCl = AlCl3 +3H2OAl(OH)3 + NaOH = Na[Al(OH)4] Al(OH)3 + 3HCl = AlCl3 +3H2OAl(OH)3 + NaOH = Na[Al(OH)4]](/img/thumbs/c1cc81c5792a618a0f900488e4fdb6b8-800x.jpg)