- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Алюминий және оның қосылыстары (10 - сынып)
Содержание
- 1. Алюминий және оның қосылыстары (10 - сынып)
- 2. Ойлан тап! 1.
- 3. Ойлан тап!
- 4. 15.02.2016ж§23 Алюминий және оның қосылыстары
- 5. Алюминийдің табиғатта кездесуі, негізгі қасиеттері, алынуы,қолданылуы туралы
- 6. АлюминийАшылу тарихыТабиғатта кездесуі, Атом құрылысыХимиялық қасиеттеріПериодтық жүйедегі орныҚолданылуы Алынуы Физикалық қасиеттері
- 7. 1.Химиялық таңбасы – Al2.Реттік нөмірі – 133.
- 8. XVIII ғасырдың соңында француз химигі А. Лавуазье
- 9. 1827 ж неміс химигі Ф.
- 10. Табиғатта таралуы. Алюминий – табиғатта кең тараған
- 11. Аl2O3·хН2О бокситрубинсапфирортоклаз KAlSi3OlOальбит NaAlSi3О1О анортит Са(AlSiO4)2нефелин KNa3[AlSiO4]4 криолит Nа3AlF6Алюминийдің маңызды қосылыстары
- 12. АлынуыАлюминиийді алюминий оксидінің криолиттегі балқымасын электролиздеу арқылы
- 13. Физикалық қасиеті Күмістей ақ түстіЖеңіл металлБүйірлі орталынған
- 14. Химиялық қасиеттеріЖай заттармен әрекеттесуі 4Al +3O₂ =
- 15. Биологиялық роліАдам ағзасының 10 -5 % құрайды.
- 16. Al₂O₃- қиын балқитын, ақ түсті зат. Табиғатта
- 17. Алюминий және оның құймаларының қолданылуы
- 18. 1. Алюминий қосылыстарда неше валентті?а) 2
- 19. 1. Алюминийдің атомдық құрылысы......
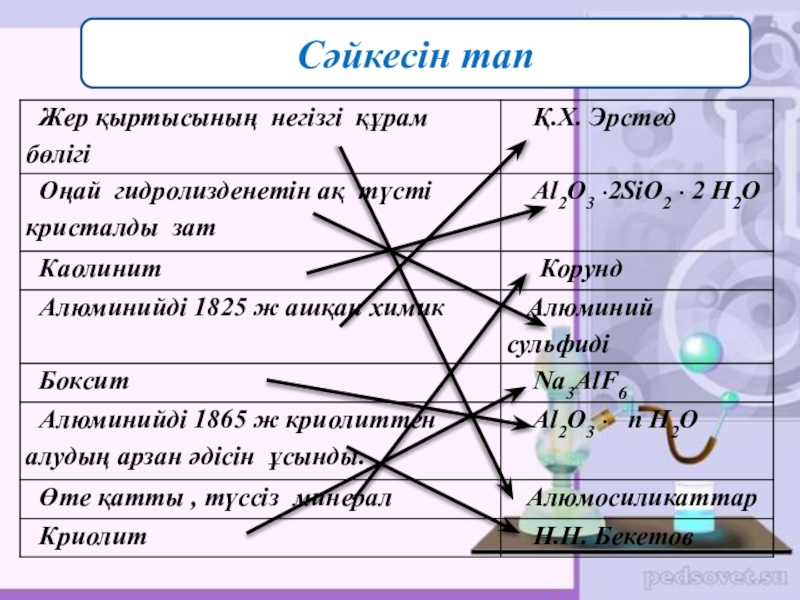
- 20. Сәйкесін тап
- 21. 1.Массасы 5,4 г алюминий темірдің (|||)
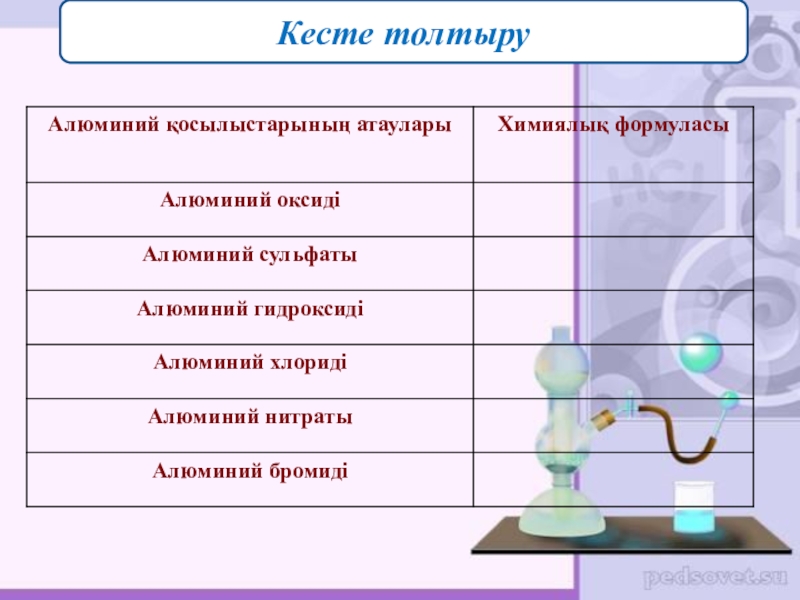
- 22. Кесте толтыру
- 23. Кесте толтыру
- 24. Кубизм әдісі Алюминий қай элемент тобына жатады?
- 25. Слайд 25
- 26. ТЫҢДАҒАНДАРЫҢЫЗҒА РАХХМЕТ!
Слайд 2
Ойлан тап!
1. Периодтық жүйеде қанша
88 металл
2. Кальцийді ашқан ғалым?
1818ж ағылшын ғалымы Гэмфри Дэви
3. Кальцийдің физикалық қасиеті?
күміс түсті ақ, жеңіл, ауада тез тотығады
4. Кальцийдің реттік нөмері нешеге тең?
20
5.Металдардың сыртқы энергетикалық деңгейінде неше электрон болады?
1 – ден 3 – ке дейін
6. Кальцийдің салыстырмалы атомдық массасы?
40
7.Кальцийде неше протон, нейтрон, электрон саны бар?
20p, 20n, 20e
8. Кальций карбонатының формуласы?
СаСO3
Слайд 3
Ойлан тап!
9. р – элементке
6 – элемент
10. СаО салыстырмалы молекулалық массасы?
56
11. Кальцийдің электрондық формуласын ата?
1s22s2 2p6 3s23p63d04s2
12. Кальций қосылыстарын ата?
бор, мәрмәр, гипс, фосфорит
13. Кальцийдің өнеркәсіпте алынуы?
тұздарының балқымасынан электролиздеу арқылы
14.Әк суы деген атпен жиі қолданылатын кальций қосылысы?
Са(ОН)2
15. Кальций қандай тотығу дәрежесін көрсетеді?
+2
16.Кальций қай периодта, қай топта орналасқан?
ІV период, IIтопта орналасқан
Слайд 5Алюминийдің табиғатта кездесуі, негізгі қасиеттері, алынуы,қолданылуы туралы түсінік бере отырып, алюминий
Оқушылардың зейінін,танымдық белсенділігін, өзіндік пікірін қалыптастыру, тұлғалық қасиеттерін дамыту.
Сабақтың мазмұны бойынша алғырттыққа, өз бетінше жұмыс жүргізулеріне, ізденімпаздыққа және өзгенің пікірімен санасуға тәрбиелеу.
Сабақ мақсаты :
Слайд 6Алюминий
Ашылу тарихы
Табиғатта кездесуі,
Атом құрылысы
Химиялық қасиеттері
Периодтық жүйедегі орны
Қолданылуы
Алынуы
Физикалық қасиеттері
Слайд 7
1.Химиялық таңбасы – Al
2.Реттік нөмірі – 13
3. Ar (Al) – 27
4.
6. Al – III период, III топ, ІІІ қатар
7. Валенттілігі – 3; тотығу дәрежесі + 3
8. Протон саны – 13
9. Нейтрон саны – 14
10. Электрон саны – 13
Атом құрылысы
Слайд 8
XVIII ғасырдың соңында француз химигі А. Лавуазье “Химиялық номенклатура әдістері” деген
Химия тарихында алюминийдің ашылу мерзімі 1825 ж. Оны ашқан -дат химигі әрі физигі Қ. Х. Эрстед.
Слайд 9
1827 ж неміс химигі Ф. Веллер алюминий хлоридіне
1865 ж Н.Н. Бекетов алюминийді криолиттен алудың арзан әдісін ұсынды.
Слайд 10
Табиғатта таралуы.
Алюминий – табиғатта кең тараған элемент.
Жер қыртысының 9%
Металдар арасында – І орын,
Элементтер арасында – ІІІ орын.
Алюминий белсенді элемент болғандықтан табиғатта тек қосылыс түрінде кездеседі. Алюминий кендері Павлодар, Қостанай, Ақтөбе облыстарында орналасқан.
Слайд 11
Аl2O3·хН2О боксит
рубин
сапфир
ортоклаз KAlSi3OlO
альбит NaAlSi3О1О
анортит Са(AlSiO4)2
нефелин KNa3[AlSiO4]4
криолит Nа3AlF6
Алюминийдің маңызды
Слайд 12Алынуы
Алюминиийді алюминий оксидінің криолиттегі балқымасын электролиздеу арқылы алады.
Слайд 13Физикалық қасиеті
Күмістей ақ түсті
Жеңіл металл
Бүйірлі орталынған торы бар
d -2,7г/см3
t(балқу) –
t(қайнау) – 2500 ºС
Иілгіштік қасиеті жоғары
Электрөткізгіштігі , жылуөткізгіштігі жоғары
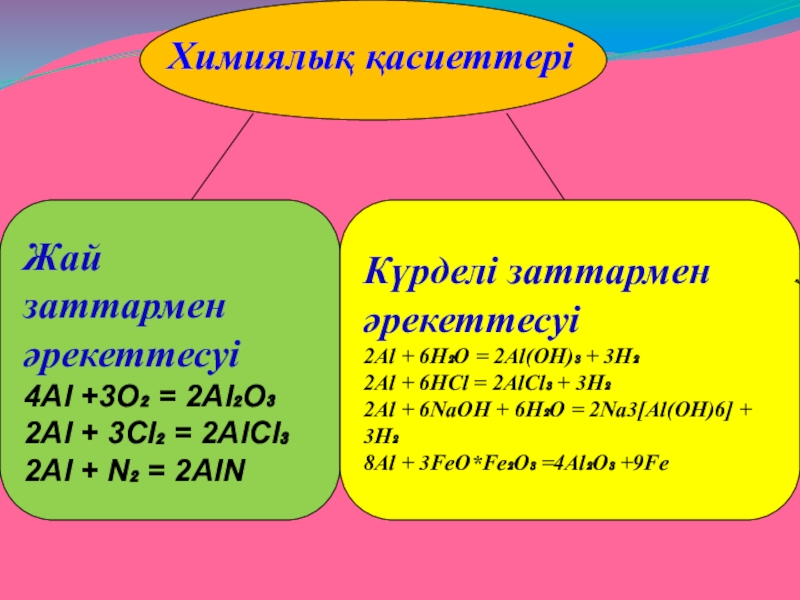
Слайд 14
Химиялық қасиеттері
Жай заттармен
әрекеттесуі
4Al +3O₂ = 2Al₂O₃
2Al + 3Cl₂ = 2AlCl₃
2Al
Күрделі заттармен
әрекеттесуі
2Al + 6H₂O = 2Al(OH)₃ + 3H₂
2Al + 6HCl = 2AlCl₃ + 3H₂
2Al + 6NaOH + 6H₂O = 2Na3[Al(OH)6] + 3H₂
8Al + 3FeO*Fe₂O₃ =4Al₂O₃ +9Fe
Слайд 15Биологиялық ролі
Адам ағзасының 10 -5 % құрайды. Қан ұйығанда өкпеде, бауырда,
Слайд 16Al₂O₃- қиын балқитын, ақ түсті зат. Табиғатта корунд деген атпен кездеседі.
Маңызды қосылыстары
Слайд 181. Алюминий қосылыстарда неше валентті?
а) 2
2. Боксит формуласы
а) Al2O3 ә) Al2O3*nH2O б) K2O3 Al2O3
3. Қазақстанда алюминий зауыты қай жылдан бастап жұмыс жасайды?
а)2000; ә)1998; б)2007; в)1992
4. Алюминий қандай затпен әрекеттеспейді?
а) H2O; ә) НCl;
б) NaOH; в) HNO3
5. Алюминотермия әдісі арқылы металдарды алу реакциясы?
а) Al2O3 = ; ә) Al +HCl;
б) Al +FeOFe2O3 = ; в) Al + NaOH =
Тест
Слайд 191. Алюминийдің атомдық құрылысы......
( ІІІ пер, ІІІтоп;
2. Алюминий табиғатта таралуы бойынша....... орында
(металдар – І, элементтер – ІІІ)
3. Жер қыртысының негізгі массасын....құрайды.
(9% құрайды)
4. Қосылыстарындағы тотығу дәрежесі......
(+3 – ке тең)
5. Алюминийдің табиғаттағы негізгі қосылыстары............
(корунд, ортоклаз, нефелин, криолит, боксит)
6. Қазақстанда бокситтердің белгілі кен орындары бар, олар.........
(Повлодар қаласы, Торғай кен орны)
7. Алюминийдің кристалдық торы......
(бүйірі орталықтанған )
8. Алюминийдің физикалық қасиеті........
(ақ түсті,жеңіл, иілгіш, элекрт, жылуөткізгіштігі жоғары)
9. Алюминий оксиді…………
(қиын балқитын,қатты, суда ерімейді)
10. Алюминийді ........... қолданады.
(кеме, ұшақ, машина жасауда, тұрмыстық бұйымдар алуда)
( Химиялық диктант5
Слайд 21
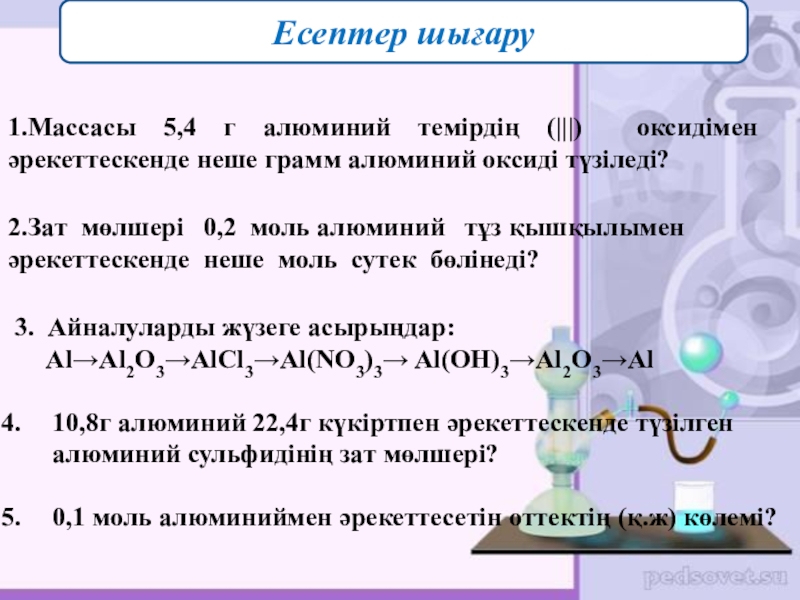
1.Массасы 5,4 г алюминий темірдің (|||) оксидімен әрекеттескенде неше грамм
Есептер шығару
2.Зат мөлшері 0,2 моль алюминий тұз қышқылымен әрекеттескенде неше моль сутек бөлінеді?
3. Айналуларды жүзеге асырыңдар:
Al→Al2O3→AlCl3→Al(NO3)3→ Al(OH)3→Al2O3→Al
10,8г алюминий 22,4г күкіртпен әрекеттескенде түзілген алюминий сульфидінің зат мөлшері?
0,1 моль алюминиймен әрекеттесетін оттектің (қ.ж) көлемі?
Слайд 24Кубизм әдісі
Алюминий қай элемент тобына жатады?
Р – элемент
2. Алюминийдің сыртқы электрондық қабатында неше электрон бар?
3 – электрон
3. Алюминийдің қайнау температурасы?
t(қайнау) – 2500 ºС
4. Алюминийдің химиялық қасиеті?
Жай және күрделі заттармен әрекеттеседі
5. Алюминийді қандай әдіс арқылы алады?
Электролиз әдісі
Алюминий мен кальцийдің ортақ қасиеттері.
физикалық және химиялық қасиеттері










![Алюминий және оның қосылыстары (10 - сынып) Аl2O3·хН2О бокситрубинсапфирортоклаз KAlSi3OlOальбит NaAlSi3О1О анортит Са(AlSiO4)2нефелин KNa3[AlSiO4]4 криолит Nа3AlF6Алюминийдің маңызды қосылыстары Аl2O3·хН2О бокситрубинсапфирортоклаз KAlSi3OlOальбит NaAlSi3О1О анортит Са(AlSiO4)2нефелин KNa3[AlSiO4]4 криолит Nа3AlF6Алюминийдің маңызды қосылыстары](/img/thumbs/944b78d48c98da1385cd5a6bbaf2915e-800x.jpg)