- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Алюминий и его свойства.
Содержание
- 1. Алюминий и его свойства.
- 2. Al +13 ) ) )
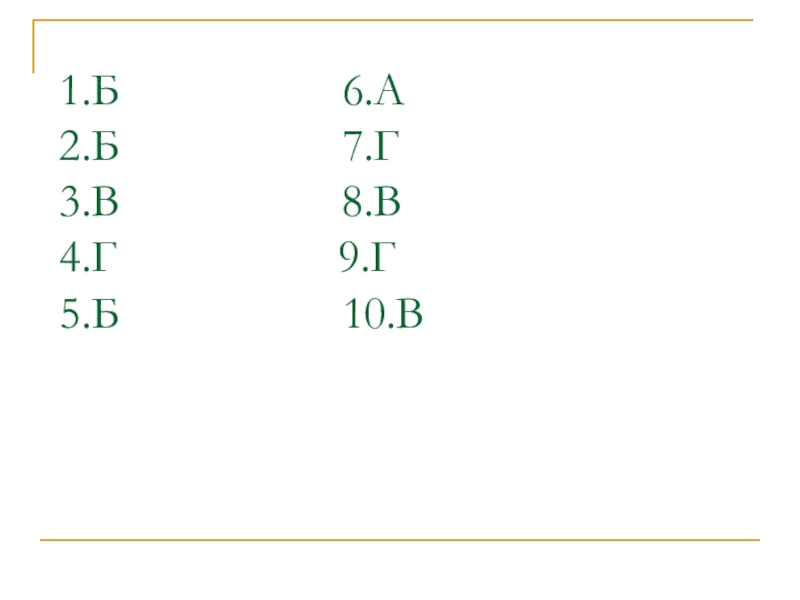
- 3. 1.Б
- 4. Какие металлы мы изучали на прошлом уроке?
- 5. « Я металл, серебристый и лёгкий,
- 6. План изучения нового материала:1. Нахождение алюминия в
- 7. АлюмосиликатыЭто соединения , образованные оксидами алюминия, кремния,
- 8. БокситыГорная порода, из которой получают алюминий.Она сдержит оксид алюминия Al2O3
- 9. Корунд Минерал состава Al2O3, обладает очень высокой
- 10. Крупные прозрачные кристаллы корунда являются ценными драгоценными камнями – рубинами и сапфирами
- 11. Красная окраска рубинов связана с замещением части
- 12. Васильково-синие сапфиры содержат ионы железа и титана
- 13. Ту же формулу имеет и другое природное соединение – металлургический глинозём
- 14. Слайд 14
- 15. Нахождение в природеПо распространённости в земной коре
- 16. Первый образец алюминия получил датский учёный
- 17. В 1827 году знаменитый немецкий химик Фридрих
- 18. Промышленный способ производства алюминия, который в своей
- 19. Характеристика элемента алюминия по его положение в
- 20. Порядковый номер алюминия -13.Алюминий - элемент III
- 21. Физические свойства алюминия. План характеристики :1. В
- 22. Физические свойстваСеребристо –белый лёгкий металлТ плавления -660о
- 23. Химические свойства:1.Легко взаимодействует с неметаллами:а) кислородом 4Al
- 24. 2. Взаимодействует с водой: 2Al + 6H2O = 2Al(OH)3↓ + 3H2↑
- 25. 3. Взаимодействует с кислотами: 2Al + 6HCl =
- 26. 4.Взаимодействует с растворами щелочей:2Al+2NaOH+6H2O=2Na[Al(OH)4] +3H2↑ – в
- 27. Вывод об амфотерности алюминия:Гидроксид и кислота Растворят металл всегда. Потому любой уверен – Алюминий амфотерен
- 28. Будет ли протекать следующая реакция?
- 29. 5. Алюминотермия (взаимодействие с оксидами металлов при
- 30. Ученый, впервые получивший алюминий. Минерал состава Al2O3,
- 31. Тест по теме «Алюминий» 1.Самым распространенным в
- 32. Домашнее задание:Обязательное: § 13 учить, упр.6 выполнить письменно.
- 33. Домашнее задание:Обязательное: § 13 учить, упр.6 выполнить письменно.
- 34. Элемент третьей группы - Прекрасный металл. Он
- 35. Самостоятельная работа:1 вариантAl→ Al2O3→ AlCl3 →Al(OH)32 вариантAl2O3→
Al +13 ) ) ) 2 8 3 1s22s2p63s2p1
Слайд 4
Какие металлы мы изучали на прошлом уроке?
Какие металлы относятся к
щелочноземельным металлам?
Сколько электронов на внешнем уровне у данных металлов?
Какие свойства проявляют в химических реакциях?
В каком виде встречаются эти металлы в природе?
Самое распространенное соединение Ca?
Сколько электронов на внешнем уровне у данных металлов?
Какие свойства проявляют в химических реакциях?
В каком виде встречаются эти металлы в природе?
Самое распространенное соединение Ca?
Слайд 5« Я металл, серебристый и лёгкий,
И зовусь самолётный металл,
И покрыт я оксидною плёнкой,
Чтоб меня кислород не достал».
Чтоб меня кислород не достал».
Слайд 6План изучения нового материала:
1. Нахождение алюминия в природе;
2.История открытия и
получения алюминия;
3.Характеристика элемента алюминия по положению в периодической системе Д.И.Менделеева. Строение атома;
4.Физические свойства алюминия;
5.Химические свойства алюминия;
6.Применение алюминия и его сплавов;
7.Алюминий в организме человека.
3.Характеристика элемента алюминия по положению в периодической системе Д.И.Менделеева. Строение атома;
4.Физические свойства алюминия;
5.Химические свойства алюминия;
6.Применение алюминия и его сплавов;
7.Алюминий в организме человека.
Слайд 7Алюмосиликаты
Это соединения , образованные оксидами алюминия, кремния, щелочных и щелочноземельных металлов.
К природным алюмосиликатам относят глины, в том числе белая глина каолинит, полевые шпаты, слюду и многие другие минералы, слагающие земную кору.
Слайд 9Корунд
Минерал состава Al2O3, обладает очень высокой твёрдостью
Мелкозернистая разновидность называется наждаком, часто
она содержит примеси кварца и оксида железа (III) Fe2O3
Слайд 10Крупные прозрачные кристаллы корунда являются ценными драгоценными камнями – рубинами и
сапфирами
Слайд 11Красная окраска рубинов связана с замещением части атомов алюминия в структуре
Al2O3 на хром, содержание которого может достигать 4 %
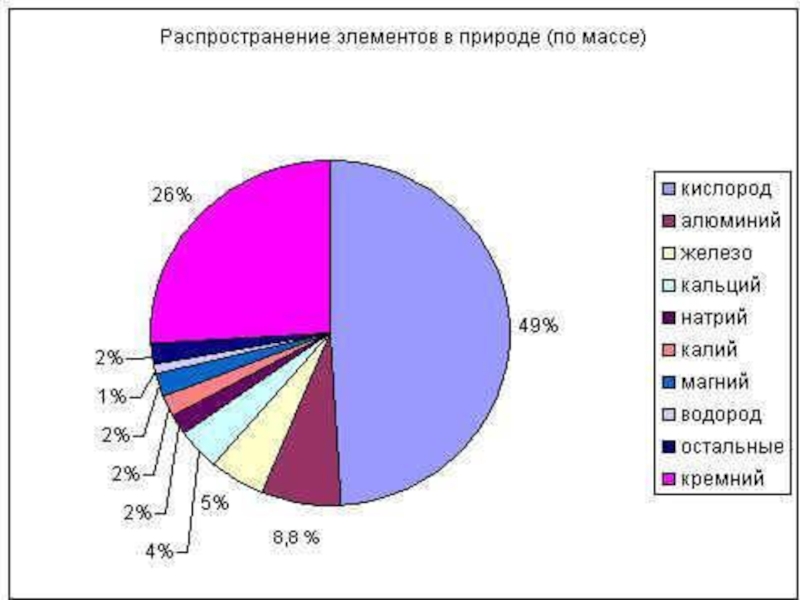
Слайд 15Нахождение в природе
По распространённости в земной коре алюминий занимает первое место
среди металлов ( 8% массы земной коры) и третье – среди всех элементов (после кислорода и кремния).
В природе алюминий встречается только в виде соединений.
Входит в состав бокситов Al2O3 • 2H2O
Каолина (белой глины) Al2O3 • 2SiO2 • 2H2O
Корунда Al2O3
В организме человека содержится незначительное количество алюминия. Суточная потребность человека в этом элементе составляет 47 мг.
В природе алюминий встречается только в виде соединений.
Входит в состав бокситов Al2O3 • 2H2O
Каолина (белой глины) Al2O3 • 2SiO2 • 2H2O
Корунда Al2O3
В организме человека содержится незначительное количество алюминия. Суточная потребность человека в этом элементе составляет 47 мг.
Слайд 16 Первый образец алюминия получил датский учёный Г.Эрстед в 1825 году
в результате следующей химической реакции:
AlCl3 + 3Na → Al +3NaCl
AlCl3 + 3Na → Al +3NaCl
Слайд 17В 1827 году знаменитый немецкий химик Фридрих Вёлер получил более чистый
алюминий, использовав для этого криолит и
металлический калий:
Na3[AlF6] + 3K → Al + 3NaF + 3KF
Слайд 18Промышленный способ производства алюминия,
который в своей основе применяется до сих
пор, был разработан в 1866 году двумя молодыми учёными американцем Чарльзом Холлом и французом Полем Эру, причём независимо друг от друга.
Na3AlF6
2Al2O3 (расплав) → 4AI + 2O3
электролиз
Na3AlF6
2Al2O3 (расплав) → 4AI + 2O3
электролиз
Слайд 19Характеристика элемента алюминия по его положение в ПСХЭ Д.И.Менделеева. Строение атома.
Порядковый номер алюминия _______.
Алюминий - элемент __________группы, __________ подгруппы
Заряд ядра атома алюминия равен ______
В ядре атома алюминия __________протонов.
В ядре атома алюминия _________нейтронов.
В атоме алюминия ________ электронов.
Атом алюминия имеет _________энергетических уровня.
Электронная оболочка имеет строение __________.
На внешнем уровне в атоме алюминия _________ электрона.
Степень окисления атома алюминия в соединениях равна ________.
Простое вещество алюминий является ____________.
Оксид и гидроксид алюминия имеют ___________________ характер.
Слайд 20Порядковый номер алюминия -13.
Алюминий - элемент III группы, главной подгруппы
Заряд ядра
атома алюминия равен +13.
В ядре атома алюминия 13 протонов.
В ядре атома алюминия 14 нейтронов.
В атоме алюминия 13 электронов.
Атом алюминия имеет 3 энергетических уровня.
Электронная оболочка имеет строение 1s22s2p63s2p1.
На внешнем уровне в атоме алюминия 3 электрона.
Степень окисления атома алюминия в соединениях равна +3.
Простое вещество алюминий является металлом.
Оксид и гидроксид алюминия имеют амфотерный
характер.
Формула высшего оксида – Al2O3
Формула гидроксида - Al(OH)3
В ядре атома алюминия 13 протонов.
В ядре атома алюминия 14 нейтронов.
В атоме алюминия 13 электронов.
Атом алюминия имеет 3 энергетических уровня.
Электронная оболочка имеет строение 1s22s2p63s2p1.
На внешнем уровне в атоме алюминия 3 электрона.
Степень окисления атома алюминия в соединениях равна +3.
Простое вещество алюминий является металлом.
Оксид и гидроксид алюминия имеют амфотерный
характер.
Формула высшего оксида – Al2O3
Формула гидроксида - Al(OH)3
Слайд 21 Физические свойства алюминия.
План характеристики :
1. В каком агрегатном состоянии находится
алюминий при данных условиях?
2. Какого цвета? Блеск?
3. Имеет ли алюминий запах?
4. Проявляет ли данный металл пластичность, хрупкость?
5. Растворяется ли в воде при данных условиях?
6. Какова температура плавления?
7. Какова плотность вещества?
8. Обладает ли алюминий теплопроводностью и электропроводностью?
Слайд 22Физические свойства
Серебристо –белый лёгкий металл
Т плавления -660о С
Пластичен
Хорошая тепло- и электропроводимость
Малая
плотность
Сплавам придаёт прочность и коррозийную стойкость
Сплавам придаёт прочность и коррозийную стойкость
Слайд 23Химические свойства:
1.Легко взаимодействует с неметаллами:
а) кислородом
4Al + 3O2 = 2Al2O3
б)
другими неметаллами
2Al + 3Br2 = 2AlBr3
4Al + 3C = Al4C3
2Al + 3S = Al2S3
2Al + 3Br2 = 2AlBr3
4Al + 3C = Al4C3
2Al + 3S = Al2S3
Слайд 253. Взаимодействует с кислотами:
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al +
3H2SO4 = Al2(SO4)3 + 3H2↑
Концентрированные H2SO4 и HNO3 – пассивируют алюминий, образуя на поверхности металла прочную, плотную оксидную плёнку, которая препятствует дальнейшему протеканию реакции.
Концентрированные H2SO4 и HNO3 – пассивируют алюминий, образуя на поверхности металла прочную, плотную оксидную плёнку, которая препятствует дальнейшему протеканию реакции.
Слайд 264.Взаимодействует с растворами щелочей:
2Al+2NaOH+6H2O=2Na[Al(OH)4] +3H2↑
– в растворе
2Al + 2NaOH +2H2O
= 2NaAlO2 + 3H2↑
- в расплаве
- в расплаве
Слайд 27Вывод об амфотерности алюминия:
Гидроксид и кислота
Растворят металл всегда.
Потому любой
уверен –
Алюминий амфотерен
Алюминий амфотерен
Слайд 295. Алюминотермия (взаимодействие с оксидами металлов при высокой температуре.
Ввиду своей
высокой активности алюминий используется в металлургии для получения металлов: хрома ,марганца, ванадия, титана, циркония из их оксидов):
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
Слайд 30
Ученый, впервые получивший алюминий.
Минерал состава Al2O3, обладающий очень высокой прочностью
и твердостью.
Способ получения металлов из оксидов с помощью алюминия.
Латинское слово, от которого образовано название химического элемента Al.
Процесс разложения веществ с участием электрического тока.
Чем является алюминий в химических реакциях?
Способ получения металлов из оксидов с помощью алюминия.
Латинское слово, от которого образовано название химического элемента Al.
Процесс разложения веществ с участием электрического тока.
Чем является алюминий в химических реакциях?
Слайд 31
Тест по теме «Алюминий»
1.Самым распространенным в земной коре металлом является
а)
Ca б) Al в) Na г) Fe
2.Самым активным металлом среди перечисленных является
a) Na б) K в) Al г) Mg
3.Амфoтерные соединения образует
a) Ca б) Na в) Al г) Li
4.Сплав на основе алюминия называется
a) бронза б) латунь в) мельхиор г) дюралюминий
5.В самородном состоянии встречается в природе
a) Al б) Cu в) Na г) Mg
6.Не подвержен коррозии
a) Al б) Fe в) Na г) Li
7.Алюминий входит в состав следующего природного соединения
а) сильвинит б) кальций в) гипс г) корунд
8.При растворении алюминия в воде получается раствор
а) алюминия б) оксида алюминия в) гидроксида алюминия г) гидрида алюминия
9.В ряду Na – Мg – Аl – Si
а) увеличивается число энергетических уровней в атомах
б) усиливаются металлические свойства элементов
в) уменьшается высшая степень окисления элементов
г) ослабевают металлические свойства элементов
10.Какую химическую реакцию положил в основу рассказа «Бенгальские огни» его автор Н. Носов?
а) взаимодействие алюминия с хлором
б) взаимодействие алюминия с водой
в) взаимодействие алюминия с кислородом
г) взаимодействие алюминия с серой
2.Самым активным металлом среди перечисленных является
a) Na б) K в) Al г) Mg
3.Амфoтерные соединения образует
a) Ca б) Na в) Al г) Li
4.Сплав на основе алюминия называется
a) бронза б) латунь в) мельхиор г) дюралюминий
5.В самородном состоянии встречается в природе
a) Al б) Cu в) Na г) Mg
6.Не подвержен коррозии
a) Al б) Fe в) Na г) Li
7.Алюминий входит в состав следующего природного соединения
а) сильвинит б) кальций в) гипс г) корунд
8.При растворении алюминия в воде получается раствор
а) алюминия б) оксида алюминия в) гидроксида алюминия г) гидрида алюминия
9.В ряду Na – Мg – Аl – Si
а) увеличивается число энергетических уровней в атомах
б) усиливаются металлические свойства элементов
в) уменьшается высшая степень окисления элементов
г) ослабевают металлические свойства элементов
10.Какую химическую реакцию положил в основу рассказа «Бенгальские огни» его автор Н. Носов?
а) взаимодействие алюминия с хлором
б) взаимодействие алюминия с водой
в) взаимодействие алюминия с кислородом
г) взаимодействие алюминия с серой
Слайд 32
Домашнее задание:
Обязательное: § 13 учить, упр.6 выполнить письменно.
Творческое: Поэт Андрей Вознесенский написал
в 1959 году стихотворение «Осень», в котором использовал алюминий в качестве художественного образа:
…А за окошком
в юном инее лежат поля из алюминия…
Объясните, что или какие свойства алюминия
подразумевал поэт. Придумайте красивые образные выражения с использованием свойств алюминия, которые можно использовать при написании сочинений.
…А за окошком
в юном инее лежат поля из алюминия…
Объясните, что или какие свойства алюминия
подразумевал поэт. Придумайте красивые образные выражения с использованием свойств алюминия, которые можно использовать при написании сочинений.
Слайд 33
Домашнее задание:
Обязательное: § 13 учить, упр.6 выполнить письменно.
Творческое: Поэт Андрей Вознесенский написал
в 1959 году стихотворение «Осень», в котором использовал алюминий в качестве художественного образа:
…А за окошком
в юном инее лежат поля из алюминия…
Объясните, что или какие свойства алюминия
подразумевал поэт. Придумайте красивые образные выражения с использованием свойств алюминия, которые можно использовать при написании сочинений.
…А за окошком
в юном инее лежат поля из алюминия…
Объясните, что или какие свойства алюминия
подразумевал поэт. Придумайте красивые образные выражения с использованием свойств алюминия, которые можно использовать при написании сочинений.
Слайд 34
Элемент третьей группы -
Прекрасный металл.
Он “крылатый”, сребристый, но не кристалл.
Образует оксид
амфотерный и ток.
С ним галлий и индий не одинок.
Слайд 35
Самостоятельная работа:
1 вариант
Al→ Al2O3→ AlCl3 →Al(OH)3
2 вариант
Al2O3→ Al→ AlCl3→ Al(OH)3 →Al2O3
Цепочку
записать в тетрадь, а затем уравнения реакций.























![Алюминий и его свойства. 4.Взаимодействует с растворами щелочей:2Al+2NaOH+6H2O=2Na[Al(OH)4] +3H2↑ – в растворе 2Al + 2NaOH +2H2O 4.Взаимодействует с растворами щелочей:2Al+2NaOH+6H2O=2Na[Al(OH)4] +3H2↑ – в растворе 2Al + 2NaOH +2H2O = 2NaAlO2 + 3H2↑ - в](/img/thumbs/037537a892429a73d40c32c7356b25c1-800x.jpg)














