- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Алюминий (9 класс)
Содержание
- 1. Алюминий (9 класс)
- 2. Слайд 2
- 3. Однажды к римскому императору Тиберию пришел незнакомец
- 4. Слайд 4
- 5. Алюминий
- 6. Цель урока: В ходе изучения темы, вы
- 7. Входной контроль
- 8. Ответы1. в2. а3. бКаждый правильный ответ – 1 баллМаксимальное количество – 3 балла
- 9. План характеристики физических свойств алюминия 1.
- 10. 1. Твердое агрегатное состояние
- 11. Название элемента происходит от лат.алюмен, так в
- 12. Впервые Al был получен датским физиком Хансом Эрстедом в 1825 г.
- 13. Англичане подарили Д.И Менделееву химические весы, в
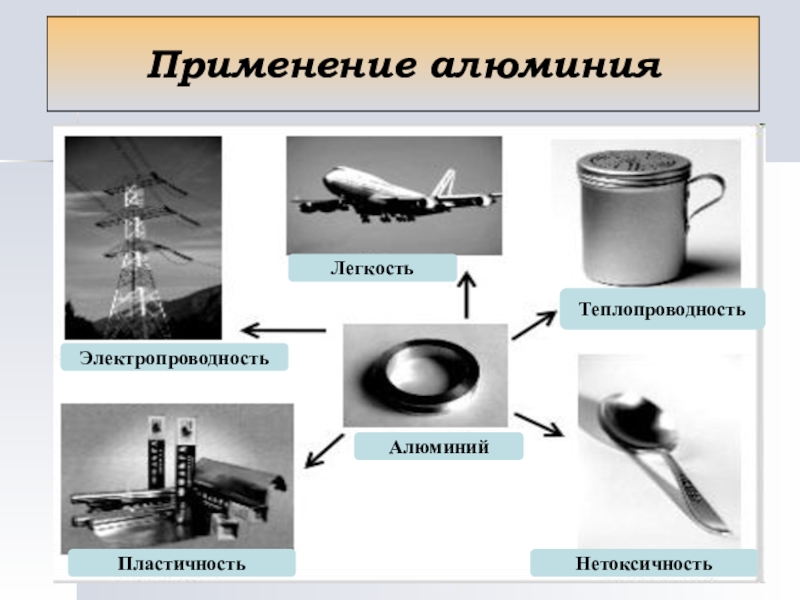
- 14. Применение алюминия
- 15. Алюминий находится в группе (
- 16. Алюминий находится в III группе (главная подгруппа),
- 17. Слайд 17
- 18. Взаимодействие алюминия с кислотой и щелочью
- 19. Химические свойства алюминия: Взаимодействие
- 20. Химические свойства алюминия: Взаимодействие
- 21. Химические свойства алюминия: Взаимодействие
- 22. Химические свойства алюминия: Взаимодействие
- 23. Выходной контрольОтвет: 1. б2. г3. в4. в5. аПравильный ответ: 5 баллов
- 24. Благородная шпинель: основа ее химического состава – оксид алюминия Al2O3,вес – 398,72 карата
- 25. 1. Вернитесь к УЭ 0. Все ли
- 26. РефлексияКак бы вы оценили результаты своей работы
- 27. Благодарю вас за работу на уроке!
Слайд 1МОУ Ундоровский общеобразовательный лицей
Урок химии
в 9 классе
на тему «Алюминий»
Учитель
Чибирёва Н.Е.
Слайд 3Однажды к римскому императору Тиберию пришел незнакомец и принес в дар
Слайд 6
Цель урока:
В ходе изучения темы, вы должны знать:
электронное строение атома
физические и химические свойства алюминия,
способы получения алюминия,
области применения алюминия
уметь:
характеризовать химический элемент алюминий по положению в ПСХЭ Д.И.Менделеева и строению атома, составлять уравнения реакций,
работать над выполнением задания в паре,
оказывать помощь своим одноклассникам в выполнении заданий, самостоятельно работать.
Слайд 7Входной контроль
1. Какой тип связи характерен для кристаллической решетки металлов:
а) ионная б) ковалентная неполярная
в) металлическая г) ковалентная полярная
2. Число электронов на внешнем энергетическом уровне атомов наиболее активных металлов:
а) 1 – 3 б) 3 – 5
в) 5 – 7 г) 6 – 8
3. Способность, характеризующая свойства металлов:
а) окислительная
б) восстановительная
в) окислительно-восстановительная
Слайд 9План характеристики
физических свойств алюминия
1. В каком агрегатном состоянии
2. Определите цвет вещества, обладает ли оно металлическим блеском?
3. Проявляет ли данный металл пластичность, хрупкость?
4. Растворяется ли в воде при данных условиях?
5. Какова температура плавления?
6. Обладает ли алюминий теплопроводностью и электропроводностью?
7. Является ли алюминий легким или тяжелым металлом?
Слайд 10 1. Твердое агрегатное состояние
2. Серебристо-белый, блестящий
4. Не растворяется в воде
5. Температура плавления 6600С
6. Тепло- и электропроводный
7. Легкий
Слайд 11Название элемента происходит от лат.
алюмен, так в древности называли квасцы,
которые
тканей
KAl(SO4)2 . 12H2O
Слайд 13Англичане подарили Д.И Менделееву химические весы, в которых одна чашка была
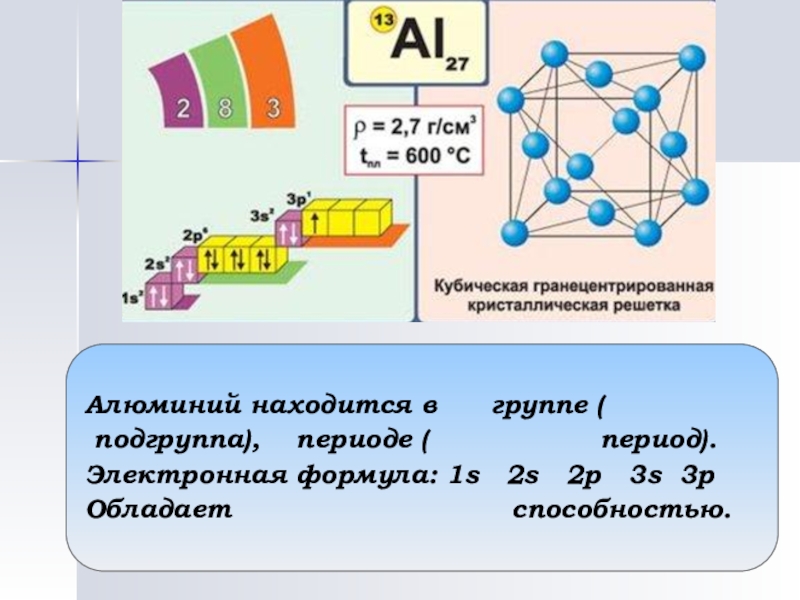
Слайд 15Алюминий находится в группе (
подгруппа), периоде ( период).
Электронная формула: 1s 2s 2p 3s 3p Обладает способностью.
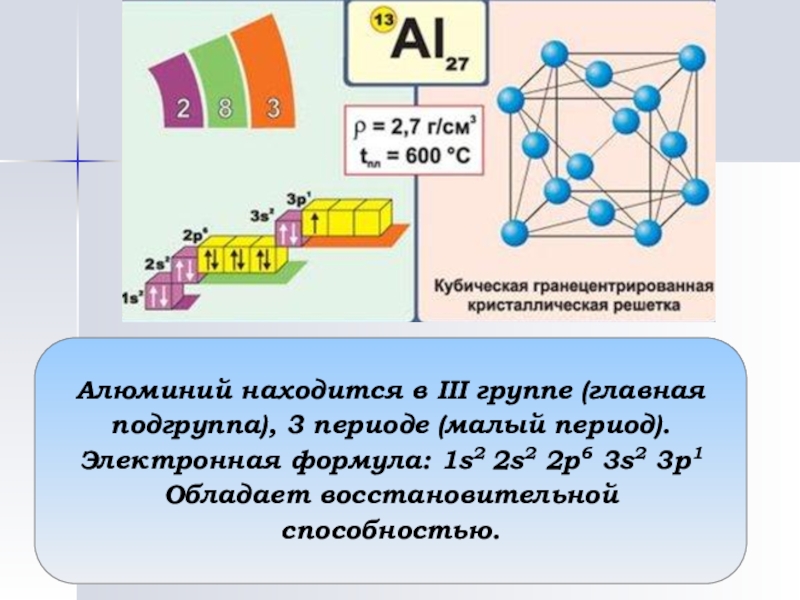
Слайд 16Алюминий находится в III группе (главная подгруппа), 3 периоде (малый период).
Электронная
Обладает восстановительной способностью.
Слайд 19 Химические свойства алюминия:
Взаимодействие со
сложными веществами:
Al + HCl =
2. Взаимодействие с гидроксидом натрия
Al + NaOH + H2O =
Слайд 20 Химические свойства алюминия:
Взаимодействие со
сложными веществами:
2Al + 6HCl = 2AlCl3 + 3H2
2. Взаимодействие с гидроксидом натрия
2Al + 2NaOH + 6H2O = 2NaAlO2 + 3H2
Слайд 21 Химические свойства алюминия:
Взаимодействие со
сложными веществами:
2Al + 6H2O = 2Al(OH)3 + 3H2
4. Восстанавливает металлы из их оксидов (алюминотермия)
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
Слайд 22 Химические свойства алюминия:
Взаимодействие с
простыми веществами:
Взаимодействие
4Al + 3O2 = 2Al2O3
Слайд 24Благородная шпинель:
основа ее химического состава – оксид алюминия Al2O3,
вес – 398,72
Слайд 251. Вернитесь к УЭ 0.
Все ли цели урока выполнены?
2. Оцените
Если вы набрали 17,5 – 20 баллов,
то ваша оценка «5»
12,5 – 17 баллов,
то ваша оценка «4»
7 – 12 баллов,
то ваша оценка «3»
6,5 и менее баллов,
то ваша оценка «2»