- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Алюминий
Содержание
- 1. Алюминий
- 2. Алюминий
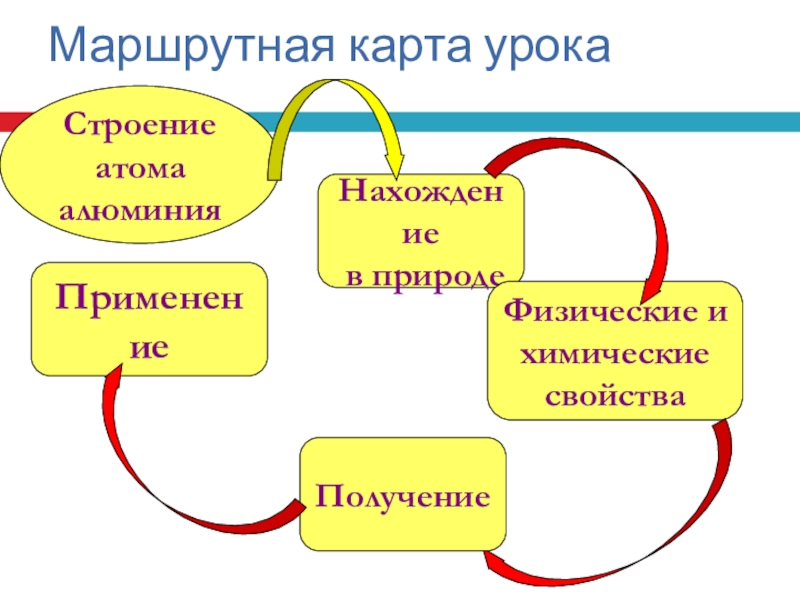
- 3. Маршрутная карта урокаСтроение атома алюминияНахождение в природеФизические ихимическиесвойстваПрименениеПолучение
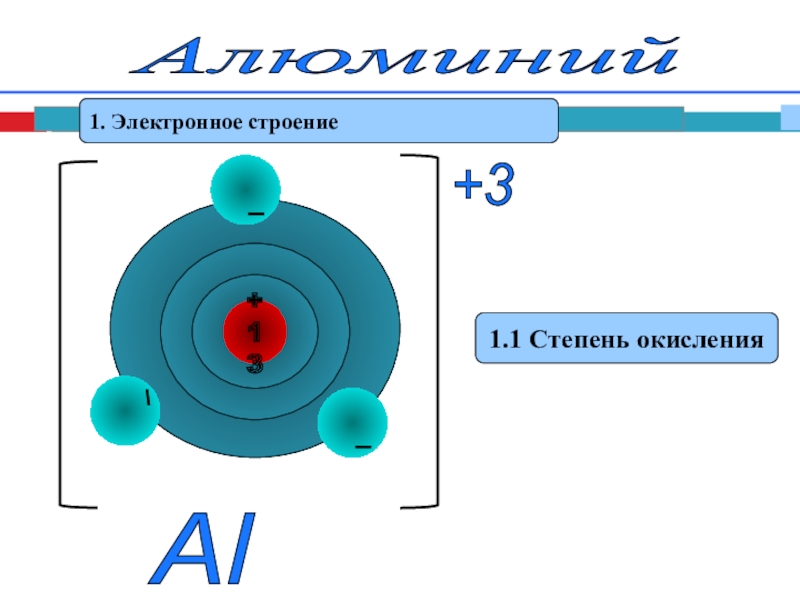
- 4. Алюминий 1. Электронное строение1.1 Степень окисленияAl +3
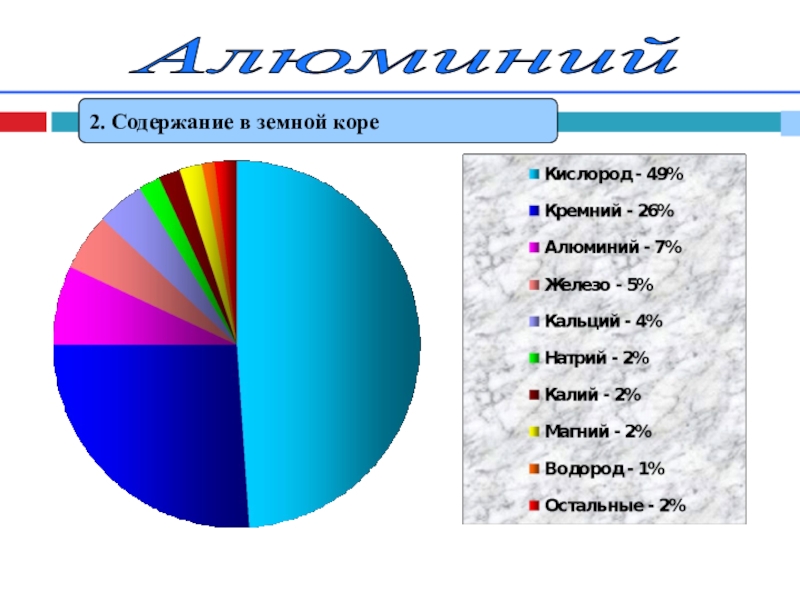
- 5. Алюминий 2. Содержание в земной коре
- 6. Алюминий 2. Нахождение в природе
- 7. Алюминий 2. Нахождение в природе
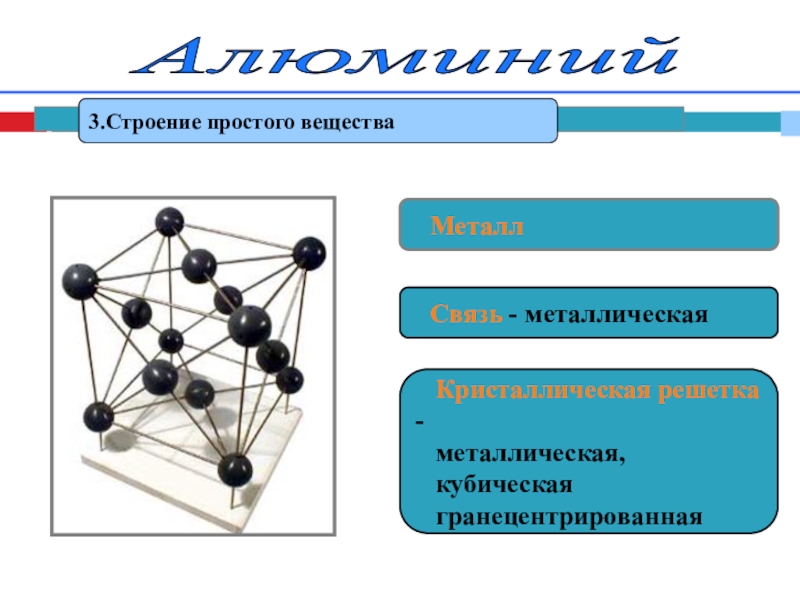
- 8. Алюминий 3.Строение простого вещества Металл
- 9. Физические свойства алюминия Твердый.Серебристо-белый с металлическим
- 10. Алюминий Восстановительные свойстваЭлектрохимический ряд напряжений металловLi, K,
- 11. Алюминий 6. Химические свойства4Аl + 3O2 =
- 12. Горение алюминияназад
- 13. Взаимодействие алюминия с водойназад
- 14.
- 15. Области применения алюминияAl
- 16. Закрепление ЗаданияЧасть А. Закончите уравнения реакции, назватьAl
- 17. Часть А. 2Al + 3Br2 →2AlBr3 бромид алюминия2Al
- 18. Домашнее заданиеПараграф 13, упр.2,5. Из предложенных
- 19. “Алюминий – металл современного технологического мира!”
Слайд 3Маршрутная карта урока
Строение атома
алюминия
Нахождение
в природе
Физические и
химические
свойства
Применение
Получение
Слайд 8Алюминий
3.Строение простого вещества
Металл
Связь - металлическая
металлическая,
кубическая
гранецентрированная
Слайд 9 Физические свойства алюминия
Твердый.
Серебристо-белый с металлическим блеском.
Без запаха.
Пластичный.
В воде не
T плавления = 660 С
Плотность = 2,7 г/см3
Теплопроводен и электропроводен.
Слайд 10Алюминий
Восстановительные свойства
Электрохимический ряд напряжений металлов
Li, K, Ca, Na, Mg,
Ослабление восстановительных свойств
Слайд 11Алюминий
6. Химические свойства
4Аl + 3O2 = 2Al2O3
t
2Al
C н е м е т а л л а м и (c кислородом, с серой)
2Аl + 3Cl2 = 2AlCl3
4Al + 3C = Al4C3
C неметаллами (c галогенами, с углеродом)
(Снять оксидную пленку)
2Al + 6H2O = 2Al(OH)3 + 3H2↑
C в о д о й
2Al + 6HCl = 2AlCl3 + H2↑
2Al + 3H2SO4 = Al2(SO4)3 + H2↑
C к и с л о т а м и
2Al + 6NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
Cо щ е л о ч а м и
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
2Al + WO3 = Al2O3 + W
C о к с и д а м и м е т а л л о в
Далее
Опыт №1
Опыт №2
Слайд 16
Закрепление
Задания
Часть А.
Закончите уравнения реакции, назвать
Al + Br2
Al + H2SO4 (p-p)
Часть В. *
Написать уравнения реакций для схемы, назвать
Al →Al2O3 → AlCl3
Al →AlCl3 →Al2(SO4)3
Назовите продукты реакций.
Часть С. **
Написать уравнения реакций для схемы, назвать
Al →Al (OH)3 → Na[Al(OH)4]
Al → Al2 O3 →NaAlO2
Алюминий
Слайд 17Часть А.
2Al + 3Br2 →2AlBr3 бромид алюминия
2Al + 3H2SO4 (p-p) → Al2(SO4)3 +
Часть В. *
1. 4Al + 3O2 → 2Al2O3 ;
Al2O3 + 6HCl → 2AlCl3 + 3H2O
2. 2Al + 3Cl2 → 2AlCl3 ;
2AlCl3 + 3H2SO4 → Al2(SO4)3 + 6HCl
Часть С. **
1. Al + Fe(OH)3 → Al(OH)3 + Fe ;
Al(OH)3 + NaOH→ Na[Al(OH)4]
2. Al + O2 → Al2O3 ;
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Закрепление
Алюминий