- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Алкены и алкины
Содержание
- 1. Алкены и алкины
- 2. Алкены Алкенами (олефинами или этиленовыми углеводородами)
- 3. Номенклатура Название алкенов по систематической номенклатуре образуют
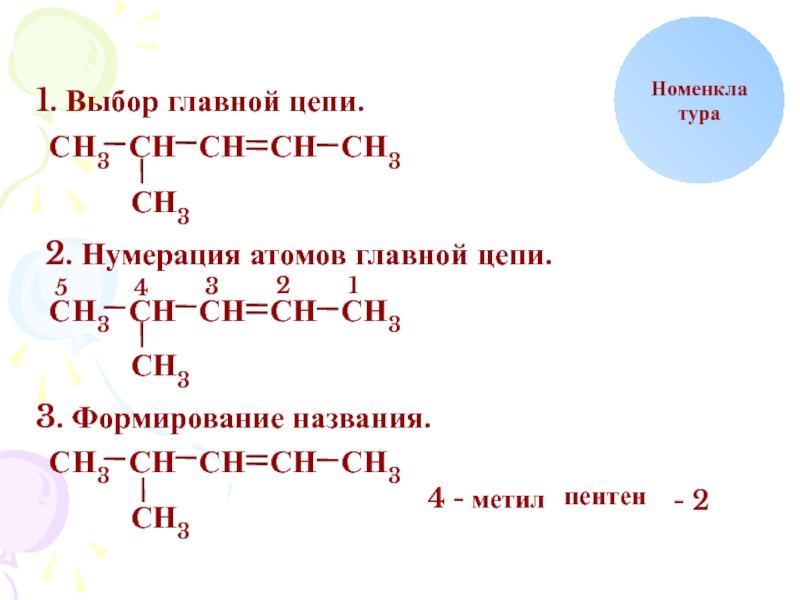
- 4. НСНоменклатура1. Выбор главной цепи.НН3ССССССН3ННН32. Нумерация атомов главной цепи.НН3ССССССН3ННН3123453. Формирование названия.НН3СССССН3НН34 - метилпентен- 2
- 5. Изомерия 1) углеродного скелетаCH2 = CH –
- 6. Физические свойства По
- 7. Строение алкенов Углеродные атомы в молекуле этилена
- 8. Каждая оставшаяся
- 9. σ-связь – плотность электронного
- 10. π- связь менее прочна, чем
- 11. Химические свойства Для алкенов
- 12. 2) Гидрирование. Легко присоединяют водород в
- 13. 4) Гидратация. В присутствии минеральных кислот олефины присоединяют
- 14. Реакция полимеризации. Реакцией полимеризации называется
- 15. *Кузнецова О.Н.Применение
- 16. Алкины
- 17. Понятие об алкинахАлкины – углеводороды, содержащие в
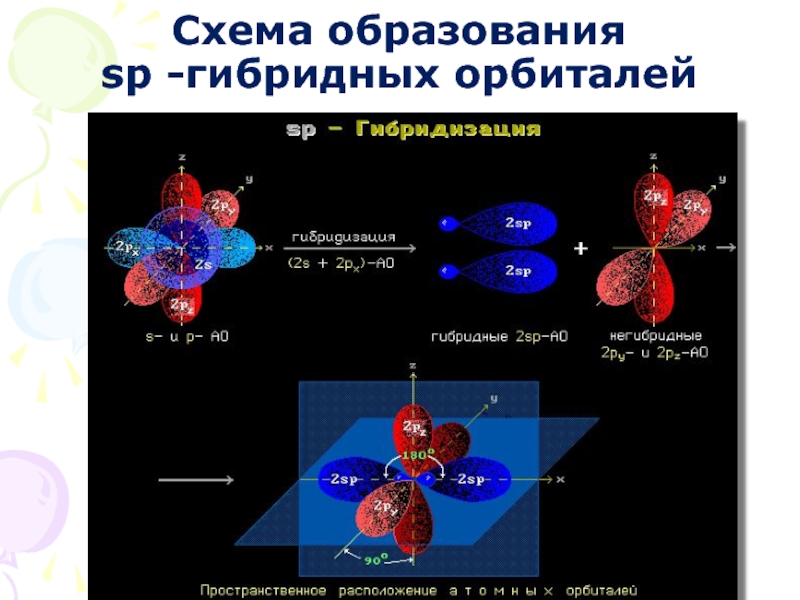
- 18. Схема образования sp -гибридных орбиталей
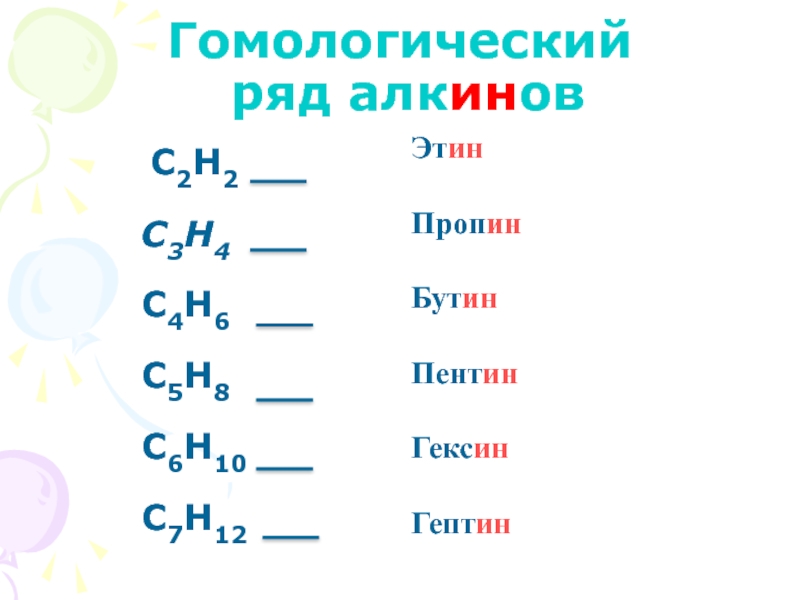
- 19. Гомологический ряд алкинов C2H2 C3H4 C4H6 C5H8 C6H10 C7H12Этин ПропинБутинПентинГексинГептин
- 20. Изомерия алкинов Структурная изомерия1. Изомерия положения тройной
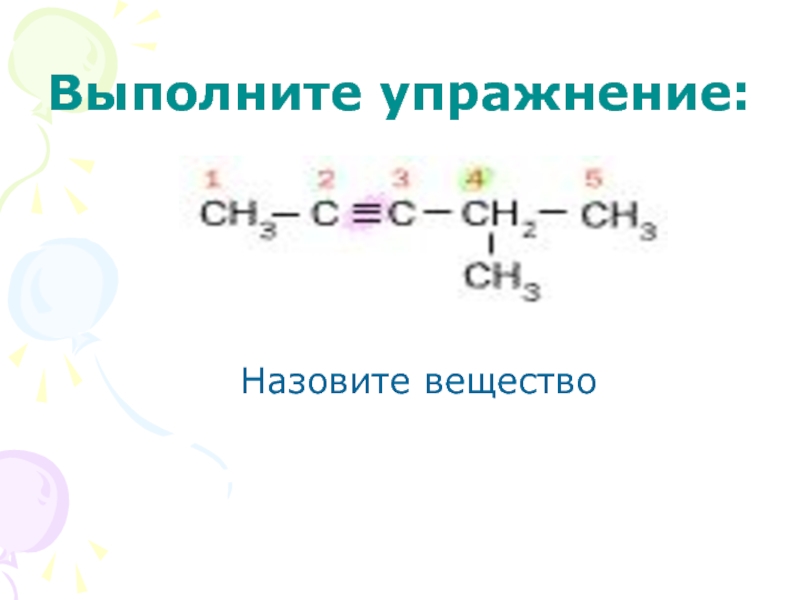
- 21. Выполните упражнение:Назовите вещество
- 22. Физические свойстваТемпературы кипения и плавления алкинов, так
- 23. Химические свойства алкиновХимические свойства ацетилена и его
- 24. Реакции присоединения1. Галогенирование Обесцвечивание бромной воды
- 25. 2. Гидрогалогенирование (+ НCl, HBr)3. Гидрирование (+Н2)4.
- 26. Горение ацетиленаПри сгорании (полном окислении) ацетилена выделяется
- 27. Реакция полимеризацииДимеризация под действием водного раствора CuCl2
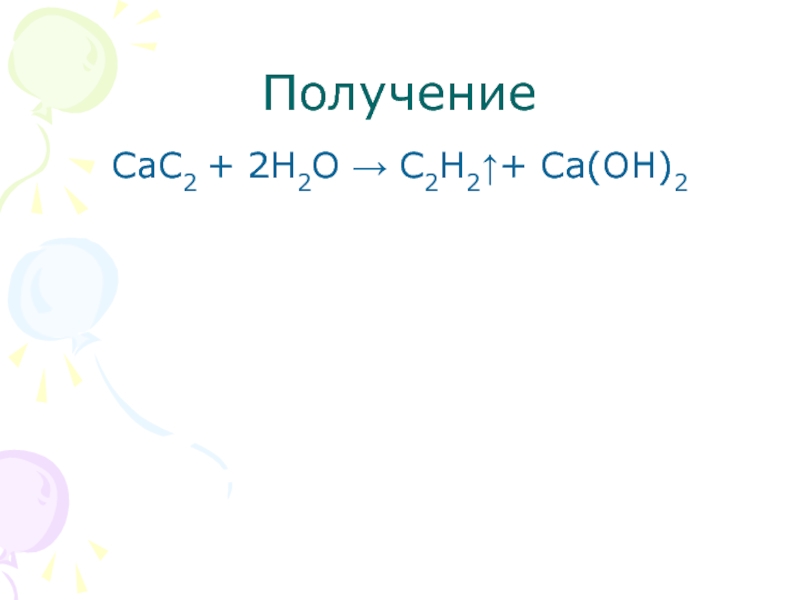
- 28. ПолучениеСaC2 + 2H2O → C2H2↑+ Ca(OH)2
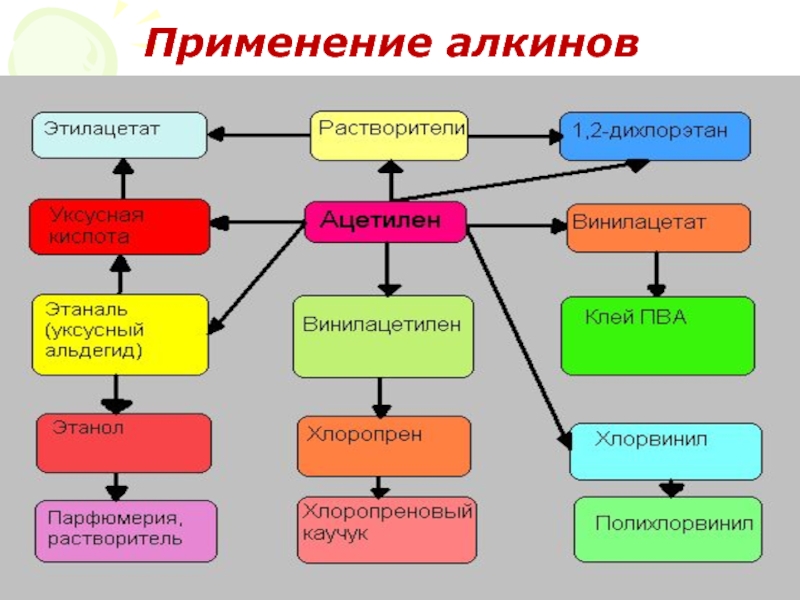
- 29. Применение алкинов
- 30. Домашнее задание§ 56 (прочитать)§ 57, упр. 1-5§ 58, упр. 5§ 59, упр. 1-2, 7
Алкены Алкенами (олефинами или этиленовыми углеводородами) называются углеводороды, содержащие в молекуле одну двойную связь и имеющие общую формулу CnH2n.
Слайд 2Алкены
Алкенами (олефинами или этиленовыми углеводородами) называются углеводороды, содержащие в
молекуле одну двойную связь и имеющие общую формулу CnH2n.
Слайд 3Номенклатура
Название алкенов по систематической номенклатуре образуют из названий аналогично построенных алканов,
заменяя суффиксы –ан на –ен, цифрой указывается номер того атома углерода, от которого начинается двойная связь.
Главная цепь атомов углерода должна обязательно включать двойную связь, и ее нумерацию проводят с того конца главной цепи, к которому она ближе.
В начале названия перечисляют радикалы с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле присутствует несколько одинаковых радикалов, то цифрой указывается место каждого из них в главной цепи и перед их названием ставят соответственно частицы ди-, три-, тетра- и т.д.
Главная цепь атомов углерода должна обязательно включать двойную связь, и ее нумерацию проводят с того конца главной цепи, к которому она ближе.
В начале названия перечисляют радикалы с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле присутствует несколько одинаковых радикалов, то цифрой указывается место каждого из них в главной цепи и перед их названием ставят соответственно частицы ди-, три-, тетра- и т.д.
Слайд 4Н
С
Номенклатура
1. Выбор главной цепи.
Н
Н3
С
С
С
С
С
СН3
Н
Н
Н3
2. Нумерация атомов главной цепи.
Н
Н3
С
С
С
С
С
СН3
Н
Н
Н3
1
2
3
4
5
3. Формирование названия.
Н
Н3
С
С
С
С
СН3
Н
Н3
4 -
метил
пентен
- 2
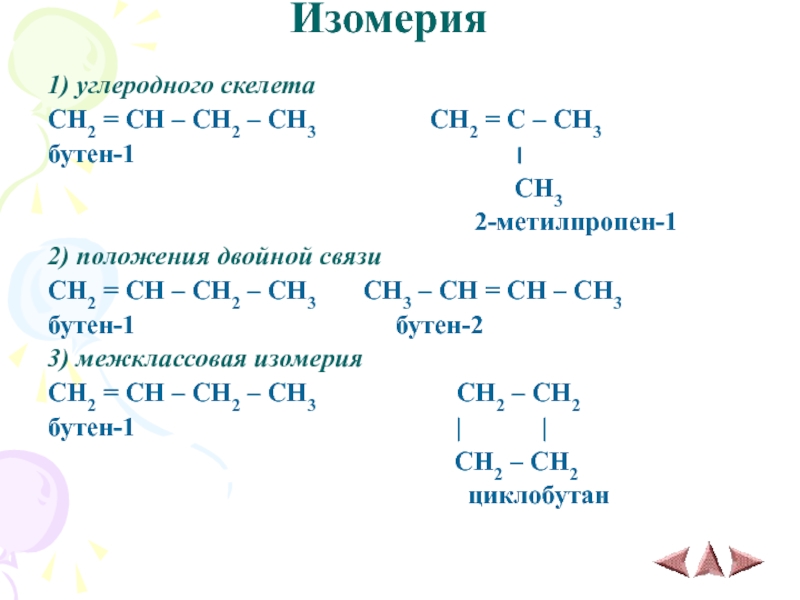
Слайд 5Изомерия
1) углеродного скелета
CH2 = CH – CH2 – CH3
CH2 = C – CH3
бутен-1 ׀
CH3
2-метилпропен-1
2) положения двойной связи
CH2 = CH – CH2 – CH3 CH3 – CH = CH – CH3
бутен-1 бутен-2
3) межклассовая изомерия
CH2 = CH – CH2 – CH3 CH2 – CH2
бутен-1 | |
CH2 – CH2
циклобутан
бутен-1 ׀
CH3
2-метилпропен-1
2) положения двойной связи
CH2 = CH – CH2 – CH3 CH3 – CH = CH – CH3
бутен-1 бутен-2
3) межклассовая изомерия
CH2 = CH – CH2 – CH3 CH2 – CH2
бутен-1 | |
CH2 – CH2
циклобутан
Слайд 6Физические свойства
По физическим свойствам этиленовые углеводороды близки
к алканам. При нормальных условиях углеводороды C2–C4 – газы, C5–C17 – жидкости, высшие представители – твердые вещества. Температура их плавления и кипения, а также плотность увеличиваются с ростом молекулярной массы. Все олефины легче воды, плохо растворимы в ней, однако растворимы в органических растворителях.
Слайд 7Строение алкенов
Углеродные атомы в молекуле этилена находятся в
состоянии sp2-гибридизации, т.е. в
гибридизации
участвуют одна s- и две p -орбитали.
Схематическое изображение строения молекулы этилена
В результате каждый атом углерода обладает тремя гибридными sp2-орбиталями, оси которых находятся в одной плоскости под углом 120º друг к другу, и одной негибридной гантелеобразной p-орбиталью, ось которой расположена под прямым углом к плоскости осей трех sp2-орбиталей. Одна из трех гибридных орбиталей атома углерода перекрывается с подобной орбиталью другого атома углерода, образуя σ- связь.
участвуют одна s- и две p -орбитали.
Схематическое изображение строения молекулы этилена
В результате каждый атом углерода обладает тремя гибридными sp2-орбиталями, оси которых находятся в одной плоскости под углом 120º друг к другу, и одной негибридной гантелеобразной p-орбиталью, ось которой расположена под прямым углом к плоскости осей трех sp2-орбиталей. Одна из трех гибридных орбиталей атома углерода перекрывается с подобной орбиталью другого атома углерода, образуя σ- связь.
Слайд 8 Каждая оставшаяся гибридная орбиталь атомов углерода
перекрывается с s- орбиталью атомов водорода, приводя к образованию в той же плоскости четырех σ- связей C–H. Две негибридные p- орбитали атомов углерода взаимно перекрываются и образуют π- связь, максимальная плотность которой расположена перпендикулярно плоскости σ- связей. Двойная связь алкенов представляет собой сочетание σ- и π- связей. Длина связи Длина связи C = C – 0,134 нм, энергия связи – 620 кДж.
Слайд 9 σ-связь – плотность электронного облака
максимальна вдоль оси,
соединяющей
ядра атомов.
π–связь – плотность электронного облака
максимальна «над» и «под» плоскостью
σ-связи.
Запомните! Простая (ординарная) связь – это всегда σ-связь. В кратных (двойных или тройных) связях – одна σ-связь, а остальные π-связи.
σ-связи всегда образованы гибридными орбиталями, π-связи – негибридными p – орбиталями.
ядра атомов.
π–связь – плотность электронного облака
максимальна «над» и «под» плоскостью
σ-связи.
Запомните! Простая (ординарная) связь – это всегда σ-связь. В кратных (двойных или тройных) связях – одна σ-связь, а остальные π-связи.
σ-связи всегда образованы гибридными орбиталями, π-связи – негибридными p – орбиталями.
Слайд 10 π- связь менее прочна, чем σ- связь, так как
p- орбитали с параллельными осями перекрываются значительно меньше, чем при образовании теми же p- орбиталями и s- орбиталями σ- связи (перекрывание осуществляется по оси орбиталей). В связи с этим, π- связь легко разрывается и переходит в две новые σ- связи посредством присоединения по месту двойной связи двух атомов или групп атомов реагирующих веществ. Для алкенов наиболее типичными являются реакции присоединения.
Слайд 11Химические свойства
Для алкенов наиболее типичными являются реакции
присоединения.
1) Галогенирование.
H2C=CH2 + Br2 → BrCH2–CH2Br
Приведенная реакция - обесцвечивание алкеном бромной воды является качественной реакцией на двойную связь.
1) Галогенирование.
H2C=CH2 + Br2 → BrCH2–CH2Br
Приведенная реакция - обесцвечивание алкеном бромной воды является качественной реакцией на двойную связь.
Слайд 12 2) Гидрирование. Легко присоединяют водород в присутствии катализаторов (Pt, Pd,
Ni) образуя предельные углеводороды.
Ni
CH3–CH=CH2 + H2 → CH3–CH2–CH3
3) Гидрогалогенирование. Этилен и его гомологи присоединяют галогеноводороды, приводя к галогенопроизводным углеводородов.
H2C=CH2 + HBr → CH3–CH2Br
Ni
CH3–CH=CH2 + H2 → CH3–CH2–CH3
3) Гидрогалогенирование. Этилен и его гомологи присоединяют галогеноводороды, приводя к галогенопроизводным углеводородов.
H2C=CH2 + HBr → CH3–CH2Br
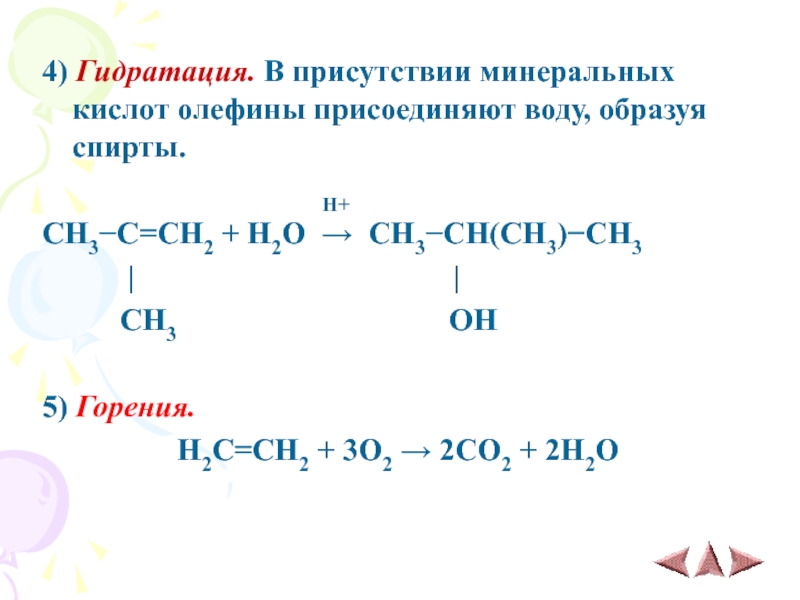
Слайд 134) Гидратация. В присутствии минеральных кислот олефины присоединяют воду, образуя спирты.
H+
CH3−C=CH2 + H2O → CH3−CH(CH3)−CH3
| |
CH3 OH
5) Горения.
H2C=CH2 + 3O2 → 2CO2 + 2H2O
CH3−C=CH2 + H2O → CH3−CH(CH3)−CH3
| |
CH3 OH
5) Горения.
H2C=CH2 + 3O2 → 2CO2 + 2H2O
Слайд 14Реакция полимеризации.
Реакцией полимеризации называется процесс соединения одинаковых молекул
в более крупные молекулы.
При полимеризации двойные связи в молекулах исходного непредельного соединения "раскрываются", и за счет образующихся свободных валентностей эти молекулы соединяются друг с другом. t, кат. n CH2 = CH2 → (- CH2 – CH2 -)n
При полимеризации двойные связи в молекулах исходного непредельного соединения "раскрываются", и за счет образующихся свободных валентностей эти молекулы соединяются друг с другом. t, кат. n CH2 = CH2 → (- CH2 – CH2 -)n
Слайд 17Понятие об алкинах
Алкины – углеводороды, содержащие в молекуле одну тройную связь
между атомами углерода, а качественный и количественный состав выражается общей формулой
СnН2n - 2, где n ≥ 2.
Алкины относятся к непредельным углеводородам, так как их молекулы содержат меньшее число атомов водорода, чем насыщенные.
СnН2n - 2, где n ≥ 2.
Алкины относятся к непредельным углеводородам, так как их молекулы содержат меньшее число атомов водорода, чем насыщенные.
Слайд 19Гомологический
ряд алкинов
C2H2
C3H4
C4H6
C5H8
C6H10
C7H12
Этин
Пропин
Бутин
Пентин
Гексин
Гептин
Слайд 20Изомерия алкинов
Структурная изомерия
1. Изомерия положения тройной связи (начиная с С4Н6):
СН
≡С−СН2−СН3 СН3−С≡С−СН3
бутин-1 бутин-2
2. Изомерия углеродного скелета (начиная с С5Н8):
СН ≡С−СН2−СН2−СН3 СН ≡С−СН−СН3
⏐
СН3
пентин-1 3-метилбутин-1
3. Межклассовая изомерия с алкадиенами и циклоалкенами, (начиная с С4Н8):
СН = СН
СН ≡С–СН2–СН3 СН2=СН–СН=СН2 ⏐ ⏐
СН2 –СН2
бутин-1 бутадиен-1,3 циклобутен
бутин-1 бутин-2
2. Изомерия углеродного скелета (начиная с С5Н8):
СН ≡С−СН2−СН2−СН3 СН ≡С−СН−СН3
⏐
СН3
пентин-1 3-метилбутин-1
3. Межклассовая изомерия с алкадиенами и циклоалкенами, (начиная с С4Н8):
СН = СН
СН ≡С–СН2–СН3 СН2=СН–СН=СН2 ⏐ ⏐
СН2 –СН2
бутин-1 бутадиен-1,3 циклобутен
Слайд 22Физические свойства
Температуры кипения и плавления алкинов, так же как и алкенов,
закономерно повышаются при увеличении молекулярной массы соединений.
Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены.
Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены.
Слайд 23Химические свойства алкинов
Химические свойства ацетилена и его гомологов в основном определяются
наличием в их молекулах тройной связи. Наиболее характерны для алкинов реакции присоединения.
Слайд 24Реакции присоединения
1. Галогенирование
Обесцвечивание бромной воды является качественной реакцией на
все непредельные углеводороды
СН ≡ СН + Br2 → Br - СН = СН – Br
1,2 - дибромэтен
Br - СН = СН – Br + Br2 → Br2НС-СНBr2
1,1,2,2-тетрабромэтан
СН ≡ СН + Br2 → Br - СН = СН – Br
1,2 - дибромэтен
Br - СН = СН – Br + Br2 → Br2НС-СНBr2
1,1,2,2-тетрабромэтан
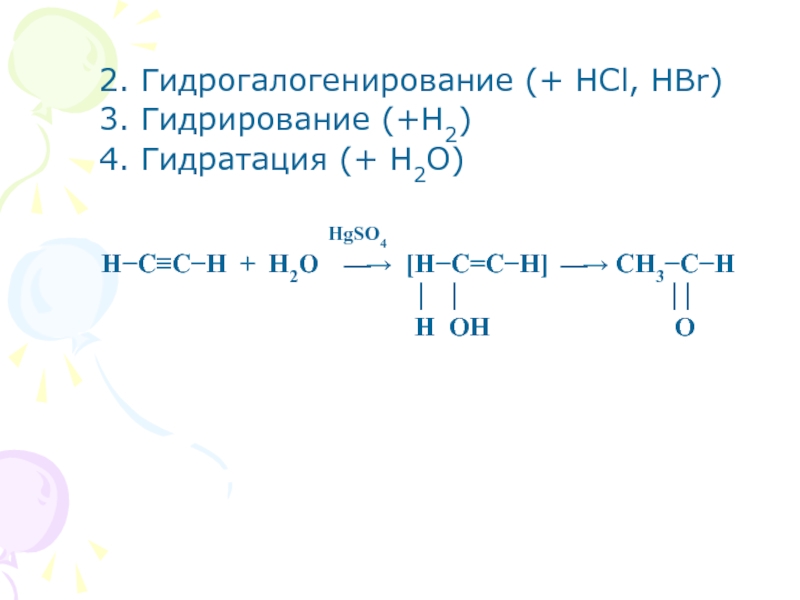
Слайд 252. Гидрогалогенирование (+ НCl, HBr)
3. Гидрирование (+Н2)
4. Гидратация (+ H2O)
HgSO4
Н−C≡C−H + H2O ⎯→ [H−C=C−H] ⎯→ CH3−C−H
⏐ ⏐ ⏐⏐
H OH O
Н−C≡C−H + H2O ⎯→ [H−C=C−H] ⎯→ CH3−C−H
⏐ ⏐ ⏐⏐
H OH O
Слайд 26Горение ацетилена
При сгорании (полном окислении) ацетилена выделяется большое количества тепла:
HC≡CH +
2О2 ⎯→ 2СО2 + Н2О
Слайд 27Реакция полимеризации
Димеризация под действием водного раствора CuCl2 и NH4Cl:
НC≡CH
+ НC≡CH ⎯→ Н2C=CH−C≡CH
(винилацетилен)
(винилацетилен)