- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Алгоритм решения задач третьего типа
Содержание
Слайд 1Алгоритм решения задач третьего типа
(Определить массу исходного вещества)
1) Прочитай внимательно условие
2) Запиши: «Дано» и «Найти».
3) Составь уравнение реакции (не забудь расставить коэффициенты).
4) Вычисли массу теоретическую продукта реакции, по обратной формуле (m пр / ω вых) .
5) Вычисли массу исходного вещества по уравнению реакции.
Слайд 21. Внимательно прочитай условие задачи
При действии оксида углерода (II) на оксид
Найдите массу использованного оксида железа (III), учитывая, что доля выхода продуктов реакции составляет 80% от теоретически возможного.
2. Составьте «Дано» и «Найти»
Дано:
m пр (Fe) = 11,2 г
ω вых (Fe) = 80%
Найти:
M (Fe2O3) - ?
Решение:
Слайд 3
3) Составь уравнение реакции
(не забудь расставить коэффициенты).
Дано:
m пр (Fe) =
ω вых (Fe) = 80%
Найти:
M (Fe2O3) - ?
Решение:
Fe2O3 + 3CO = 2Fe + 3CO2
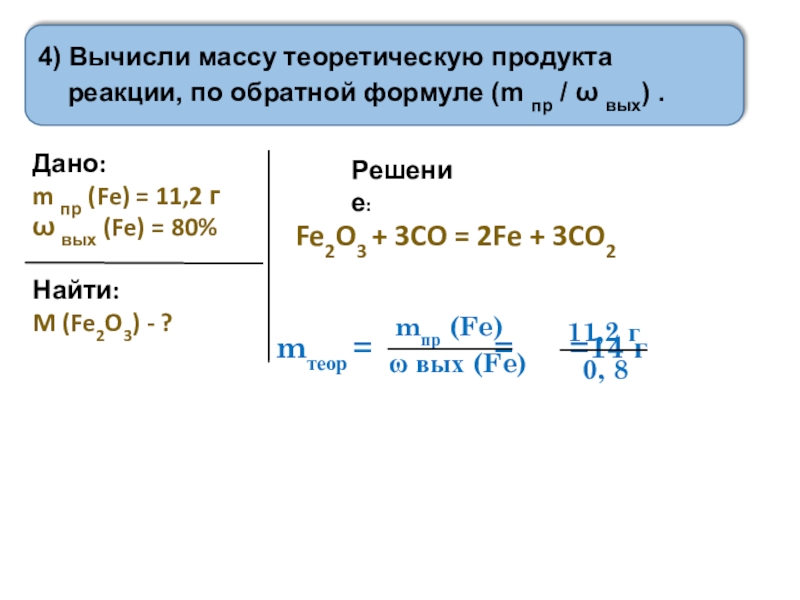
Слайд 44) Вычисли массу теоретическую продукта реакции, по обратной формуле (m пр
Дано:
m пр (Fe) = 11,2 г
ω вых (Fe) = 80%
Найти:
M (Fe2O3) - ?
Решение:
Fe2O3 + 3CO = 2Fe + 3CO2
mтеор = = =14 г
mпр (Fe)
ω вых (Fe)
11,2 г
0, 8
Слайд 5 5) Вычисли массу исходного вещества по уравнению реакции.
Дано:
m
ω вых (Fe) = 80%
Найти:
M (Fe2O3) - ?
Решение:
Fe2O3 + 3CO = 2Fe + 3CO2
mтеор = = =14 г
mпр(Fe)
ωвых(Fe)
11,2 г
0, 8
По уравнению:
n(Fe2O3) = ½ n (Fe) = ½ = ½ = 0,125 моль
M (Fe)
m (Fe)
14 г
56 г/моль
m(Fe2O3) = n M = 0,125 моль 160 г/моль = 20 г
Ответ: 20 грамм