- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему 30. Урок по теме Соли аммония
Содержание
- 1. 30. Урок по теме Соли аммония
- 2. Соли аммония представляют собой твёрдые кристаллические вещества,
- 3. Получение солей аммония проводят путем взаимодействия аммиака
- 4. Соли аммония обладают всеми типичными свойствами солей,
- 5. Взаимодействие карбоната аммония с кислотами обусловлено образованием
- 6. Качественная реакция на ионы аммонияNH4Cl + NaOH = NH3↑ + H2O + NaCl
- 7. Распознать аммиак можно:По характерному запахуИспользуя влажную лакмусовую
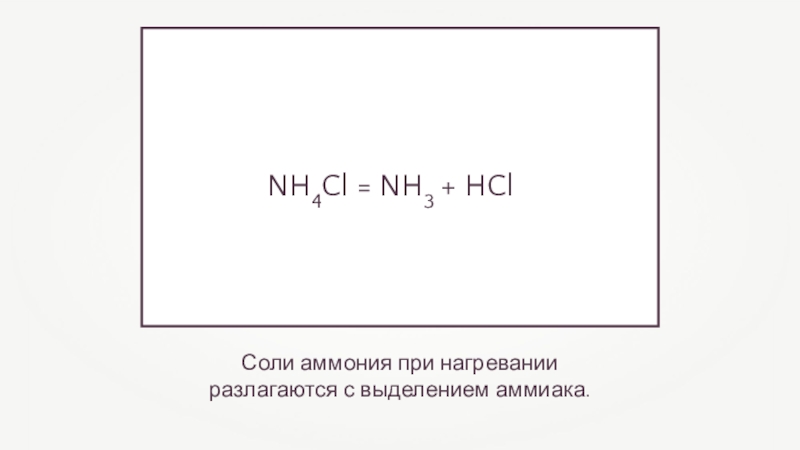
- 8. Соли аммония при нагревании разлагаются с выделением аммиака.NH4Cl = NH3 + HCl
- 9. Применение солей аммонияАзот является необходимым элементом для
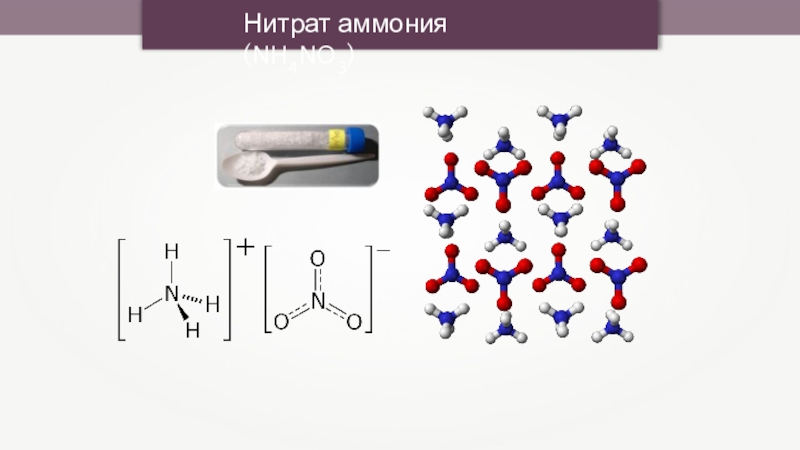
- 10. Нитрат аммония (NH4NO3)
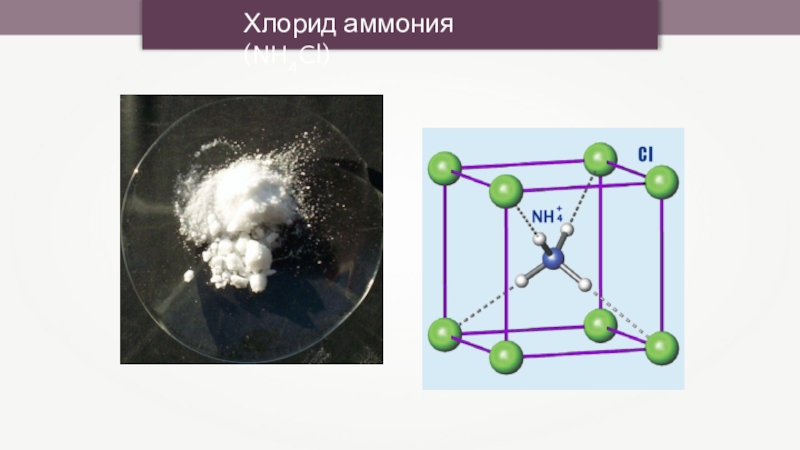
- 11. Хлорид аммония (NH4Cl)
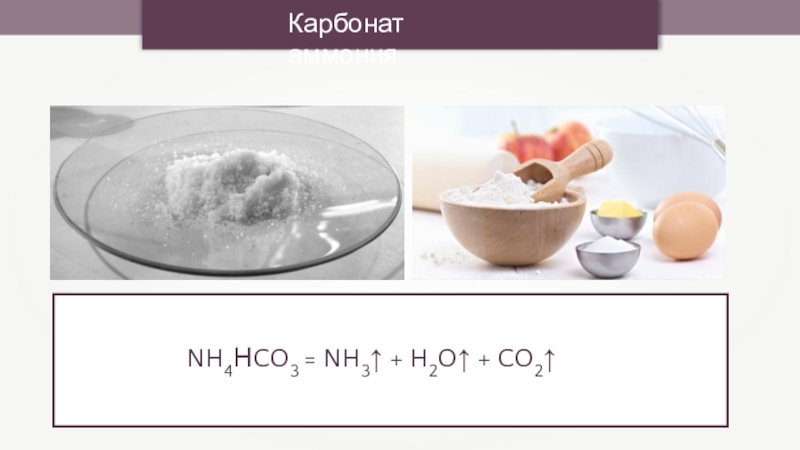
- 12. Карбонат аммонияNH4НCO3 = NH3↑ + H2O↑ + CO2↑
- 13. Использование карбоната и гидрокарбоната аммония эффективнее использования
- 14. Аммонал
Слайд 1
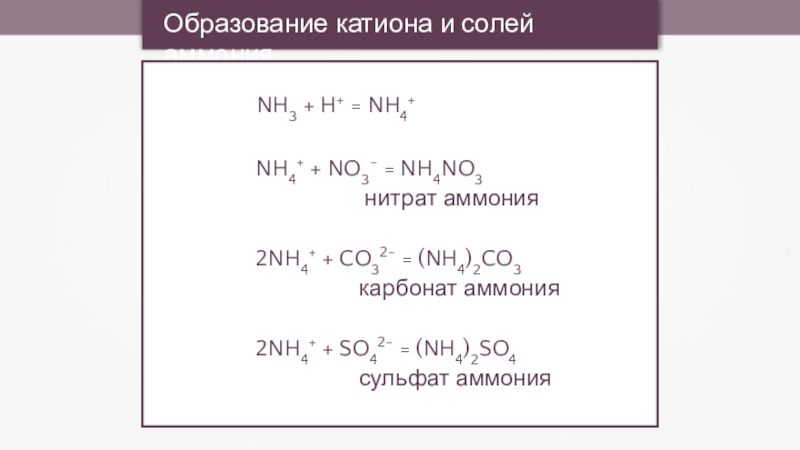
Образование катиона и солей аммония
NH3 + H+ = NH4+
NH4+ + NO3-
нитрат аммония
2NH4+ + CO32- = (NH4)2CO3
карбонат аммония
2NH4+ + SO42- = (NH4)2SO4
сульфат аммония
Слайд 2
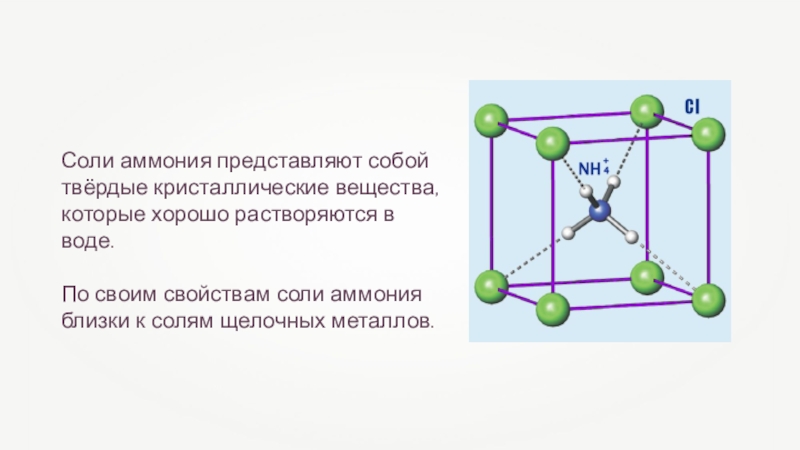
Соли аммония представляют собой твёрдые кристаллические вещества, которые хорошо растворяются в
По своим свойствам соли аммония близки к солям щелочных металлов.
Слайд 3
Получение солей аммония проводят путем взаимодействия аммиака или его водного раствора
NH3 + HCl = NH4Cl
2NH3 + H2SO4 = (NH4)2SO4
Слайд 4
Соли аммония обладают всеми типичными свойствами солей, которые связаны с наличием
NH4Cl + AgNO3 = NH4NO3 + AgCl↓
(NH4)2SO4 + BaCl2 = 2NH4Cl + BaSO4↓
Слайд 5
Взаимодействие карбоната аммония с кислотами обусловлено образованием углекислого газа в ходе
(NH4)2CO3 + H2SO4 = (NH4)2SO4 + H2O + CO2↑
Слайд 7
Распознать аммиак можно:
По характерному запаху
Используя влажную лакмусовую бумажку, которая в присутствии
По белому дыму, который появляется при внесении в аммиак стеклянной палочки, смоченной соляной кислотой
Слайд 9
Применение солей аммония
Азот является необходимым элементом для полноценного роста растений, но
Слайд 13
Использование карбоната и гидрокарбоната аммония эффективнее использования пищевой соды, в которой
NaHCO3 = Na2CO3 + H2O + CO2↑