- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему 14. Урок Щелочные металлы
Содержание
- 1. 14. Урок Щелочные металлы
- 2. А. Арфведсон 1792–1841 гг. Литий был открыт в
- 3. Г. Деви 1778–1829 гг. Впервые литий был получен английским химиком Г. Дэви в 1818 г.
- 4. ЛитийDnn87
- 5. Использование лития
- 6. Использование лития
- 7. Г. Деви 1778–1829 гг. В 1807 г. английский
- 8. НатрийDnn87
- 9. Слайд 9
- 10. Натрий содержится в организме человека: в эритроцитах
- 11. Слайд 11
- 12. Слайд 12
- 13. Металлическим натрием восстанавливают из соединений такие ценные металлы, как цирконий, тантал. ЦирконийAlchemist-hpТантал
- 14. КалийDnn87
- 15. В природе калий встречается только в соединениях
- 16. Слайд 16
- 17. Калий используют обычно в форме солей. Калийные
- 18. Калий
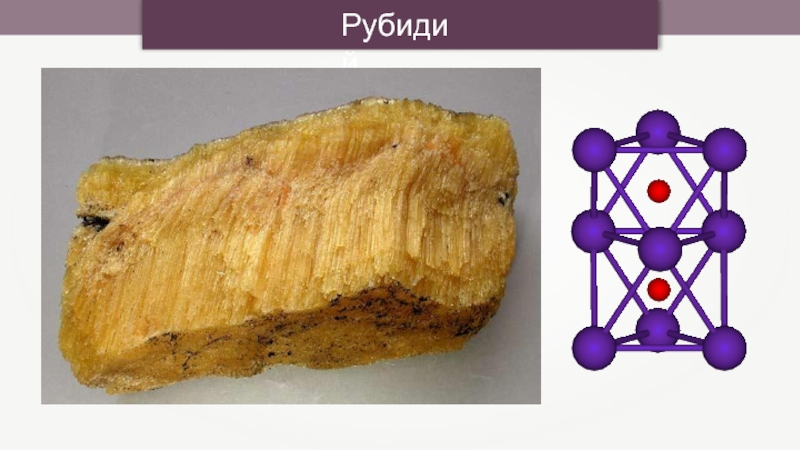
- 19. Рубидий
- 20. Рубидий
- 21. ЦезийMagnus Manske
- 22. ФранцийМаргарита Пере 1909–1975 гг. Франций был открыт в
- 23. Строение атомов щелочных металлов и их свойства
- 24. Металлические свойстваМеталлический блескПластичностьМягкостьХорошая электропроводностьХорошая теплопроводность
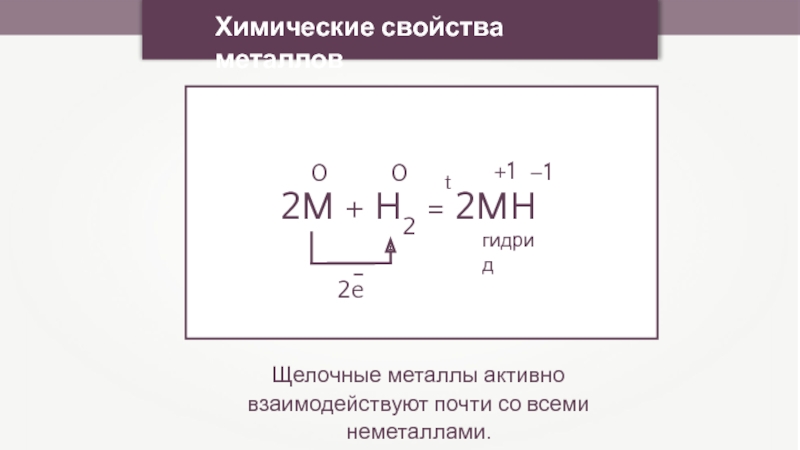
- 25. Химические свойства металловЩелочные металлы активно взаимодействуют почти со всеми неметаллами. 2M + H2 = 2MH00+1–12e–гидридt
- 26. Химические свойства металловПри взаимодействии щелочных металлов с галогенами образуются соли (галогениды металлов).2M + Cl2 = 2MCl00+1–12e–хлоридt
- 27. Химические свойства металловПри взаимодействии щелочных металлов с серой образуются сульфиды металлов.2M + S = M2S00+1–22e–сульфидt
- 28. Реакция взаимодействия щелочных металлов с кислородом4Li + O2 = 2Li2O00+1–2t
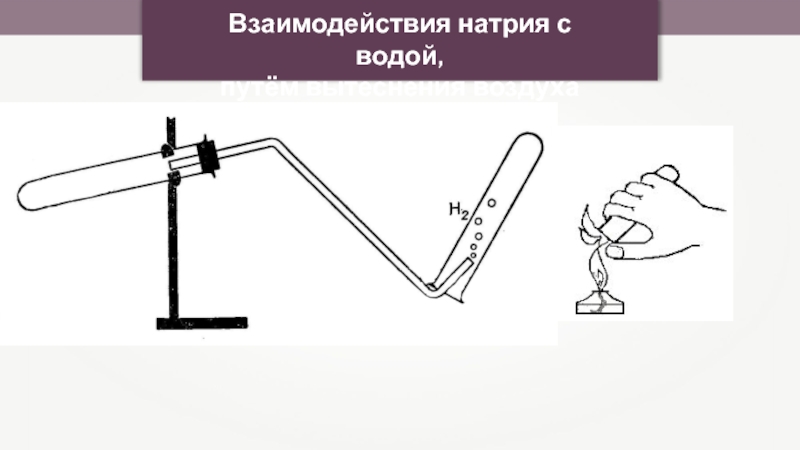
- 29. Взаимодействия натрия с водой, путём вытеснения воздуха
- 30. При взаимодействии с водой щелочные металлы образуют
- 31. Соединения щелочных металловГалитСильвинит
- 32. Оксиды щелочных металловОксиды щелочных металлов являются типичными
- 33. Гидроксиды щелочных металловГидроксиды щелочных металлов являются сильными
- 34. Соли щелочных металловГидроксид натрия
- 35. Соли щелочных металловХлорид натрия
- 36. Соли щелочных металлов
- 37. Соли щелочных металлов
- 38. Самая значительная способность калия — поддерживать работу
Слайд 2
А. Арфведсон
1792–1841 гг.
Литий был открыт в 1817 г. шведским химиком
А. Арфведсоном. Металл назвали литием, что в переводе с греческого означает «камень».
Слайд 7
Г. Деви
1778–1829 гг.
В 1807 г. английский химик и физик
Г.
Он первым изучил его свойства.
Слайд 10
Натрий содержится в организме человека: в эритроцитах крови, сыворотке, пищеварительных соках,
Слайд 13
Металлическим натрием восстанавливают из соединений такие ценные металлы, как цирконий, тантал.
Цирконий
Alchemist-hp
Тантал
Слайд 15
В природе калий встречается только в соединениях с другими элементами, например,
Очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь.
Слайд 17
Калий используют обычно в форме солей. Калийные удобрения — это природные
Слайд 22
Франций
Маргарита Пере
1909–1975 гг.
Франций был открыт в 1939 г. Маргаритой Пере.
Слайд 24
Металлические свойства
Металлический блеск
Пластичность
Мягкость
Хорошая электропроводность
Хорошая теплопроводность
Слайд 25
Химические свойства металлов
Щелочные металлы активно взаимодействуют почти со всеми неметаллами.
2M
0
0
+1
–1
2e
–
гидрид
t
Слайд 26
Химические свойства металлов
При взаимодействии щелочных металлов с галогенами образуются соли (галогениды
2M + Cl2 = 2MCl
0
0
+1
–1
2e
–
хлорид
t
Слайд 27
Химические свойства металлов
При взаимодействии щелочных металлов с серой образуются сульфиды металлов.
2M
0
0
+1
–2
2e
–
сульфид
t
Слайд 30
При взаимодействии с водой щелочные металлы образуют щёлочи, восстанавливая воду до
2Na + H2O = 2NaOH + H2↑
0
+1
+1
0
2K + H2O = 2KOH + H2↑
0
+1
+1
0
Слайд 32
Оксиды щелочных металлов
Оксиды щелочных металлов являются типичными основными оксидами, они обладают
R2O +H2O =2ROH
Слайд 33
Гидроксиды щелочных металлов
Гидроксиды щелочных металлов являются сильными основаниями. Они участвуют во
Na2O + H2O = 2NaOH
K2O+HNO3 = 2KNO3 + H2O
нитрат калия
Слайд 38
Самая значительная способность калия — поддерживать работу сердечной мышцы, поэтому нехватка
Взрослый человек должен в сутки потреблять с пищей 3,5 г ионов калия.