- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад урока Уравнение состояния идеального газа. Газовые законы
Содержание
- 1. Презентация урока Уравнение состояния идеального газа. Газовые законы
- 2. Уравнение Клапейрона-Менделеева.Объединенный газовый закон.Газовые законы.Закон Бойля-Мариотта.Закон Гей-Люссака.Закон Шарля.
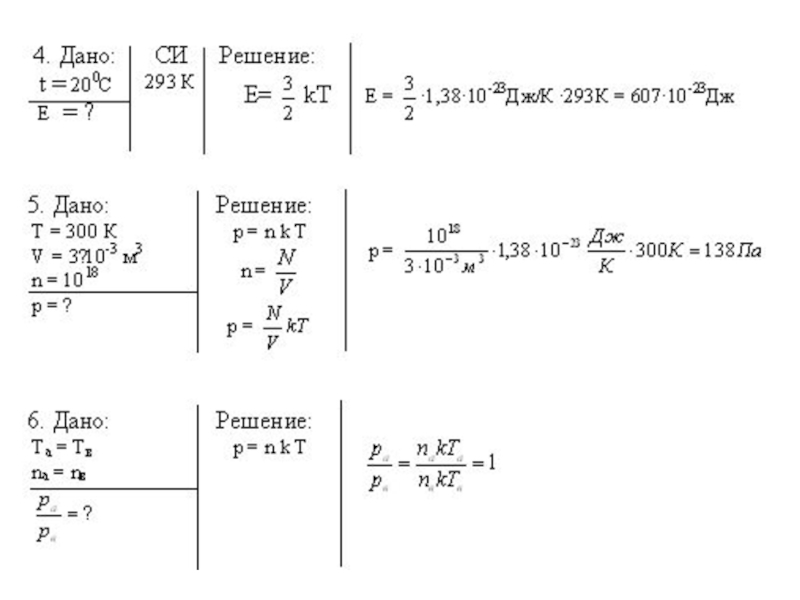
- 3. Решение задач1.Температура по шкале Кельвина 300 К,
- 4. Слайд 4
- 5. Слайд 5
- 6. ВопросыКакие температурные шкалы вы знаете?Каким прибором определяют
- 7. Из основного уравнения МКТ:
- 8. Из основного уравнения МКТ:
- 9. Из основного уравнения МКТ:
- 10. Из основного уравнения МКТ:
- 11. Из основного уравнения МКТ: Следовательно, величина пропорциональна температуре:
- 12. Из основного уравнения МКТ: Следовательно, величина пропорциональна температуре:
- 13. Из основного уравнения МКТ: Следовательно, величина пропорциональна температуре:
- 14. Из основного уравнения МКТ: Следовательно, величина пропорциональна температуре:
- 15. Из основного уравнения МКТ: Следовательно, величина пропорциональна температуре:
- 16. Из основного уравнения МКТ: Следовательно, величина пропорциональна температуре:
- 17. Уравнение Клапейрона-МенделееваR – универсальная газовая постоянная.
- 18. Уравнение Клапейрона-МенделееваR – универсальная газовая постоянная.R = 8,31
- 19. Обозначим параметры первого состояния газа – p1,V1,T1;
- 20. Процессы, при которых масса газа и один
- 21. ПланНазвание и формулировка процесса.Кто установил закон? Биография. Постоянная величина. Формула.График.Демонстрация. Объяснение результатов.
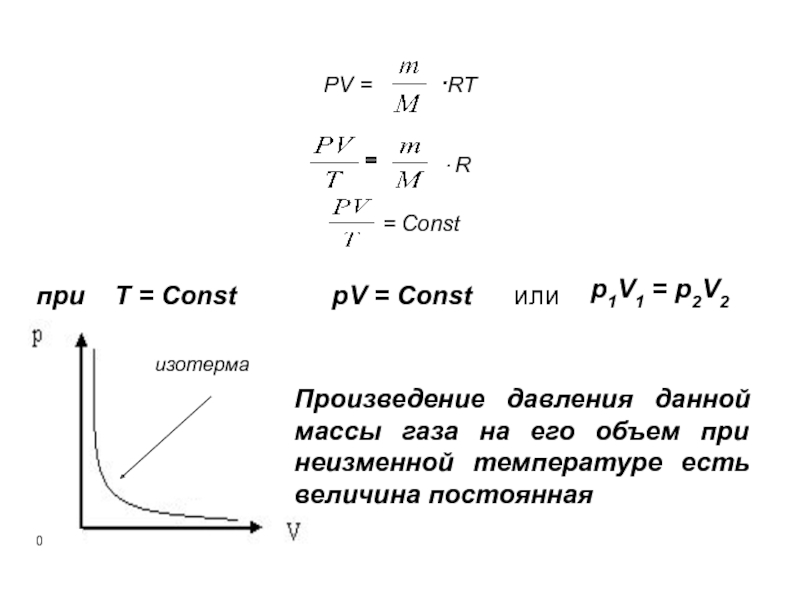
- 22. Изотермический процесс Процесс изменения состояния
- 23. РV = ·RT = ·
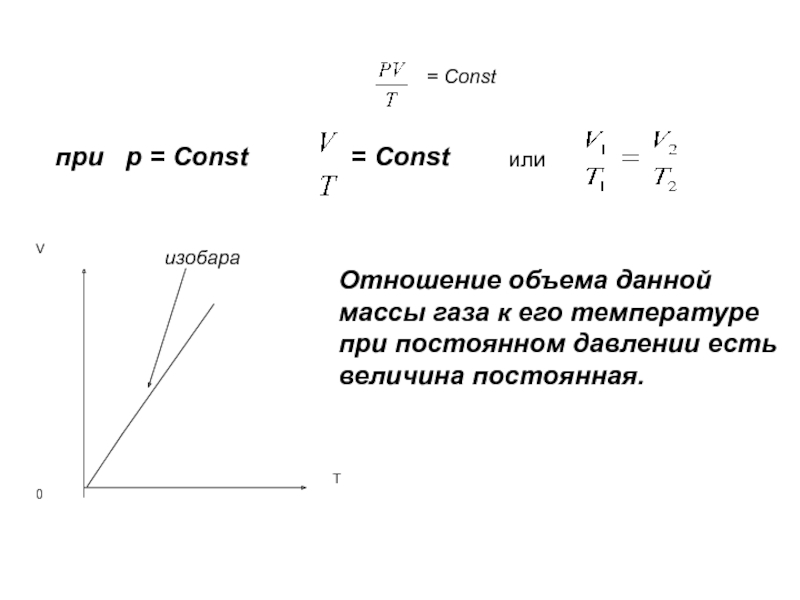
- 24. Изобарный процесс Процесс изменения состояния
- 25. = Constпри р = Const= Constили
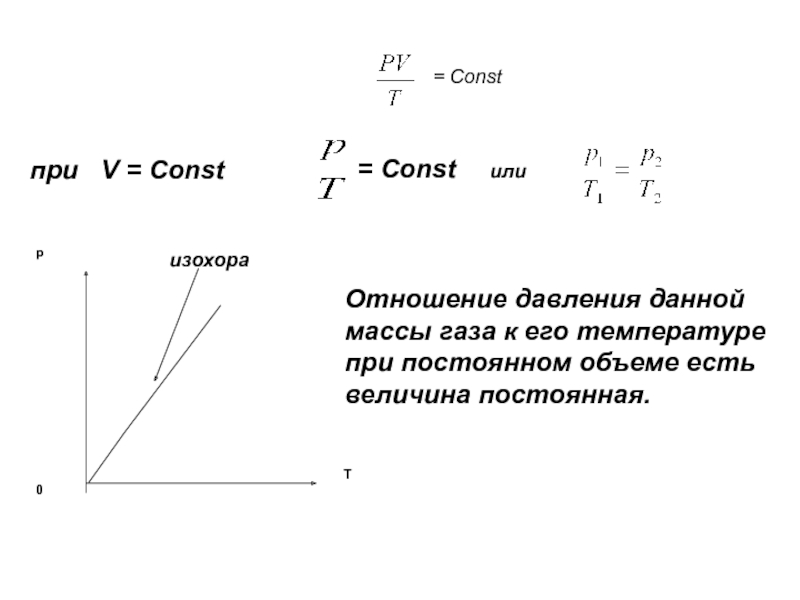
- 26. Изохорный процесс Процесс изменения состояния
- 27. = Constпри V = Const= Const
- 28. Решение задач№ 167. При давлении 1,05· 105
- 29. Домашнее задание - подготовить с помощью
Слайд 2Уравнение Клапейрона-Менделеева.
Объединенный газовый закон.
Газовые законы.
Закон Бойля-Мариотта.
Закон Гей-Люссака.
Закон Шарля.
Слайд 3Решение задач
1.Температура по шкале Кельвина 300 К, определите температуру по шкале
2. Какое количество вещества содержится в 19,2 кг меди?
3. Найти число атомов в алюминиевом предмете массой 200 г.
4.Определить среднюю кинетическую энергию идеального газа при температуре 20 0С.
5. Какое давление производят пары ртути в баллоне ртутной лампы объемом 3· 10 –5 м3 при 300 К, если в ней содержится 1018 молекул?
6. В первом сосуде находится азот, во втором – водород. Чему равно отношение ,если температура и концентрация молекул одинаковые?
Слайд 6Вопросы
Какие температурные шкалы вы знаете?
Каким прибором определяют температуру?
На чем основано действие
Как вычислить термодинамическую температуру?
Что называют абсолютным нулем?
Можно ли достичь абсолютного нуля? Почему?
Как вычисляют среднюю кинетическую энергию молекул газа?
Как вычисляют среднюю квадратичную скорость движения молекул газа?
Почему при вычислении скорости молекул по формуле получили значения более 500 м/с, а запах распространяется очень медленно?
Слайд 19Обозначим параметры первого состояния газа – p1,V1,T1; параметры второго состояния газа –
Слайд 20Процессы, при которых масса газа и один из его параметров (температура,
Изотермический процесс
Изобарный процесс
Изохорный процесс
Слайд 21План
Название и формулировка процесса.
Кто установил закон? Биография.
Постоянная величина.
Формула.
График.
Демонстрация. Объяснение
Слайд 22Изотермический процесс
Процесс изменения состояния системы при постоянной температуре называется
Роберт Бойль
1627 - 1691
Эдм Мариотт
1620 - 1684
(закон Бойля – Мариотта)
Слайд 23РV = ·RT
=
· R
= Const
при
pV = Const
или
p1V1 = p2V2
Произведение давления данной массы газа на его объем при неизменной температуре есть величина постоянная
Слайд 24Изобарный процесс
Процесс изменения состояния системы при постоянном давлении называется
Жозеф Луи Гей-Люссак
1778 - 1850
(закон Гей-Люссака)
Слайд 25= Const
при р = Const
= Const
или
Отношение объема данной массы
Слайд 26Изохорный процесс
Процесс изменения состояния системы при постоянном объеме называется
Жак Александр Сезар Шарль
1746 - 1823
(закон Шарля)
Слайд 27= Const
при V = Const
= Const
или
Отношение давления
Слайд 28Решение задач
№ 167. При давлении 1,05· 105 Па объем воздуха 6
№ 168. При заполнении баллона газом до давления 2·107 Па температура газа повысилась до 600С. Каким станет давление газа после охлаждения баллона до 100С?
№ 169. В цилиндре под поршнем находится 6·10-3 м3 газа при температуре 323 К. До какого объема необходимо изобарно сжать этот газ, чтобы его температура понизилась до 223 К?
Слайд 29Домашнее задание
- подготовить с помощью конспекта устные ответы на
- изучить стр. 183-191 учебник Мякишев Г.Я., Буховцев Б.Б.;
- решить задачу № 166:
При температуре 7270С газ занимает объем 8 л и производит давление 2 · 105 Па на стенки сосуда. При каком давлении этот газ при температуре 230С будет занимать объем 160 л?