Светлана Дмитриевна
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физике Уравнение Менделеева-Клапейрона. Газовые законы (1 курс СПО)
Содержание
- 1. Презентация по физике Уравнение Менделеева-Клапейрона. Газовые законы (1 курс СПО)
- 2. Цель урока
- 3. План урока
- 4. Ключи к тесту и критерии оценки
- 5. Анализ ошибок
- 6. ПовторениеИдеальный газ – это газ, в котором взаимодействием между молекулами можно пренебречь.
- 7. Повторение1) Масса молекулы (атома) - mo, 2)
- 8. ПовторениеДавление, объем и температура. Р – давление, [Па].V - объём, [м3].Т – температура, [К].
- 9. Повторение Ек – средняя кинетическая энергия поступательного движения частиц;Т - термодинамическая температура;k – постоянная Больцмана.
- 10. Повторениеm0 – масса молекулы;v - средняя квадратичная скорость молекул.
- 11. ПовторениеКонцентрация – отношение числа молекул к объёму. n – концентрация;N - число молекул;V - объём.
- 12. ПовторениеКоличество вещества – это отношение числа молекул
- 13. ПовторениеВ 1 моле содержится NA= 6,02 ·1023
- 14. ПовторениеМолярная масса – масса 1 моля вещества.
- 15. Повторениеp – давление газа.n – концентрация.m0 -
- 16. Изучение нового материала
- 17. Уравнение Клапейрона1 Преобразуйте выражение учитывая, что2. Преобразуйте
- 18. Клапейрон Бенуа Поль Эмиль
- 19. Менделеев Дмитрий Иванович (8.II.1834–2.II.1907)Обобщив уравнение Клапейрона,
- 20. Уравнение Менделеева R - универсальная газовая
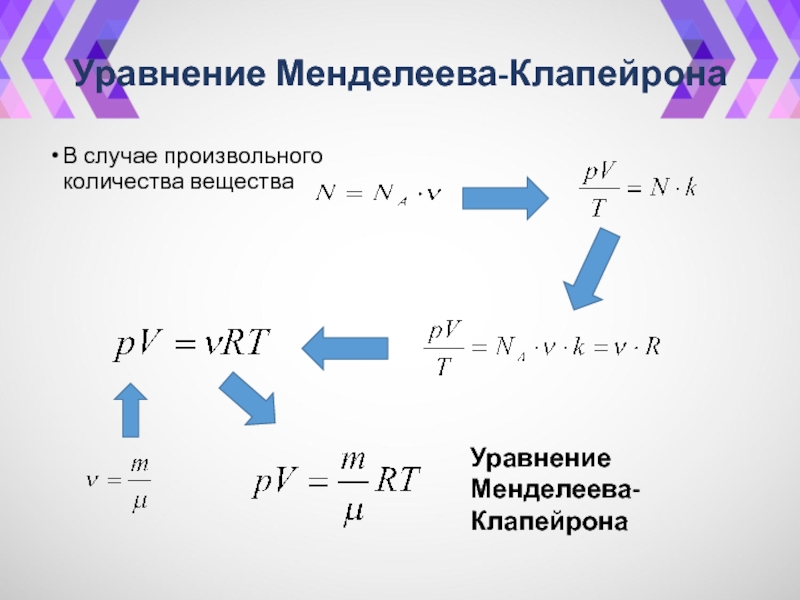
- 21. Уравнение Менделеева-КлапейронаВ случае произвольного количества вещества Уравнение Менделеева-Клапейрона
- 22. Для чего это нужно?Уравнение позволяет определить одну
- 23. Для чего это нужно?Зная уравнение состояния, можно
- 24. Для чего это нужно?Зная уравнение состояния, можно
- 25. ИЗОПРОЦЕСС – изменение состояния идеального газа при
- 26. Изопроцессы, m=constИзотермический (T=const)Изохорный (V=const) Изобарный (p=const)
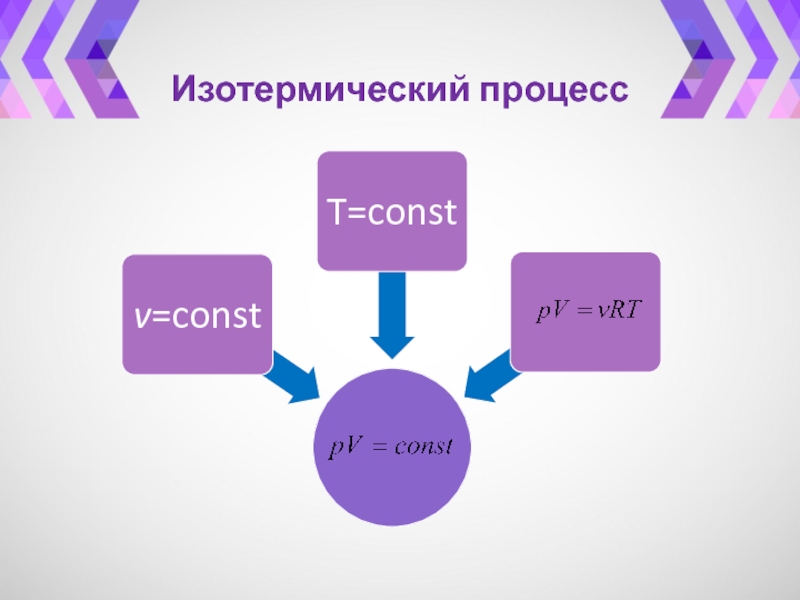
- 27. Изотермический процесс
- 28. Изотермический процесс(p ~ 1/V).Закон Бойля-МариоттаИзотерма
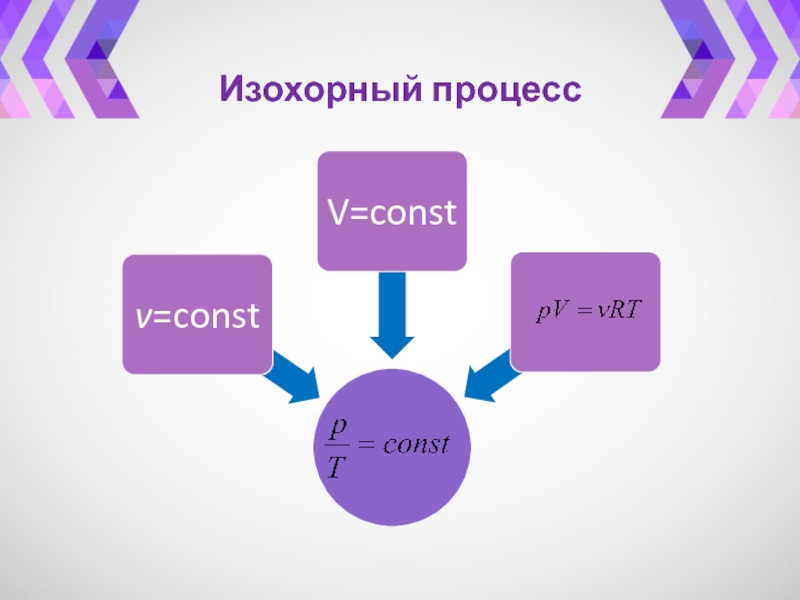
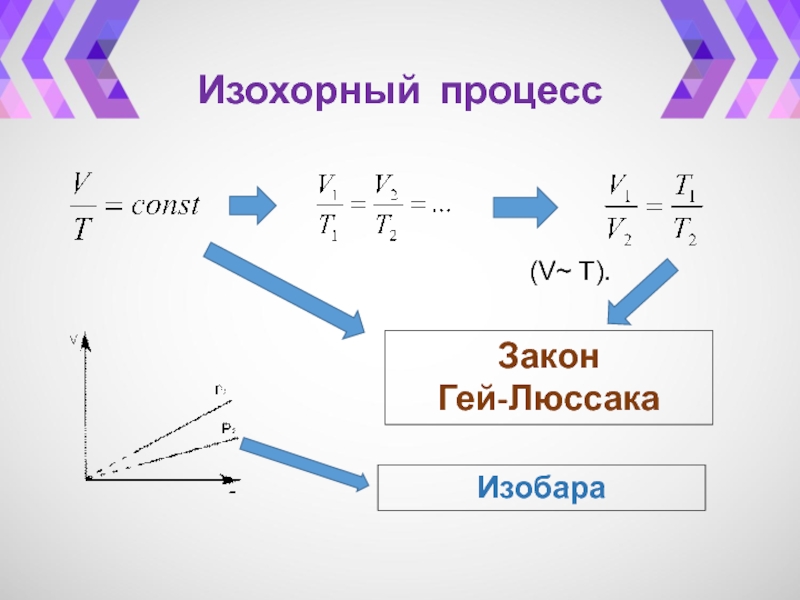
- 29. Изохорный процесс
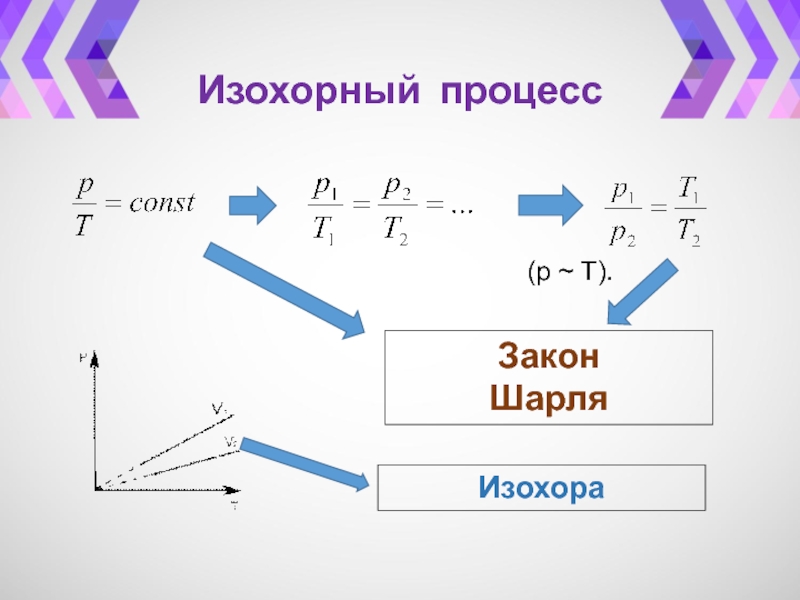
- 30. Изохорный процесс(p ~ T).Закон ШарляИзохора
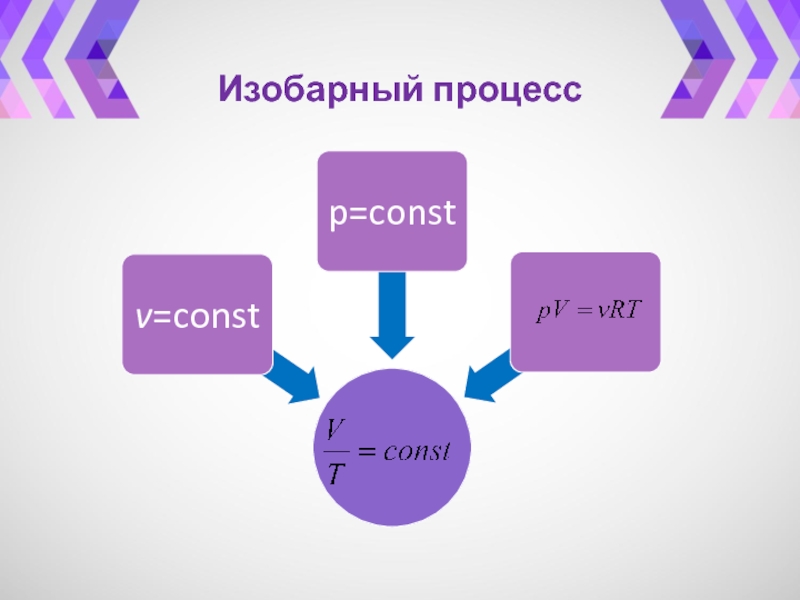
- 31. Изобарный процесс
- 32. Изохорный процесс(V~ T).Закон Гей-ЛюссакаИзобара
- 33. Закрепление новой темыКакое давление имеет 1 кг
- 34. Закрепление новой темыДаны графики процессов в различных
- 35. Закрепление новой темыПри температуре 27оС давление газа
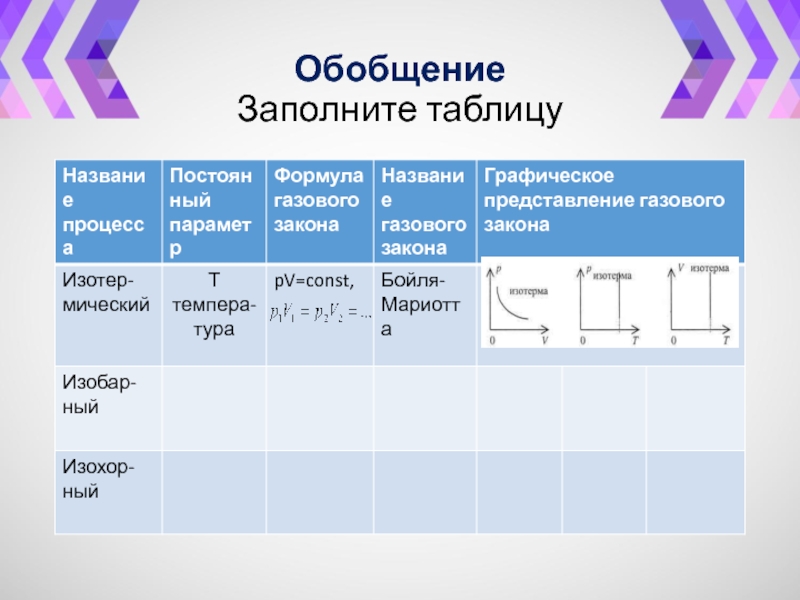
- 36. Обобщение Заполните таблицу
- 37. Обобщение Заполните таблицу
- 38. Первичный контроль знанийВыполните тест.Каждое задание оценивается в
- 39. Ключи к тесту «Уравнение Менделеева-Клапейрона. Газовые законы»
- 40. Домашнее задание:Следующий урок – л.р. «Проверка закона
- 41. Спасибо за урок!
Цель урока
Слайд 1Уравнение
Менделеева-Клапейрона.
Газовые законы
ГБПОУ ЛО
«Волховский колледж транспортного строительства»
Преподаватель физики:
Гончарова
Слайд 6Повторение
Идеальный газ – это газ, в котором взаимодействием
между молекулами можно
пренебречь.
Слайд 7Повторение
1) Масса молекулы (атома) - mo,
2) средняя квадратичная скорость молекул
- v,
3) концентрация молекул – n.
3) концентрация молекул – n.
Слайд 8Повторение
Давление, объем и температура.
Р – давление, [Па].
V - объём, [м3].
Т
– температура, [К].
Слайд 9Повторение
Ек – средняя кинетическая энергия поступательного
движения частиц;
Т - термодинамическая
температура;
k – постоянная Больцмана.
k – постоянная Больцмана.
Слайд 11Повторение
Концентрация – отношение числа молекул к объёму.
n – концентрация;
N -
число молекул;
V - объём.
V - объём.
Слайд 12Повторение
Количество вещества – это отношение числа молекул
в данном макроскопическом теле
к числу атомов,
содержащихся в 12 г углерода (NA):
Ед. изм. - моль.
содержащихся в 12 г углерода (NA):
Ед. изм. - моль.
Слайд 13Повторение
В 1 моле содержится NA= 6,02 ·1023 молекул (атомов),
столько содержится в
12 г углерода.
NA – число Авогадро.
NA – число Авогадро.
Слайд 15Повторение
p – давление газа.
n – концентрация.
m0 - масса молекулы (атома).
v –
средняя квадратичная скорость движения молекул (атомов).
Слайд 17Уравнение Клапейрона
1 Преобразуйте выражение
учитывая, что
2. Преобразуйте уравнение таким образом, чтобы
все макроскопические параметры оказались в левой части уравнения.
Умножим обе части уравнения на V и разделим на T, получаем:
Слайд 18 Клапейрон Бенуа Поль Эмиль
(26.0I.1799–28.0I.1864)
Французский
физик, член Парижской АН
Окончил Политехническую школу в Париже(1818)
В 1820–30 работал в Петербурге в институте инженеров путей сообщения
В 1834сделал вывод: если масса порции газа постоянна, а, следовательно, и количество частиц постоянно, т.е.
то
Окончил Политехническую школу в Париже(1818)
В 1820–30 работал в Петербурге в институте инженеров путей сообщения
В 1834сделал вывод: если масса порции газа постоянна, а, следовательно, и количество частиц постоянно, т.е.
то
Слайд 19Менделеев Дмитрий Иванович
(8.II.1834–2.II.1907)
Обобщив уравнение Клапейрона,
в 1874 вывел
общее уравнение состояния идеального газа.
Данное уравнение он рассмотрел для 1 моля вещества:
т.е. N= NA.
Данное уравнение он рассмотрел для 1 моля вещества:
т.е. N= NA.
Слайд 20Уравнение Менделеева
R - универсальная газовая постоянная
- уравнение
Менделеева
Менделеева
N= NA.
Данное уравнение Менделеев рассмотрел для 1 моля вещества:
моль, т.е. N= NA.
Слайд 21Уравнение Менделеева-Клапейрона
В случае произвольного количества вещества
Уравнение
Менделеева-Клапейрона
Слайд 22Для чего это нужно?
Уравнение позволяет определить одну из величин, характеризующих состояние,
если известны две другие величины
Это используют в термометрах
Это используют в термометрах
Слайд 23Для чего это нужно?
Зная уравнение состояния, можно сказать, как протекают в
системе процессы при определённых внешних условиях
Слайд 24Для чего это нужно?
Зная уравнение состояния, можно определить, как меняется состояние
системы, если она совершает работу или получает теплоту от окружающих тел
Слайд 25ИЗОПРОЦЕСС
– изменение состояния идеального газа при неизменном значении одного из
макроскопических параметров
Преимущества:
а) упрощает расчеты
б) позволяет графически описывать процессы
Преимущества:
а) упрощает расчеты
б) позволяет графически описывать процессы
Слайд 33Закрепление новой темы
Какое давление имеет 1 кг азота в объёме 1
м3 при температуре 27о С?
89 036 Па.
Ответ: р= 89 036 Па.
Решение:
Слайд 34Закрепление новой темы
Даны графики процессов в различных системах координат.
Найти во
всех трех системах координат:
Изотермы;
Изохоры;
Изобары.
Ответ: а)132 б) 321 в) 213
Изотермы;
Изохоры;
Изобары.
Ответ: а)132 б) 321 в) 213
Слайд 35Закрепление новой темы
При температуре 27оС давление газа в закрытом сосуде было
75кПа. Каким будет давление этого газа при температуре – 13оС?
Ответ: р = 65 кПа.
р2=р1Т2/Т1
р2=75∙103∙263/300=65кПа
Слайд 38Первичный контроль знаний
Выполните тест.
Каждое задание оценивается в 1 балл.
Максимальное количество баллов
– 8.
Критерии оценивания:
«5» - 8 баллов;
«4» - 6-7 баллов;
«3» - 4-5 баллов;
«2» - 0-3 балла.
Критерии оценивания:
«5» - 8 баллов;
«4» - 6-7 баллов;
«3» - 4-5 баллов;
«2» - 0-3 балла.
Слайд 40Домашнее задание:
Следующий урок – л.р. «Проверка закона Бойля-Мариотта».
1. Подготовить ответы на
контрольные вопросы к л.р. (вопросы на стенде в кабинете и на сайте колледжа).
2. §§4.10-4.12, ответить на вопросы 20-25 на с. 123, выучить определения изопроессов, знать вывод уравнения М-К, уметь читать и строить графики изопроцессов.
3. Разобрать пример решения задачи №2, с. 123,
решить задачи №№ 3-5, с.125.
4*. По желанию: Подготовить сообщение об истории открытия газовых законов.
2. §§4.10-4.12, ответить на вопросы 20-25 на с. 123, выучить определения изопроессов, знать вывод уравнения М-К, уметь читать и строить графики изопроцессов.
3. Разобрать пример решения задачи №2, с. 123,
решить задачи №№ 3-5, с.125.
4*. По желанию: Подготовить сообщение об истории открытия газовых законов.







![Презентация по физике Уравнение Менделеева-Клапейрона. Газовые законы (1 курс СПО) ПовторениеДавление, объем и температура. Р – давление, [Па].V - объём, [м3].Т – температура, [К]. ПовторениеДавление, объем и температура. Р – давление, [Па].V - объём, [м3].Т – температура, [К].](/img/thumbs/430e25a385662571f19e96a310e6f34d-800x.jpg)