- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физике на тему Основы молекулярно-кинетической теории
Содержание
- 1. Презентация по физике на тему Основы молекулярно-кинетической теории
- 2. СодержаниеОсновные понятия о молекулахОсновные положения МКТОсновные доказательства
- 3. Основные понятия о молекулах
- 4. Основные положения МКТ: Все тела состоят из
- 5. Основные доказательства положений МКТ: ДиффузияБроуновское движениеИзменение агрегатных состояний веществНазад к содержанию
- 6. ДиффузияДиффузия — процесс взаимного проникновения молекул или атомов
- 7. Броуновское движениеБроуновское движение — беспорядочное движение микроскопических видимых
- 8. Агрегатное состояниеАгрегатное состояние вещества — состояние одного и того
- 9. Частицы телАтом — частица вещества микроскопических размеров и
- 10. Тепловое движениеТепловое движение — процесс хаотичного (беспорядочного) движения частиц, образующих вещество. Чем выше
- 11. Абсолютно упругие столкновенияАбсолютно упругий удар — удар, при
- 12. Основное уравнение МКТОсновное уравнение МКТ связывает макроскопические
- 13. Идеальный газИдеальный газ — это газ, в котором
- 14. Универсальная газовая постояннаяВ 1874 году Д. Менделеев вычислил значение константы
- 15. Закон АвогадроЗакон Авога́дро — закон, согласно которому в
- 16. ИзопроцессыИзопроцессы — термодинамические процессы, во время которых количество вещества
- 17. ИзобарныйИзобарный — термодинамический процесс, происходящий в системе при
- 18. ИзохорныйИзохорный процесс — термодинамический процесс, который происходит при постоянном объёме
- 19. ИзотермическийИзотермический процесс — термодинамический процесс, происходящий в физической системе
- 20. Закон ШарляДавление газа фиксированной массы и фиксированного объёма прямо пропорционально абсолютной
- 21. Закон Бойля-МариоттаПри постоянных температуре и массе газа произведение давления газа на его объём
- 22. Закон Гей-ЛюссакаОбъем газа фиксированной массы и фиксированного давления прямо пропорционален абсолютной
- 23. Список литературыМинкин В. И., Симкин Б. Я.,
Слайд 2Содержание
Основные понятия о молекулах
Основные положения МКТ
Основные доказательства положений МКТ
Основное уравнение МКТ
Идеальный
Термодинамические процессы и газовые законы
Список литературы
Слайд 3Основные понятия о молекулах
Молекула - электрически нейтральная
её вязкость, теплопроводность и т. д.
Назад к содержанию
Слайд 4Основные положения МКТ:
Все тела состоят из частиц: атомов, молекул и ионов;
Частицы находятся в непрерывном хаотичном движении;
Частицы взаимодействуют
Назад к содержанию
Слайд 5Основные доказательства положений МКТ:
Диффузия
Броуновское движение
Изменение агрегатных состояний веществ
Назад к содержанию
Слайд 6Диффузия
Диффузия — процесс взаимного проникновения молекул или атомов одного вещества между молекулами
Назад к содержанию
Назад к доказательствам
Слайд 7Броуновское движение
Броуновское движение — беспорядочное движение микроскопических видимых взвешенных в жидкости или
Назад к содержанию
Назад к доказательствам
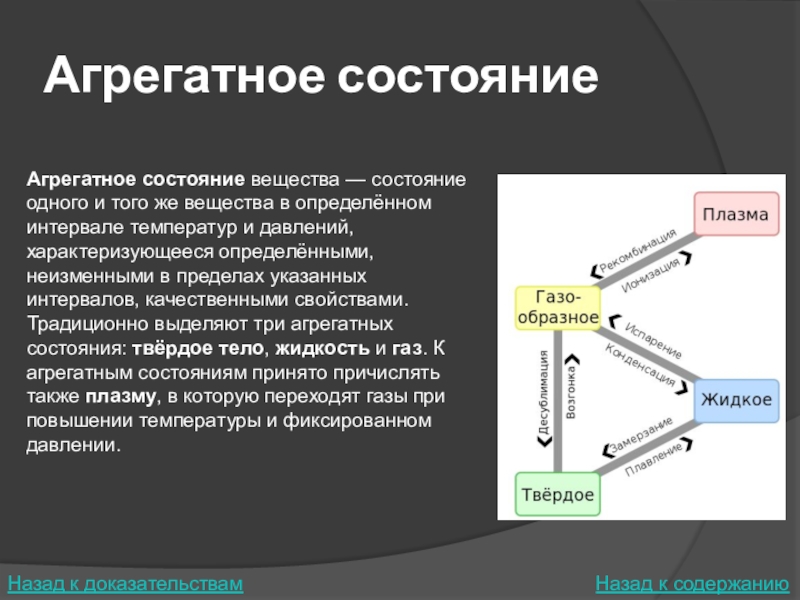
Слайд 8Агрегатное состояние
Агрегатное состояние вещества — состояние одного и того же вещества в определённом
Традиционно выделяют три агрегатных состояния: твёрдое тело, жидкость и газ. К агрегатным состояниям принято причислять также плазму, в которую переходят газы при повышении температуры и фиксированном давлении.
Назад к содержанию
Назад к доказательствам
Слайд 9Частицы тел
Атом — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента,
Молекула — электрически нейтральная частица, образованная из двух или более связанных ковалентными связями атомов. В физике к молекулам причисляют также одноатомные молекулы, то есть свободные (химически не связанные) атомы.
Ион — электрически заряженная неэлементарная частица (атом, молекула), получаемая в процессе ионизации. Имеет положительный или отрицательный заряд, кратный заряду электрона. Положительно заряженный ион принято называть катионом, отрицательно заряженный ион анионом.
Назад к содержанию
Назад к положениям
Слайд 10Тепловое движение
Тепловое движение — процесс хаотичного (беспорядочного) движения частиц, образующих вещество. Чем выше температура, тем больше скорость
ВНИМАНИЕ
Неверно смешивать понятия «Тепловое движение» и «Броуновское движение». Броуновским называется движение видимых взвешенных в веществе частиц; тепловым — движение частиц самого вещества. Тепловое движение является причиной броуновского движения.
Назад к содержанию
Назад к положениям
Слайд 11Абсолютно упругие столкновения
Абсолютно упругий удар — удар, при котором внутренняя энергия соударяющихся
Есть в наличии два тела, которые сталкиваются.(Частицы)
В точке контакта происходят упругие деформации. Кинетическая энергия движущихся тел мгновенно и полностью переходит в энергию деформации.
В следующий момент деформированные тела принимают свою прежнюю форму, а энергия деформации полностью обратно переходит в кинетическую энергию.
Контакт тел прекращается, и они продолжают движение.
Для математического описания простейших абсолютно упругих ударов используется закон сохранения энергии и закон сохранения импульса.
Назад к содержанию
Назад к положениям
Слайд 12Основное уравнение МКТ
Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) термодинамической системы
p – давление газа на стенки сосуда (Па = Н/м2)
n - концентрация газа (1/м3)
m0 - масса молекулы (кг)
v - средняя скорость молекул(м/с)
Назад к содержанию
Слайд 13Идеальный газ
Идеальный газ — это газ, в котором молекулы можно считать материальными
PV = nRT
P – давление газа
V – объем газа
T – температура газа (в Кельвинах)
R – газовая постоянная
n – число молей газа
Назад к содержанию
Слайд 14Универсальная газовая постоянная
В 1874 году Д. Менделеев вычислил значение константы в уравнении Менделеева — Клапейрона для
Численно равна работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 К (градус Кельвина).
R=8.3144698 Дж/Моль*К
Назад к содержанию
Назад к идеальному газу
Слайд 15Закон Авогадро
Закон Авога́дро — закон, согласно которому в равных объёмах различных газов,
Назад к содержанию
Назад к газовой постоянной
Слайд 16Изопроцессы
Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из
Изобарный — процесс изменения состояния термодинамической системы при постоянном давлении.
Изохорный — процесс изменения состояния термодинамической системы при постоянном объёме.
Изотермический — процесс изменения состояния термодинамической системы при постоянной температуре.
Назад к содержанию
Слайд 17Изобарный
Изобарный — термодинамический процесс, происходящий в системе при постоянном давлении и постоянной массе газа.(Закон
Графиком изобарного процесса является Изобара.
Назад к содержанию
Назад к изопроцессам
Слайд 18Изохорный
Изохорный процесс — термодинамический процесс, который происходит при постоянном объёме и постоянном количестве вещества
Графиком изобарного процесса является Изохора.
Назад к содержанию
Назад к изопроцессам
Назад к изопроцессам
Слайд 19Изотермический
Изотермический процесс — термодинамический процесс, происходящий в физической системе при постоянной температуре и
График изотермического процесса называется Изотерма.
Назад к содержанию
Назад к изопроцессам
Слайд 20Закон Шарля
Давление газа фиксированной массы и фиксированного объёма прямо пропорционально абсолютной температуре газа.
Закон имеет особенно
Назад к содержанию
Назад к изопроцессам
Слайд 21Закон Бойля-Мариотта
При постоянных температуре и массе газа произведение давления газа на его объём постоянно.
Закон имеет особенно простой
Назад к содержанию
Назад к изопроцессам
Слайд 22Закон Гей-Люссака
Объем газа фиксированной массы и фиксированного давления прямо пропорционален абсолютной температуре газа.
Закон имеет особенно
Назад к содержанию
Назад к изопроцессам
Слайд 23Список литературы
Минкин В. И., Симкин Б. Я., Миняев Р. М. Теория строения
Сивухин Д. В. Термодинамика и молекулярная физика // Общий курс физики. — М.: Наука, 1975
Савельев И. В. Курс общей физики: Молекулярная физика и термодинамика. — М.: Астрель, 2001
Белоконь Н. И. Основные принципы термодинамики. — М.: Недра, 1965
Сивухин Д. В. Общий курс физики. — М., 2008
Стромберг А. Г., Семченко Д. П. Физическая химия: Учеб. для хим. спец. вузов / Под ред. А. Г. Стромберга. — 7-е изд., стер. — М.: Высш. шк., 2009.
Бокштейн Б. С. Атомы блуждают по кристаллу. — М.: Наука, 1984
Быков Г. В. Амедео Авогадро: Очерк жизни и деятельности. — М.: Наука, 1970
Назад к содержанию