- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физике Идеальный газ
Содержание
- 1. Презентация по физике Идеальный газ
- 2. Идеальный газИдеальный газ – модель состояния вещества, в
- 3. Модель идеальных газовсреднее расстояние между отдельными молекулами
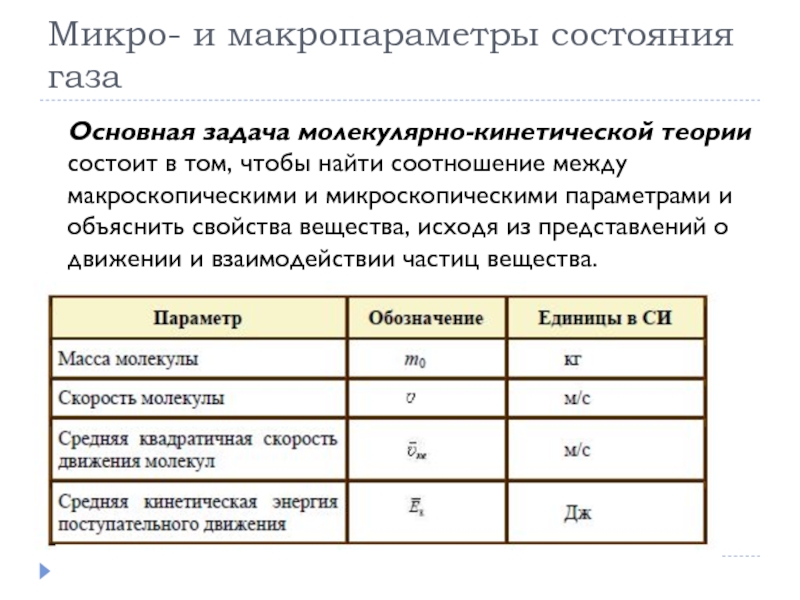
- 4. Микро- и макропараметры состояния газаОсновная задача молекулярно-кинетической
- 5. Микро- и макропараметры состояния газа
- 6. Средняя квадратичная скорость и средняя кинетическая энергия
- 7. Средняя кинетическая энергия молекул
- 8. Основное уравнение молекулярно-кинетической теории идеального газаУравнение связывает
- 9. Температура. Абсолютная температураПонятие «температура» - степень нагретости
- 10. Температура. Абсолютная температураДля калибровки термометра необходимы тела,
- 11. Термодинамическое (тепловое) равновесиеТемпература, как термодинамический параметр, характеризует
- 12. Температура – мера средней кинетической энергии поступательного
- 13. Температура – мера средней кинетической энергии поступательного
- 14. Основное уравнение молекулярно – кинетической теории идеального
- 15. Парциальное давление. Закон ДальтонаЕсли имеется смесь нескольких
- 16. Уравнение Менделеева – Клапейрона (уравнение состояния идеального
- 17. Уравнение Менделеева – Клапейрона (уравнение состояния идеального
- 18. Равновесные процессыРавновесный процесс – квазистатический процессЕсли процесс
- 19. Объединённый газовый закон
- 20. Закон Бойля–Мариотта1 случай:T = const – изотермический
- 21. Изотермы в координатах (p, V), (V, T)
- 22. Закон Гей-Люссакаp = const – изобарный процесс;m
- 23. Изобары в координатах (p, V), (p, T)
- 24. Закон ШарляV = const – изохорный процесс;m
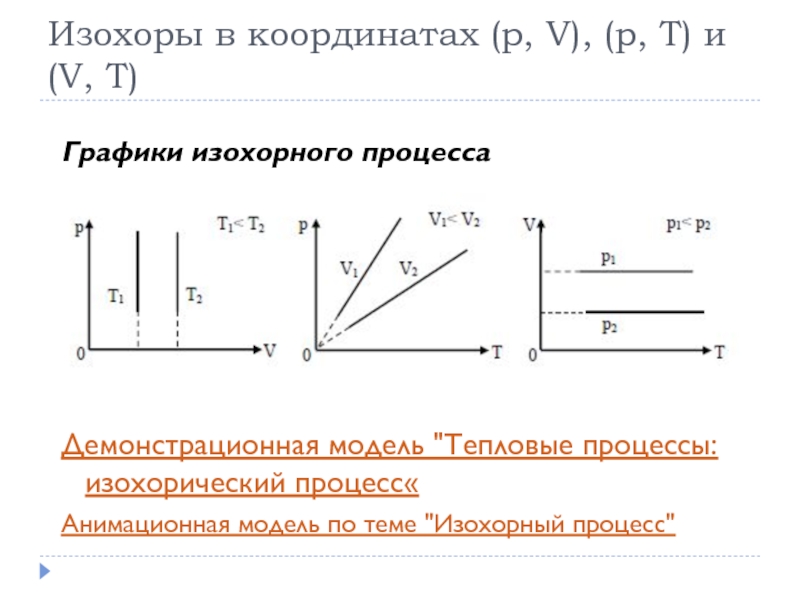
- 25. Изохоры в координатах (p, V), (p, T)
- 26. Методические указания по решению задачРешение задач на
- 27. Методические указания по решению задачДве группы задач:задачи,
- 28. Задачи первой группыЕсли при постоянной массе в
- 29. Задачи второй группыПри решении задач второй группы
- 30. Примеры решения задачЗадача 1В сосуде находится смесь
- 31. Задача 1
- 32. Задача 2Одна треть молекул азота, заключенного в
- 33. Задача 2
- 34. Задача 3Идеальный газ изотермически сжимают, затем изобарически
- 35. Задача 3
Идеальный газИдеальный газ – модель состояния вещества, в которой относительно его молекул принимаются следующие предположения:Число молекул в газе велико: N >> 1Молекулы не взаимодействуют друг с другомМолекулы газа совершают неупорядоченное, хаотичное движение.
Слайд 2Идеальный газ
Идеальный газ – модель состояния вещества, в которой относительно его молекул
принимаются следующие предположения:
Число молекул в газе велико: N >> 1
Молекулы не взаимодействуют друг с другом
Молекулы газа совершают неупорядоченное, хаотичное движение.
Число молекул в газе велико: N >> 1
Молекулы не взаимодействуют друг с другом
Молекулы газа совершают неупорядоченное, хаотичное движение.
Слайд 3Модель идеальных газов
среднее расстояние между отдельными молекулами много больше их размеров
(d >> a), или объем, занимаемый молекулами такого газа, несравнимо мал по сравнению с объемом сосуда, который они заполняют;
температура газа достаточно высока (при нормальной концентрации n = 3·1025 м-3 температура T > 10 K считается высокой).
молекулы не притягиваются друг к другу, т.е. условия достаточно далеки от условий перехода газа в жидкость.
температура газа достаточно высока (при нормальной концентрации n = 3·1025 м-3 температура T > 10 K считается высокой).
молекулы не притягиваются друг к другу, т.е. условия достаточно далеки от условий перехода газа в жидкость.
Слайд 4Микро- и макропараметры состояния газа
Основная задача молекулярно-кинетической теории состоит в том,
чтобы найти соотношение между макроскопическими и микроскопическими параметрами и объяснить свойства вещества, исходя из представлений о движении и взаимодействии частиц вещества.
Слайд 6Средняя квадратичная скорость и средняя кинетическая энергия молекул
где N – число молекул в
газе.
Величина называется средней квадратичной скоростью молекул в газе.
Лабораторная работа «Расчет средних квадратичных скоростей молекул»
(«Физика в системе Д.Б. Эльконина - В.В. Давыдова», 7-9 класс)
Величина называется средней квадратичной скоростью молекул в газе.
Лабораторная работа «Расчет средних квадратичных скоростей молекул»
(«Физика в системе Д.Б. Эльконина - В.В. Давыдова», 7-9 класс)
Слайд 8Основное уравнение молекулярно-кинетической теории идеального газа
Уравнение связывает макропараметры системы – давление p и
концентрацию молекул с ее микропараметрами – массой молекул, их средним квадратом скорости или средней кинетической энергией:
или
или
тогда формула для давления примет вид
Слайд 9Температура. Абсолютная температура
Понятие «температура» - степень нагретости тела не по субъективным
ощущениям экспериментатора, а на основании объективных показаний физических приборов.
Термометр – прибор для измерения температуры, действие которого основано на взаимно-однозначной связи наблюдаемого параметра системы (давления, объема, электропроводности, яркости свечения и т.д.) с температурой
Термометр – прибор для измерения температуры, действие которого основано на взаимно-однозначной связи наблюдаемого параметра системы (давления, объема, электропроводности, яркости свечения и т.д.) с температурой
Слайд 10Температура. Абсолютная температура
Для калибровки термометра необходимы тела, температура которых считается неизменной
и воспроизводимой. Обычно это температура равновесной системы лед – вода при нормальном давлении (0 °С) и температура кипения воды при нормальном давлении (100 °С).
Слайд 11Термодинамическое (тепловое) равновесие
Температура, как термодинамический параметр, характеризует состояние теплового равновесия. Для
измерения температуры необходим контакт с термодинамической системой, температуру которой измеряют.
Термодинамическое (тепловое) равновесие – состояние макросистемы, при котором макропараметры остаются сколь угодно долго неизменными.
Термодинамическое (тепловое) равновесие – состояние макросистемы, при котором макропараметры остаются сколь угодно долго неизменными.
Слайд 12Температура – мера средней кинетической энергии поступательного движения молекул
температура – мера
средней кинетической энергии поступательного движения молекул
средней квадратичной скорость
средней квадратичной скорость
Слайд 13Температура – мера средней кинетической энергии поступательного движения молекул
Средняя кинетическая энергия
поступательного движения молекул связана с температурой Т соотношением:
где k = 1,38∙10–23 Дж/К – постоянная Больцмана.
где k = 1,38∙10–23 Дж/К – постоянная Больцмана.
Слайд 14Основное уравнение молекулярно – кинетической теории идеального газа
Средняя квадратичная скорость характеризует
скорость хаотического движения молекул, называемого еще тепловым движением.
Связь между давлением, концентрацией и температурой для идеального газа можно получить, исключив из равенств среднюю кинетическую энергию
Связь между давлением, концентрацией и температурой для идеального газа можно получить, исключив из равенств среднюю кинетическую энергию
Слайд 15Парциальное давление. Закон Дальтона
Если имеется смесь нескольких идеальных газов, то для
каждого газа можно записать уравнение, где ni – концентрация молекул i-го газа, – давление, которое производил бы этот газ, если бы он один занимал весь сосуд. Это давление называют парциальным давлением газа (англ. partial – частичный).
Суммарное давление смеси равно сумме давлений, которое оказывал бы каждый из газов, помещенный в тот же сосуд отдельно от остальных:
p = p1+ p2+ …+ pn
Скорости и энергии молекул в смеси газов
Суммарное давление смеси равно сумме давлений, которое оказывал бы каждый из газов, помещенный в тот же сосуд отдельно от остальных:
p = p1+ p2+ …+ pn
Скорости и энергии молекул в смеси газов
Слайд 16Уравнение Менделеева – Клапейрона (уравнение состояния идеального газа)
pV = vRT
где R = 8,31
Дж/(K·моль) – универсальная газовая постоянная,
m – масса газа
M – молярная масса газа
Уравнение Менделеева – Клапейрона называют уравнением состояния, поскольку оно связывает функциональной зависимостью параметры состояния. Его записывают и в других видах:
m – масса газа
M – молярная масса газа
Уравнение Менделеева – Клапейрона называют уравнением состояния, поскольку оно связывает функциональной зависимостью параметры состояния. Его записывают и в других видах:
Слайд 17Уравнение Менделеева – Клапейрона (уравнение состояния идеального газа)
Плотность газа не постоянна,
а определяется его давлением и температурой.
Для смеси различных газов, находящихся в равновесии, уравнение можно записать в виде:
где давление смеси (pi – парциальное давление i-го компонента)
– масса смеси (mi – масса i - го компонента)
– средняя молярная масса смеси.
Для смеси различных газов, находящихся в равновесии, уравнение можно записать в виде:
где давление смеси (pi – парциальное давление i-го компонента)
– масса смеси (mi – масса i - го компонента)
– средняя молярная масса смеси.
Слайд 18Равновесные процессы
Равновесный процесс – квазистатический процесс
Если процесс с идеальным газом (или
любой термодинамической системой) идет достаточно медленно, то давление и температура газа во всем его объеме успевают выровняться и принимают в каждый момент времени одинаковые по всему объему значения. Это означает, что газ проходит через последовательность равновесных (почти равновесных) состояний.
Такой процесс с газом называется равновесным.
Такой процесс с газом называется равновесным.
Слайд 20Закон Бойля–Мариотта
1 случай:
T = const – изотермический процесс;
m = const;
pV =
const – закон Бойля–Мариотта.
При постоянной массе идеального газа и постоянной температуре, произведение давления на его объем есть величина постоянная.
При постоянной массе идеального газа и постоянной температуре, произведение давления на его объем есть величина постоянная.
Слайд 21Изотермы в координатах (p, V), (V, T) и (p, T)
Графики изотермического
процесса
Демонстрационная модель "Тепловые процессы: изотермический процесс«
Анимационная модель по теме "Изотермический процесс"
Демонстрационная модель "Тепловые процессы: изотермический процесс«
Анимационная модель по теме "Изотермический процесс"
Слайд 22Закон Гей-Люссака
p = const – изобарный процесс;
m = const;
V/T = const
– закон Гей-Люссака.
При постоянной массе идеального газа и постоянном давлении, отношение его объема к температуре есть величина постоянная.
При постоянной массе идеального газа и постоянном давлении, отношение его объема к температуре есть величина постоянная.
Слайд 23Изобары в координатах (p, V), (p, T) и (V, T)
Графики изобарного
процесса
Демонстрационная модель "Тепловые процессы: изобарический процесс«
Анимационная модель по теме "Изобарный процесс"
Демонстрационная модель "Тепловые процессы: изобарический процесс«
Анимационная модель по теме "Изобарный процесс"
Слайд 24Закон Шарля
V = const – изохорный процесс;
m = const;
p/T = const
– закон Шарля.
При постоянной массе идеального газа и постоянном объеме отношение давления к температуре есть величина постоянная.
При постоянной массе идеального газа и постоянном объеме отношение давления к температуре есть величина постоянная.
Слайд 25Изохоры в координатах (p, V), (p, T) и (V, T)
Графики изохорного
процесса
Демонстрационная модель "Тепловые процессы: изохорический процесс«
Анимационная модель по теме "Изохорный процесс"
Демонстрационная модель "Тепловые процессы: изохорический процесс«
Анимационная модель по теме "Изохорный процесс"
Слайд 26Методические указания по решению задач
Решение задач на расчет микропараметров газа осуществляется
на основании основного уравнения молекулярно–кинетической теории идеального газа, формулы для расчета среднего значения кинетической энергии молекулы и определения абсолютной температуры.
Слайд 27Методические указания по решению задач
Две группы задач:
задачи, в которых заданы параметры
газа в начальном состоянии и некоторые параметры в конечном состоянии при постоянной массе
задачи, где в условиях фигурирует масса газа и приведены некоторые параметры состояния или рассматриваются такие процессы, в которых масса газа изменяется. Необходимо найти неизвестные величины.
задачи, где в условиях фигурирует масса газа и приведены некоторые параметры состояния или рассматриваются такие процессы, в которых масса газа изменяется. Необходимо найти неизвестные величины.
Слайд 28Задачи первой группы
Если при постоянной массе в результате перехода из начального
состояния в конечное один из параметров газа не меняется, то при решении задач можно пользоваться соответствующим законом одного из изопроцессов.
Если меняются все три параметра, следует применять уравнение Менделеева – Клапейрона. При этом необходимо также использовать дополнительные условия в виде вспомогательных формул и выразить, где это необходимо, давление и объем через другие заданные величины.
Если меняются все три параметра, следует применять уравнение Менделеева – Клапейрона. При этом необходимо также использовать дополнительные условия в виде вспомогательных формул и выразить, где это необходимо, давление и объем через другие заданные величины.
Слайд 29Задачи второй группы
При решении задач второй группы чаще всего бывает необходимо
определить один из параметров состояния газа.
В этом случае пользуются уравнением Клапейрона – Менделеева с учетом дополнительных условий.
В случае смеси газов необходимо воспользоваться ещё и законом Дальтона.
Если в задаче рассматривается процесс смешения газов, находящихся в разных сосудах, следует различать парциальные давления от давлений, оказываемых газами на стенки сосудов, которые они занимали первоначально.
В этом случае пользуются уравнением Клапейрона – Менделеева с учетом дополнительных условий.
В случае смеси газов необходимо воспользоваться ещё и законом Дальтона.
Если в задаче рассматривается процесс смешения газов, находящихся в разных сосудах, следует различать парциальные давления от давлений, оказываемых газами на стенки сосудов, которые они занимали первоначально.
Слайд 30Примеры решения задач
Задача 1
В сосуде находится смесь 20 г углекислого газа
и 30 г азота. Найти плотность этой смеси при температуре 27°С и давлении 200 кПа. Газы считать идеальными.
Слайд 32Задача 2
Одна треть молекул азота, заключенного в закрытый сосуд, распалась на
атомы вследствие термической диссоциации при повышении температуры от 70С до 14070С. Во сколько раз при этом возросло давление газа?
Слайд 34Задача 3
Идеальный газ изотермически сжимают, затем изобарически нагревают и изохорически возвращают
в исходное состояние.
Нарисовать графики этого равновесного процесса в координатах (p, V); (V, T); (p, T).
Нарисовать графики этого равновесного процесса в координатах (p, V); (V, T); (p, T).