- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Квантовые постулаты Бора
Содержание
- 1. Квантовые постулаты Бора
- 2. БОР Нильс Хендрик Давид (1885–1962) – выдающийся датский
- 3. Теоретическое обоснование постулатов БораПо законам классической электродамики
- 4. Следующий шаг в развитии представлений об устройстве
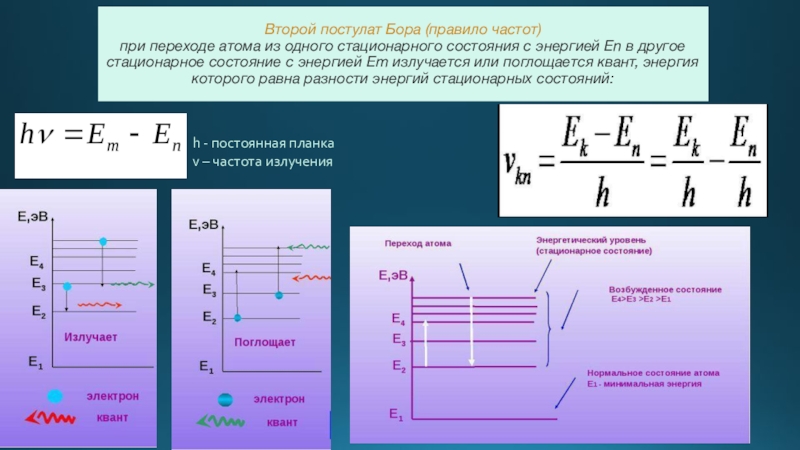
- 5. Второй постулат Бора (правило частот) при
- 6. Правило квантования В стационарном состоянии атома электрон,
- 7. Радиусы орбитРадиусы боровских орбит меняются дискретно с
- 8. Энергия стационарных состоянийНизшее энергетическое состояние
- 9. Переходы в первое возбужденное состояние (на второй
- 10. Поглощение света Процесс, обратный излучению. Атом, поглощая
Слайд 2БОР Нильс Хендрик Давид (1885–1962) – выдающийся датский физик-теоретик, один из создателей
Слайд 3Теоретическое обоснование постулатов Бора
По законам классической электродамики движущийся с ускорением заряд
То, что этого не происходит в устойчивых состояниях атома, показывает, что внутренние процессы в атоме не подчиняются классическим законам.
Неустойчивость классического атома
Слайд 4Следующий шаг в развитии представлений об устройстве атома сделал в 1913 году
Первый постулат Бора (постулат стационарных состояний)
атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает.
Слайд 5Второй постулат Бора (правило частот) при переходе атома из одного стационарного
h - постоянная планка
v – частота излучения
Слайд 6Правило квантования
В стационарном состоянии атома электрон, двигаясь по круговой орбите,
me – масса электрона
V – скорость электрона
rn- радиус стационарной круговой орбиты
Правило квантования орбиты Бора позволяет вычислить радиусы Стационарных орбит электрона в атоме водорода и определить значения энергий
Слайд 7Радиусы орбит
Радиусы боровских орбит меняются дискретно с изменением числа n. Значения
Наименьший радиус орбиты:
Размеры атома определяются квантовыми законами (радиус пропорционален квадрату постоянной Планка). Классическая теория не может объяснить, почему атом имеет размеры порядка 10-8см
Слайд 9Переходы в первое возбужденное состояние (на второй энергетический уровень) с верхних
Красная, зеленая и две синие линии в видимой части спектра водорода соответствует переходам E3-E2; E4-E2; E5-E2; E6 -E2.
Названа в честь швейцарского учителя И.Бальмера , который в 1885 г. на основе экспериментальных данных получил простую формулу для определения частот видимой части спектра водорода.