- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Неорганические кислоты
Содержание
- 1. Неорганические кислоты
- 2. План1. Определение2. Классификация3. Физические свойства4. Химические свойства5. Особенности кислот6. Применение
- 3. Кислоты — электролиты, при диссоциации которыхобразуются ионы
- 4. КИСЛОТЫHCL—соляная кислотаHNO3—азотная кислотаH2SO4—серная кислотаH2CO3—угольная кислотаH3PO4—ортофосфорная кислота
- 5. Признаки классификацииНаличие кислородаОсновностьРастворимостьЛетучестьСтепень электролитической диссоциации
- 6. Классификация кислотНаличие кислорода Кислородосодержащие Бескислородные H2SO4 HCl HNO3 HBr H2CO3 H2S
- 7. Классификация кислотОсновность(число атомов Н в молекуле)Одноосновные Двухосновные Трехосновные HCl H2S H3PO4 HNO3 H2SO4
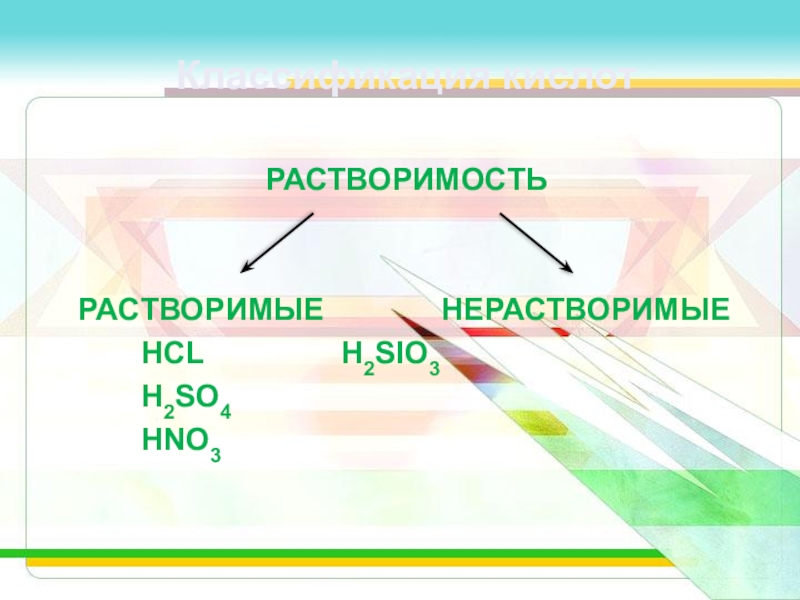
- 8. Классификация кислотРАСТВОРИМОСТЬ РАСТВОРИМЫЕ НЕРАСТВОРИМЫЕ HCL H2SIO3 H2SO4 HNO3
- 9. Классификация кислотЛЕТУЧЕСТЬ ЛЕТУЧИЕ
- 10. Классификация кислотСТЕПЕНЬ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ СИЛЬНЫЕ СЛАБЫЕ HCL H2S HNO3 H2CO3 H2SO4 H2SO3
- 11. Физические свойстваПри обычных условиях кислоты представляют собой
- 12. 3. Растворы кислот имеют кислый вкус.4. Разъедает
- 13. Кислоты постоянно присутствуют
- 14. Самая значительная функция
- 15. Химические свойстваВзаимодействие с металлами Zn +
- 16. Химические свойства2. Взаимодействие кислот с оксидами металловCuO
- 17. Химические свойства3. Взаимодействие кислот с гидроксидами металловА)
- 18. Химические свойства4. Взаимодействие кислот с солями (если
- 19. Особенности кислотH2SO4 – бесцветная маслянистая жидкость. При
- 20. Серная кислота гигроскопична — хорошо
- 21. Особенности кислотHNO3 – прозрачная жидкость, на воздухе
- 22. Особенности кислотHCl – бесцветная жидкость с резким
- 23. Особенности кислотHF – Фтороводородная кислота (плавиковая)Плавиковая кислота
- 24. Применение серной кислотыПроизводство минеральных удобренийПроизводство взрывчатых веществДля
- 25. Применение азотной кислотыПроизводство минеральных удобренийПроизводство взрывчатых веществПроизводство
- 26. Применение фосфорной кислотыПроизводство минеральных удобренийПри изготовлении реактивов,
- 27. Угадай вещество!!!Сильная двухосновная кислота,— маслянистая жидкость,— очень
- 28. УпражненияОпределите степень окисления каждого элемента в соединениях:H2SO4,
- 29. Спасибо за внимание!
План1. Определение2. Классификация3. Физические свойства4. Химические свойства5. Особенности кислот6. Применение
Слайд 2План
1. Определение
2. Классификация
3. Физические свойства
4. Химические свойства
5. Особенности кислот
6. Применение
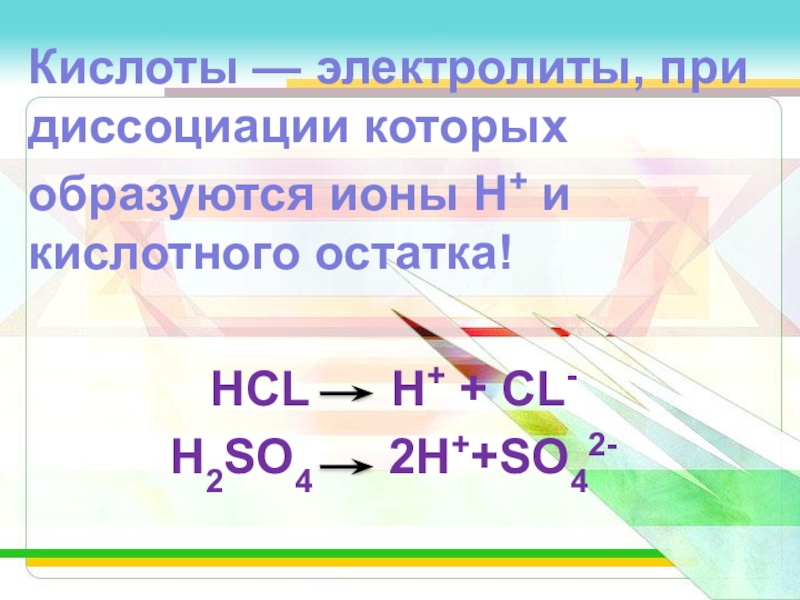
Слайд 3Кислоты — электролиты, при диссоциации которых
образуются ионы Н+ и кислотного остатка!
HCL H+ + CL-
H2SO4 2H++SO42-
Слайд 4КИСЛОТЫ
HCL—соляная кислота
HNO3—азотная кислота
H2SO4—серная кислота
H2CO3—угольная кислота
H3PO4—ортофосфорная кислота
Слайд 5Признаки классификации
Наличие кислорода
Основность
Растворимость
Летучесть
Степень электролитической диссоциации
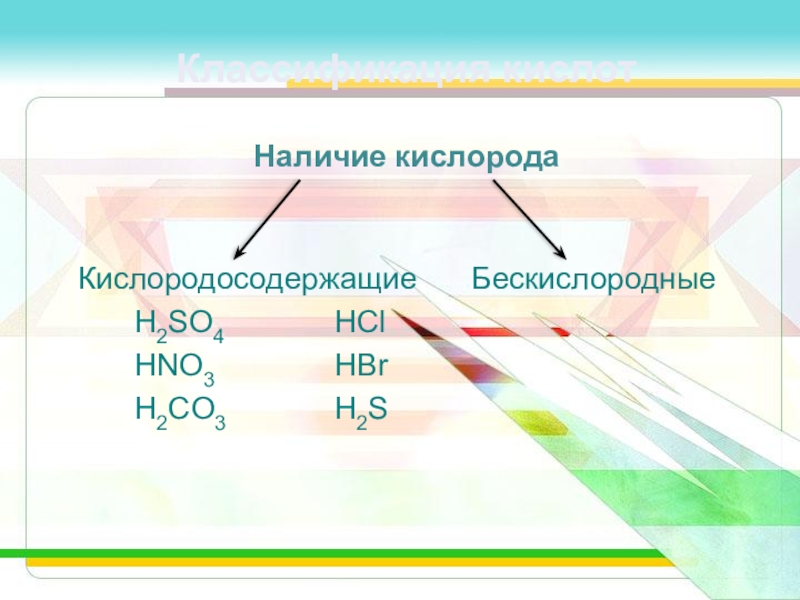
Слайд 6Классификация кислот
Наличие кислорода
Кислородосодержащие Бескислородные
H2SO4 HCl
HNO3 HBr
H2CO3 H2S
Слайд 7Классификация кислот
Основность
(число атомов Н в молекуле)
Одноосновные Двухосновные Трехосновные
HCl H2S H3PO4
HNO3 H2SO4
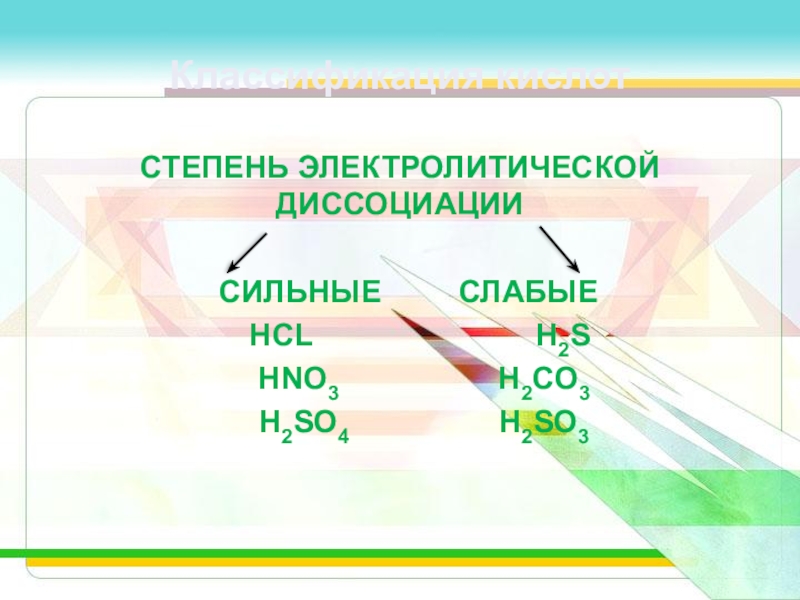
Слайд 10Классификация кислот
СТЕПЕНЬ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
СИЛЬНЫЕ СЛАБЫЕ
HCL
H2S
HNO3 H2CO3
H2SO4 H2SO3
HNO3 H2CO3
H2SO4 H2SO3
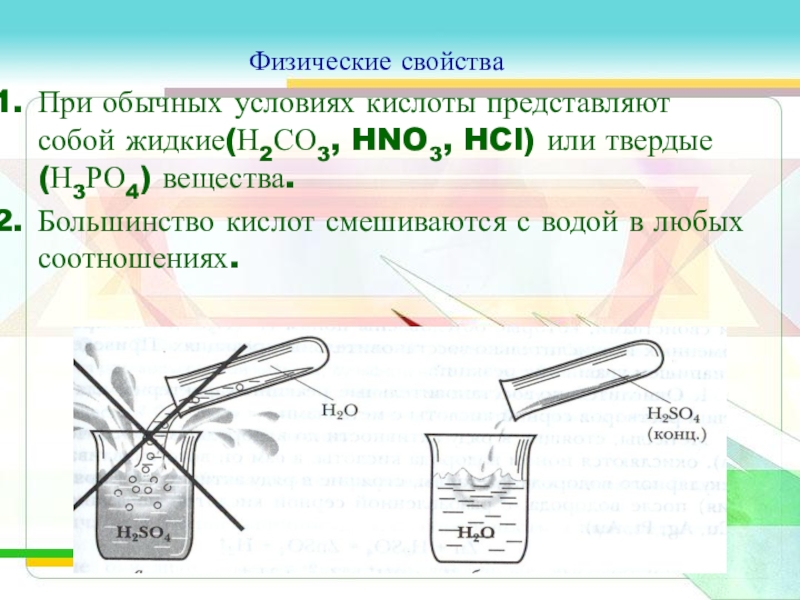
Слайд 11Физические свойства
При обычных условиях кислоты представляют собой жидкие(Н2СО3, HNO3, HCl) или
твердые(Н3РО4) вещества.
Большинство кислот смешиваются с водой в любых соотношениях.
Большинство кислот смешиваются с водой в любых соотношениях.
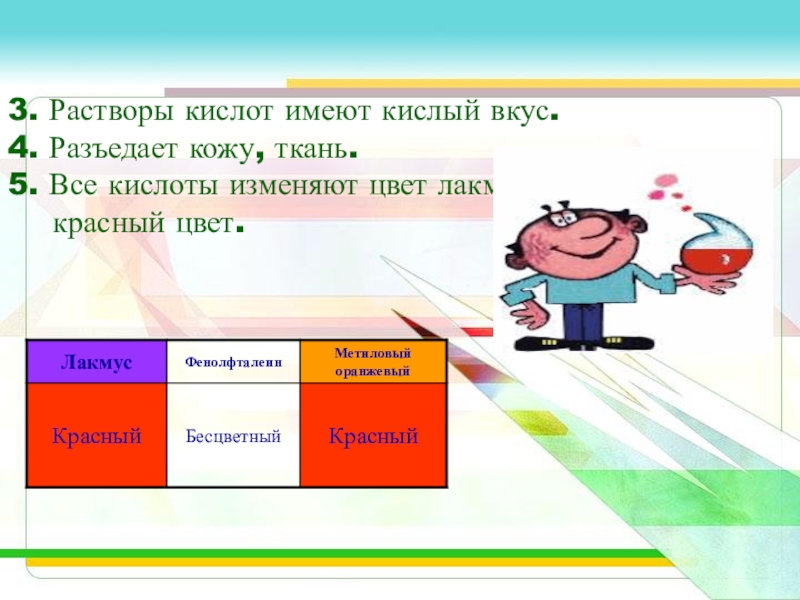
Слайд 123. Растворы кислот имеют кислый вкус.
4. Разъедает кожу, ткань.
5. Все кислоты
изменяют цвет лакмуса в красный цвет.
Слайд 13 Кислоты постоянно присутствуют вокруг нас. Например, дождевая
вода на первый взгляд кажется чистой. На самом деле в ней присутствует немало других веществ. За счет растворения углекислого газа из атмосферы она является раствором угольной кислоты. После летней грозы в дождевой воде оказывается еще и азотная кислота. Извержения вулканов и сгорание топлива способствуют появлению в дождевой и снеговой воде серной кислоты.
Кислоты вокруг нас
Слайд 14 Самая значительная функция кислот в природе состоит
в разрушении горных пород и создании почвы. Ведь было время, когда вся земная суша представляла собой голые камни.
Сотни миллионов лет потребовалось на то, чтобы солнце, ветер и слабый раствор кислот – дождевая вода – разрушили камни на песчинки. Появившиеся затем растения тут же подключились к процессу разрушения горных пород и созданию почвы.
Сотни миллионов лет потребовалось на то, чтобы солнце, ветер и слабый раствор кислот – дождевая вода – разрушили камни на песчинки. Появившиеся затем растения тут же подключились к процессу разрушения горных пород и созданию почвы.
Слайд 15Химические свойства
Взаимодействие с металлами
Zn + 2HCl = ZnCl2 +
H2
хлорид цинка
Fe + H2SO4 = FeSO4 + H2
разб. cульфат железа II
Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Sn, Pb, H, Cu, Hg, Ag, Au
Металлы, стоящие до Н в электрохимическом ряду напряжений металлов, вытесняют его из растворов кислот HCl, H2SO4.
хлорид цинка
Fe + H2SO4 = FeSO4 + H2
разб. cульфат железа II
Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Sn, Pb, H, Cu, Hg, Ag, Au
Металлы, стоящие до Н в электрохимическом ряду напряжений металлов, вытесняют его из растворов кислот HCl, H2SO4.
Слайд 16Химические свойства
2. Взаимодействие кислот с оксидами металлов
CuO + H2SO4 = CuSO4
+ H2O
cульфат меди
ZnO + 2HCl = ZnCl2 + H2O
хлорид цинка
cульфат меди
ZnO + 2HCl = ZnCl2 + H2O
хлорид цинка
Слайд 17Химические свойства
3. Взаимодействие кислот с гидроксидами металлов
А) с растворимыми основаниями(щелочами)
NaOH +
HCl = NaCl +H2O
хлорид натрия
Реакция нейтрализации
Б) с нерастворимыми основаниями
Сu(OH)2 + 2HCl = CuCl2 + 2H2O
хлорид меди
В) с амфотерными основаниями
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
хлорид цинка
хлорид натрия
Реакция нейтрализации
Б) с нерастворимыми основаниями
Сu(OH)2 + 2HCl = CuCl2 + 2H2O
хлорид меди
В) с амфотерными основаниями
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
хлорид цинка
Слайд 18Химические свойства
4. Взаимодействие кислот с солями (если образуется осадок или газ)
Качественная
реакция на SO42-(cульфат-ион)
BaCl2+ H2SO4 = BaSO4 + 2HCl
сульфат бария
Качественная реакция на СО32- (карбонат-ион)
Na2CO3 + 2HNO3 = 2NaNO3+CO2 +H2O
нитрат натрия
BaCl2+ H2SO4 = BaSO4 + 2HCl
сульфат бария
Качественная реакция на СО32- (карбонат-ион)
Na2CO3 + 2HNO3 = 2NaNO3+CO2 +H2O
нитрат натрия
Слайд 19Особенности кислот
H2SO4 – бесцветная маслянистая жидкость. При растворении в воде выделяется
большое количество теплоты.
ПОМНИ! Вливают серную кислоту (как более тяжелую) в воду небольшими порциями.
Издавна её называют
«матерью всех кислот»,
«Купоросное масло»
ПОМНИ! Вливают серную кислоту (как более тяжелую) в воду небольшими порциями.
Издавна её называют
«матерью всех кислот»,
«Купоросное масло»
Слайд 20 Серная кислота гигроскопична — хорошо поглощает пары воды из
воздуха.
Концентрированная кислота взаимодействует с металлами стоящими до и после водорода в электро-химическом ряду
Cu + 2H2SO4 CuSO4 + SO2 +H2O
конц. сульфат меди
Концентрированная кислота взаимодействует с металлами стоящими до и после водорода в электро-химическом ряду
Cu + 2H2SO4 CuSO4 + SO2 +H2O
конц. сульфат меди
Слайд 21Особенности кислот
HNO3 – прозрачная жидкость, на воздухе «дымит», так как её
пары образуют с влагой воздуха капельки тумана.
Разлагается при нагревании и на свету:
4HNO3 = 4NO2 + O2 +2H2O
Азотная кислота – сильный окислитель. Легко окисляет не только металлы, но и неметаллы.
Смесь из 1 объема азотной кислоты и 3 объемов концентрированной соляной кислоты называется Царской водкой!
Разлагается при нагревании и на свету:
4HNO3 = 4NO2 + O2 +2H2O
Азотная кислота – сильный окислитель. Легко окисляет не только металлы, но и неметаллы.
Смесь из 1 объема азотной кислоты и 3 объемов концентрированной соляной кислоты называется Царской водкой!
Слайд 22Особенности кислот
HCl – бесцветная жидкость с резким запахом. На воздухе дымит.
Н3РО4
– бесцветные прозрачные кристаллы, плавящиеся при 42°С. В воде растворяется хорошо.
Н2СО3 – очень слабая кислота, может существовать только в водном растворе. При нагревании раствора СО2 улетучивается и остается чистая вода.
Н2СО3 – очень слабая кислота, может существовать только в водном растворе. При нагревании раствора СО2 улетучивается и остается чистая вода.
Слайд 23
Особенности кислот
HF – Фтороводородная кислота (плавиковая)
Плавиковая кислота обладает оригинальными свойствами: она
легко реагирует со стеклом и химически растворяет его,
поэтому хранить кислоту приходится не в стеклянной посуде, а в полиэтиленовой.
Представьте, что получится, если какой-то химик перельёт эту кислоту в стеклянную колбу !
поэтому хранить кислоту приходится не в стеклянной посуде, а в полиэтиленовой.
Представьте, что получится, если какой-то химик перельёт эту кислоту в стеклянную колбу !
Слайд 24Применение серной кислоты
Производство минеральных удобрений
Производство взрывчатых веществ
Для очистки керосина, нефтяных масел,
различных газов, бензола и т. д.
При изготовлении красок
При травлении черных металлов (снятие окалины)
При изготовлении красок
При травлении черных металлов (снятие окалины)
Слайд 25Применение азотной кислоты
Производство минеральных удобрений
Производство взрывчатых веществ
Производство органических красителей
Служит окислителем во
многих химических процессах
Для изготовления целлюлозных лаков, киноплёнки
Для изготовления целлюлозных лаков, киноплёнки
Слайд 26Применение фосфорной кислоты
Производство минеральных удобрений
При изготовлении реактивов, многих органических веществ
Для создания
защитных покрытий на металлах
Фосфаты кальция и аммония применяются при производстве эмалей и лекарств
Фосфаты кальция и аммония применяются при производстве эмалей и лекарств
Слайд 27Угадай вещество!!!
Сильная двухосновная кислота,
— маслянистая жидкость,
— очень гигроскопичная,
— смешивается с водой
во всех отношениях, выделяя большое количество теплоты
2) Трехосновная кислота,
— некоторые соли используются в качестве удобрений
3) Какое вещество называют «хлебом химии»?
4) Какая кислота всегда находится в желудке здорового человека?
5) Какую водку нельзя пить и почему?
2) Трехосновная кислота,
— некоторые соли используются в качестве удобрений
3) Какое вещество называют «хлебом химии»?
4) Какая кислота всегда находится в желудке здорового человека?
5) Какую водку нельзя пить и почему?
Слайд 28Упражнения
Определите степень окисления каждого элемента в соединениях:
H2SO4, HNO3, H2CO3, H3PO4, H2SiO3,
HClO4
2. Укажите формулы оксидов, которые соответствуют кислотам из задания №1
3. С каким из перечисленных веществ реагирует серная кислота: KOH, CuO, Ba(OH)2, Fe2O3, Al2O3, PbO, CO2, Al(OH)3, H3PO4, Cu, Fe, H2O, O2
Cоставьте уравнения реакций!
2. Укажите формулы оксидов, которые соответствуют кислотам из задания №1
3. С каким из перечисленных веществ реагирует серная кислота: KOH, CuO, Ba(OH)2, Fe2O3, Al2O3, PbO, CO2, Al(OH)3, H3PO4, Cu, Fe, H2O, O2
Cоставьте уравнения реакций!