- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад внеклассного мероприятия по подготовки учащихся к сдаче ЕГЭ по химии Насколько знаешь ты химию?
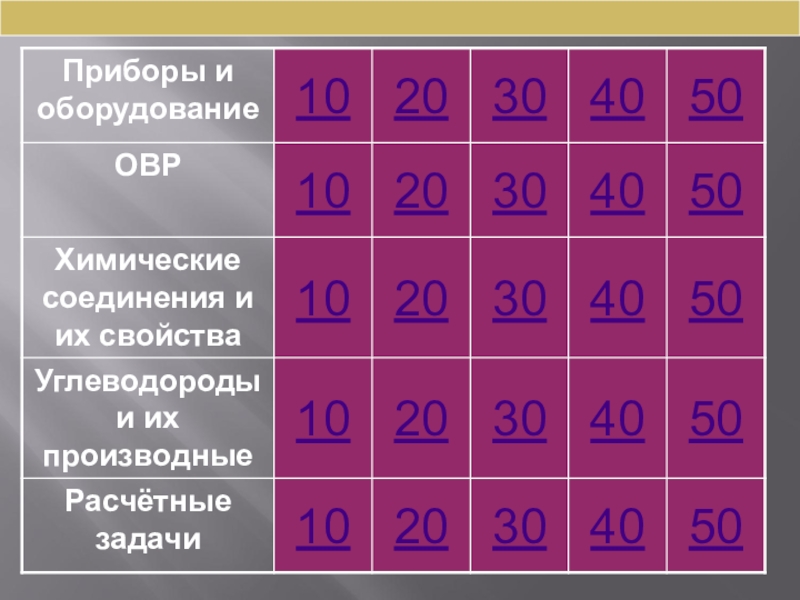
Содержание
- 1. Презентация внеклассного мероприятия по подготовки учащихся к сдаче ЕГЭ по химии Насколько знаешь ты химию?
- 2. Химическая разминкаЧто изучает наука химия?(состав, строение и превращение веществ)
- 3. Химическая разминкаКак называются частицы, которые находятся в ядре атома и не имеют заряда? (нейтроны)
- 4. Химическая разминкаСколько протонов содержит атом бора? (четыре)
- 5. Химическая разминкаНазовите тип химической связи в молекуле азота(ковалентная неполярная)
- 6. Химическая разминкаНазовите тип химической связи в молекуле хлороводорода (ковалентная полярная)
- 7. Химическая разминкаЧему равна степень окисления магния в соединениях? (+2)
- 8. Химическая разминкаЧему равен заряд катиона бария?(2+)
- 9. Химическая разминкаЧему равна валентность алюминия в соединениях? (III)
- 10. Слайд 10
- 11. Как называется и для чего предназначен прибор?
- 12. Как называется и для чего предназначен прибор?
- 13. Какой закон можно доказать, используя данное оборудование?
- 14. Для чего применяют химические индикаторы?
- 15. Соли, каких катионов окрашивают пламя в желтый, фиолетовый, зеленый цвета?
- 16. Какие реакции называют окислительно – восстановительными?
- 17. а) оксид серы(IV) и оксид серы(VI);б) оксид
- 18. Укажите окислитель и восстановитель в данной реакции 5Na2SO3 + 2HIO3 = 5Na2SO4 + I2 + H2O
- 19. Установите соответствие между уравнением реакции и формулой
- 20. Используя метод электронного баланса, составьте уравнение реакции:
- 21. Алюминий не реагирует с:а) раствором хлорида меди(II);б)
- 22. С концентрированной серной кислотой при обычных условиях
- 23. В цепочке превращений: CaCO3 → CaO →
- 24. Установите соответствие между названием соли и формулами
- 25. Установите соответствие между реагирующими веществами и продуктами
- 26. Чему равно число изомерных алкенов, имеющих состав С5Н10 (с учетом геометрической изомерии)?
- 27. Верны ли следующие утверждения о свойствах альдегидов?А.
- 28. Для этилена характерны каждая из реакций ряда:а)
- 29. Установите соответствие между общей формулой и каждым
- 30. Для анилина справедливы утверждения:1) взаимодействует с соляной
- 31. Согласно термохимическому уравнению реакции 3Cu (тв.) +
- 32. Какая масса йода выделится при взаимодействии 3 моль йодоводорода с необходимым количеством азотной кислоты?
- 33. В 730 мл 15%-го раствора соляной кислоты
- 34. Установите молекулярную формулу диена, относительная плотность паров которого по воздуху равна 1,862.
- 35. Нитрит натрия массой 13,8 г внесли при
- 36. Слайд 36
- 37. ИсточникиМатериалы курса «Подготовка выпускников средних учебных заведений
Слайд 1
«Насколько знаешь ты химию?»
(внеклассное мероприятие по подготовке к ЕГЭ по химии)
Разработала
Юрина Александра Викторовна
Слайд 3Химическая разминка
Как называются частицы, которые находятся в ядре атома и не
(нейтроны)
Слайд 6Химическая разминка
Назовите тип химической связи в молекуле хлороводорода
(ковалентная полярная)
Слайд 17
а) оксид серы(IV) и оксид серы(VI);
б) оксид фосфора(III) и оксид фосфора(V);
в)
г) оксид углерода(II) и оксид углерода(IV).
И окислительные, и восстановительные свойства могут проявлять каждый из оксидов ряда:
Слайд 19
Установите соответствие между уравнением реакции и формулой вещества, которое в данной
УРАВНЕНИЕ РЕАКЦИИ ОКИСЛИТЕЛЬ
А) H2S + I2 = S + 2HI 1) I2
Б) 2S + С = СS2 2) SO3
В) 2SO3 + 2KI = I2 + SO2 + K2SO4 3) S
Г) S + 3NO2 = SO3 + 3NO 4) HI
5) H2S
6) NO2
Слайд 20Используя метод электронного баланса, составьте уравнение реакции:
KMnO4 + MnSO4 +
Определите окислитель и восстановитель.
Слайд 21Алюминий не реагирует с:
а) раствором хлорида меди(II);
б) раствором сульфата меди (II);
в)
г) раствором гидроксида натрия.
Слайд 22С концентрированной серной кислотой при обычных условиях не взаимодействует каждое из
а) алюминий и железо;
б) глюкоза и сахароза;
в) углерод и кремний;
г) медь и цинк.
Слайд 23В цепочке превращений: CaCO3 → CaO → X → C2H2 →
а) гидроксид кальция и бензол;
б) хлорид кальция и нитробензол;
в) карбид кальция и соляная кислота;
г) карбид кальция и бензол.
Слайд 24Установите соответствие между названием соли и формулами веществ, с которыми она
НАЗВАНИЕ СОЛИ ФОРМУЛА ВЕЩЕСТВ:
А) Хлорат калия; 1) Ba(OH)2, HNO3, NaCl;
Б) Карбонат кальция; 2) Mg, KOH, Cl2;
В) Сульфат железа (II); 3) NaOH, NH3 * H2O, Sn;
Г) Хлорид меди (II). 4) H2SO4, NaOH, CuO;
5) HNO3, HBr, CO2 + H2O;
6) HCl, P, S.
Слайд 25Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
ВЗАИМОДЕЙСТВИЯ
А) NaOH (хол.) + Cl2 → …; 1) ZnSO4 + H2S + H2O;
Б) CaC2 + H2O + CO2 → …; 2) ZnSO4 + H2;
В) H2SO4 (конц.) + Zn → …; 3) NaClO3 + NaCl + H2O;
Г) KOH + H3PO4 (изб.) → …. 4) NaClO + NaCl + H2O;
5) Ca(HCO3)2 + C2H2;
6) Ca(OH)2 + C2H2;
7) KH2PO4 + H2O;
8) K3PO4 +H2O.
Слайд 26Чему равно число изомерных алкенов, имеющих состав С5Н10 (с учетом геометрической
Слайд 27Верны ли следующие утверждения о свойствах альдегидов?
А. Все альдегиды вступают в
Б. Все альдегиды можно получить окислением соответствующих спиртов.
а) Верно только А; б) верно только Б;
в) верны оба суждения; г) оба суждения
неверны.
Слайд 28Для этилена характерны каждая из реакций ряда:
а) гидрирование, гидратация, изомеризация;
б) полимеризация,
в) галогенирование, гидрирование, дегидрогалогенирование;
г) окисление, поликонденсация, полимеризация.
Слайд 29Установите соответствие между общей формулой и каждым из двух классов органических
ОБЩАЯ ФОРМУЛА КЛАССЫ СОЕДИНЕНИ Й
А) СnН2n; 1) Алкины и алкадиены;
Б) СnН2n–2; 2) алкены и циклоалканы;
В) СnН2nО; 3) простые эфиры и спирты;
Г) СnН2n+2СО. 4) альдегиды и кетоны;
5) спирты и кетоны.
Слайд 30Для анилина справедливы утверждения:
1) взаимодействует с соляной кислотой;
2) взаимодействует с гидроксидом
3) взаимодействует с бромной водой;
4) с хлорной известью образует характерное фиолетовое окрашивание;
5) хорошо растворим в воде;
6) плохо растворяется в спирте, эфире и бензоле;
7) неядовит.
Слайд 31
Согласно термохимическому уравнению реакции 3Cu (тв.) + 8HNO3 (разб.) = 3Cu(NO3)2
Слайд 32
Какая масса йода выделится при взаимодействии 3 моль йодоводорода с необходимым
Слайд 33В 730 мл 15%-го раствора соляной кислоты (плотность 1,1 г/мл) растворили
Слайд 34
Установите молекулярную формулу диена, относительная плотность паров которого по воздуху равна
Слайд 35
Нитрит натрия массой 13,8 г внесли при нагревании в 220 г
Слайд 37Источники
Материалы курса «Подготовка выпускников средних учебных заведений к сдаче ЕГЭ по
Материалы курса «Подготовка выпускников средних учебных заведений к сдаче ЕГЭ по химии»: лекции 5 – 8. – Москва.: Педагогический университет «Первое сентября», 2010.
Материалы контрольной работы №1 для слушателей курса «Первое сентября» «Подготовка выпускников средних учебных заведений к сдаче ЕГЭ по химии»