- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Железо и его соединения 9 класс
Содержание
- 1. Железо и его соединения 9 класс
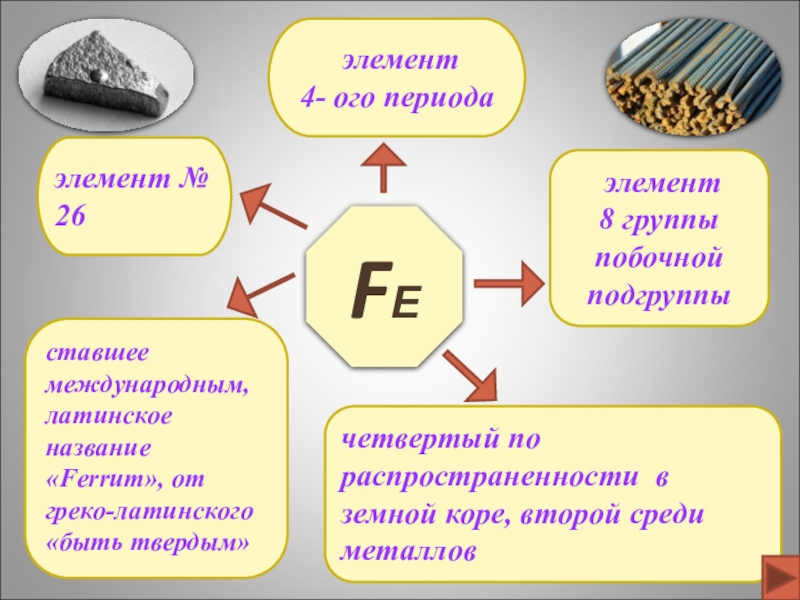
- 2. FЕэлемент № 26 элемент 4- ого периодачетвертый
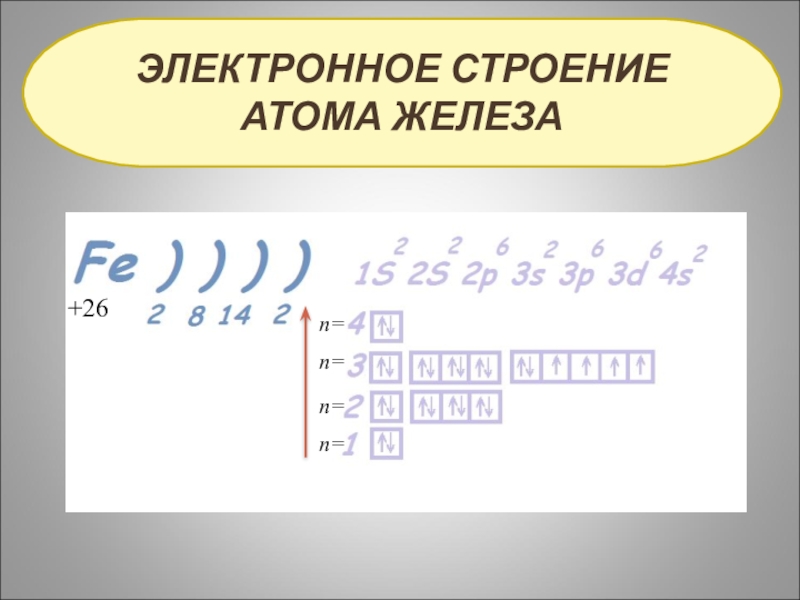
- 3. ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМА ЖЕЛЕЗАn=n=n=n=+26
- 4. Нахождение в природе В земной коре на
- 5. Первое металлическое железо, попавшее в руки человека,
- 6. Люди впервые овладели железом в 4-3 тысячелетиях
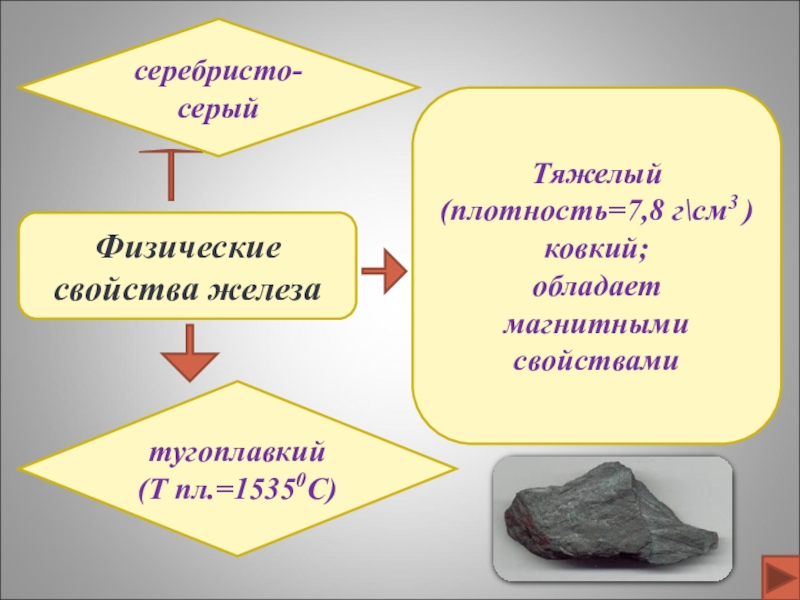
- 7. Физические свойства железасеребристо-серый тугоплавкий (Т пл.=15350C)Тяжелый (плотность=7,8 г\см3 )ковкий;обладает магнитными свойствами
- 8. Химические свойства Реакции с простыми веществамиЖелезо сгорает
- 9. Химические свойстваРеакции со сложными веществами С кислотами:А)
- 10. Железо разрушается под действием окружающей среды, т.е.
- 11. СОЕДИНЕНИЯ ЖЕЛЕЗА
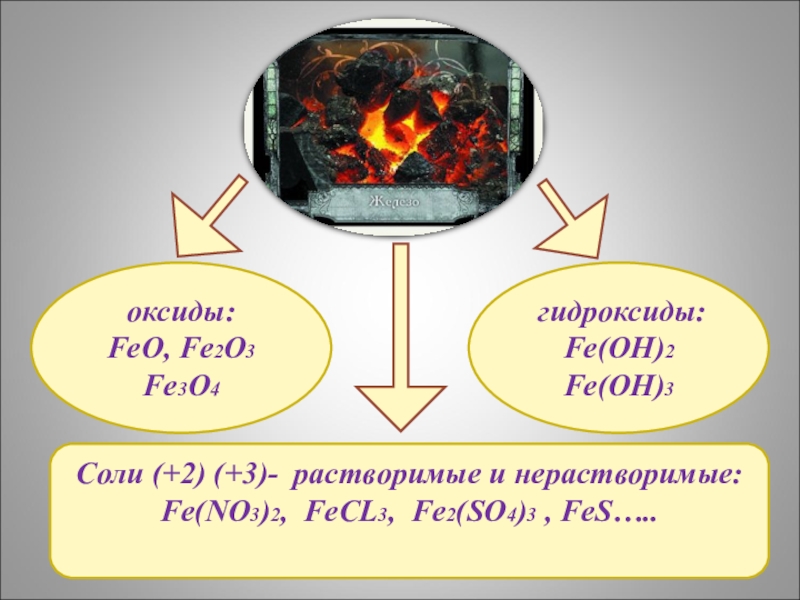
- 12. Соли (+2) (+3)- растворимые и нерастворимые:Fe(NO3)2, FeCL3, Fe2(SO4)3 , FeS…..оксиды:FeO, Fe2O3Fe3O4 гидроксиды:Fe(OH)2Fe(OH)3
- 13. ЖЕЛЕЗО В ОРГАНИЗМЕЖелезо в виде ионов присутствует
- 14. Основная роль железа в организме – участие
- 15. П Р И М Е Н Е
- 16. Чистое железо имеет довольно ограниченное применение. Его
- 17. С П Л А В ЫЖ Е
- 18. Железо сегодняГидроэлектро-станции и опорылиний электропередачТрубопроводы для воды,нефти и газаАвтомобили ,Тракторы,Подводные лодки,Бытовые приборы,Другие предметы
Слайд 2FЕ
элемент № 26
элемент
4- ого периода
четвертый по распространенности в земной
элемент
8 группы
побочной подгруппы
ставшее международным, латинское название «Ferrum», от греко-латинского «быть твердым»
Слайд 4Нахождение в природе
В земной коре на долю железа приходится около
Известно большое число руд и минералов, содержащих железо.
Оно бывает в виде различных соединений: оксидов, гидроксидов и солей.
В свободном виде железо находят в метеоритах, изредка встречается самородное железо (феррит) в земной коре как продукт застывания магмы.
Слайд 5Первое металлическое железо, попавшее в руки человека, имело, явно, метеоритное происхождение.
Руды железа широко распространены и часто встречаются даже на поверхности Земли
Железные изделия из метеоритного железа найдены в захоронениях, относящихся к очень давним временам (IV - V тысячелетиях до н.э.), в Египте и Месопотамии
Слайд 6Люди впервые овладели железом в 4-3 тысячелетиях
до н. э., подбирая
Самый древний способ получения железа основывается на его восстановлении из оксидных руд. В 19 веке были разработаны современные способы: мартеновские печи, электросталеплавильные процессы и другие методы…
История получения железа
Слайд 7Физические свойства железа
серебристо-серый
тугоплавкий
(Т пл.=15350C)
Тяжелый (плотность=7,8 г\см3 )
ковкий;
обладает
магнитными свойствами
Слайд 8
Химические свойства
Реакции с простыми веществами
Железо сгорает в чистом кислороде при
Реагирует с порошком серы при нагревании:Fe +S = FeS
Реагирует с галогенами при нагревании:2Fe + 3CL2=2FeCL3
Слайд 9Химические свойства
Реакции со сложными веществами
С кислотами:
А) с соляной кислотой
2HCL +
Б) с раствором серной кислоты
H2SO4 + Fe = FeSO4 + H2
С солями:
Fe + CuSO4= Cu + FeSO4
С водой(при высокой температуре):
3Fe + 4H2O=Fe3O4 +4H2
(железная окалина)
Слайд 10Железо разрушается под действием окружающей среды, т.е. подвергается коррозии – «ржавлению».
При
4Fe + 2Н2О + ЗО2 = 2(Fe2O3•Н2О)
Слайд 12Соли (+2) (+3)- растворимые и нерастворимые:
Fe(NO3)2, FeCL3, Fe2(SO4)3 , FeS…..
оксиды:
FeO, Fe2O3
Fe3O4
Fe(OH)2
Fe(OH)3
Слайд 13ЖЕЛЕЗО В ОРГАНИЗМЕ
Железо в виде ионов присутствует в организмах всех растений
Основная биологическая функция железа – участие в транспорте кислорода ко всем органам и окислительных процессах.
В организме человека с массой тела прниблизительно70 кг содержится 4,2 г железа, а в 1 л крови – 450 мг.
При недостатке железа в организме развивается железистая анемия.
Перенос железа в организме осуществляет важнейший белок –гемоглобин, в котором находится больше половины всего железа организма.
Слайд 14Основная роль железа в организме – участие в «рождении» красных (эритроцитов)
Эритроциты содержат гемоглобин - переносчик кислорода, а лимфоциты ответственны за иммунитет.
Почти 60%, поступающего в организм железа расходуется на синтез гемоглобина.
Некоторое количество (примерно 20%) - откладывается в мышцах, костном мозге, печени и селезенке.
Еще 20% его используется для синтеза различных ферментов.
Слайд 16Чистое железо имеет довольно ограниченное применение.
Его используют при изготовлении сердечников
Находят широкое применение и многие соединения железа. Так, сульфат железа (III) используют при водоподготовке, оксиды и цианид железа служат пигментами при изготовлении красителей и так далее.
Но сплавы железа — чугун и сталь — составляют основу современной техники
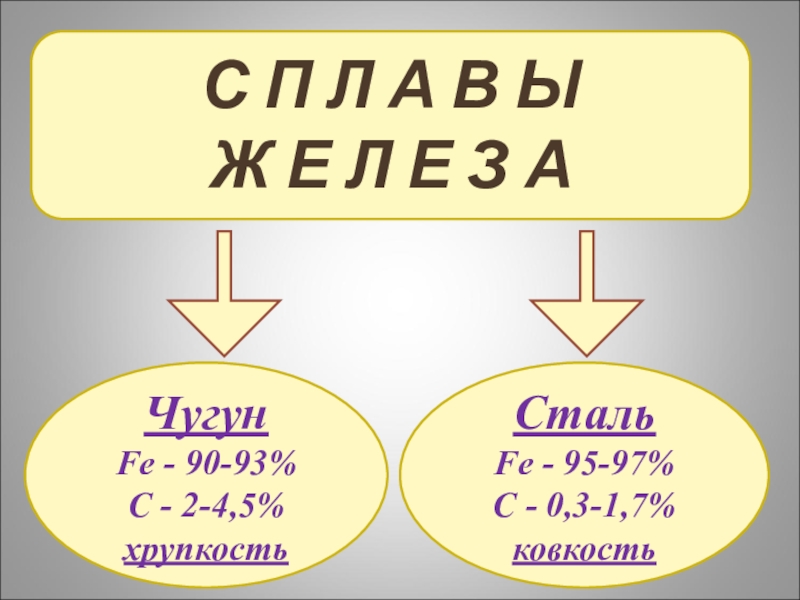
Слайд 17С П Л А В Ы
Ж Е Л Е З А
Чугун
Fe
C - 2-4,5%
хрупкость
Сталь
Fe - 95-97%
C - 0,3-1,7%
ковкость
Слайд 18Железо сегодня
Гидроэлектро-
станции и опоры
линий электропередач
Трубопроводы
для воды,
нефти и газа
Автомобили ,
Тракторы,
Подводные лодки,
Бытовые
Другие предметы