- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Вычисление массы или объема продукта реакции по известной массе или объему исходного вещества, содержащего примеси.
Содержание
- 1. Вычисление массы или объема продукта реакции по известной массе или объему исходного вещества, содержащего примеси.
- 2. Цель урока: научиться решать задачи данного типа
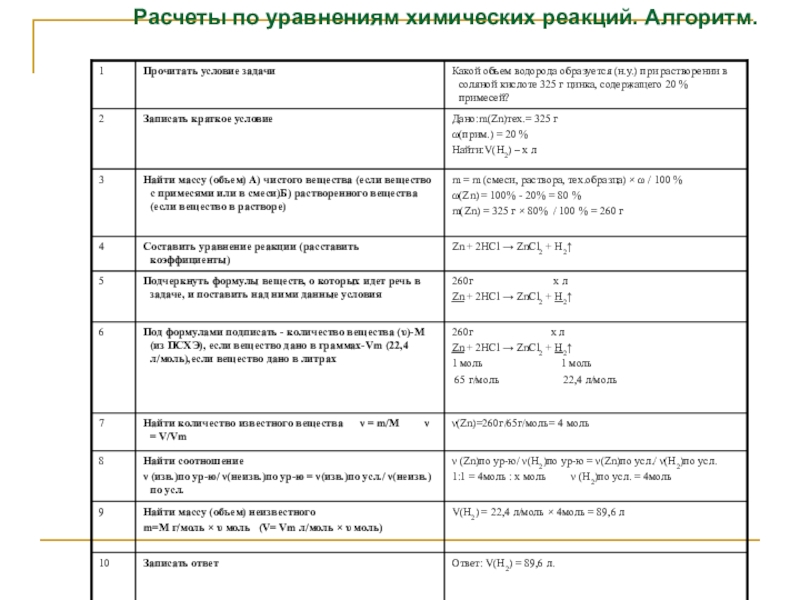
- 3. Алгоритм вычисления по уравнениям реакций: Записать в
- 4. Расчеты по уравнениям химических реакций. Алгоритм.
- 5. Для вычисления чистого вещества или примеси, содержащихся
- 6. Расчеты по уравнениям химических реакций. Алгоритм.
- 7. При прокаливании 400 г натриевой
- 8. Решение:Находим чистую массу нитрата натрия (натриевой селитры):
- 9. 2. Сколько литров углекислого газа можно получить из 119 грамм известняка, содержащего 16 % примесей?
- 10. Решение:Находим массовую долю карбоната кальция в известняке:
- 11. 3. Какой объём кислорода и воздуха потребуется,
- 12. Решение:1) Вычисляем, сколько чистого оксида углерода (II)
- 13. Домашнее задание:1.Повторить записи в тетради.2.Решить задачи: а).
Цель урока: научиться решать задачи данного типа
Слайд 3Алгоритм вычисления по уравнениям реакций:
Записать в «ДАНО» массы или количество вещества
по условию задачи, с указанием формулы вещества (например: m(H2 SO4) = 56г).
Составить уравнение химической реакции.
В уравнении одной чертой подчеркнуть формулы веществ, массы которых указаны в условии задачи, а двумя чертами – формулы тех веществ, массы которых требуется вычислить.
Под формулами этих веществ указать количество вещества (число молей) согласно уравнению реакции (это будут коэффициенты, стоящие перед веществами в уравнении реакции).
Массу вещества, данную в условии задачи, перевести в моль:
и поставить над формулой вещества.
Над неизвестным веществом поставить х моль.
По уравнению реакции установить соотношение количеств веществ и найти искомую величину.
Записать ответ
Составить уравнение химической реакции.
В уравнении одной чертой подчеркнуть формулы веществ, массы которых указаны в условии задачи, а двумя чертами – формулы тех веществ, массы которых требуется вычислить.
Под формулами этих веществ указать количество вещества (число молей) согласно уравнению реакции (это будут коэффициенты, стоящие перед веществами в уравнении реакции).
Массу вещества, данную в условии задачи, перевести в моль:
и поставить над формулой вещества.
Над неизвестным веществом поставить х моль.
По уравнению реакции установить соотношение количеств веществ и найти искомую величину.
Записать ответ
Слайд 5Для вычисления чистого вещества или примеси, содержащихся в смеси, используют формулы
ω(чист.
в-ва)=100% - ω(примеси);
ω(чист. в-ва)= m(чист. в-ва)/m(смеси) →
→ m(чист. в-ва)= m(смеси) • ω(чист. в-ва)
или
Вначале определяют массу примеси:
m(примеси)= m(смеси) • ω(примеси),
а затем вычитают её из массы смеси:
m(чист. в-ва)= m(смеси) - m(примеси)
ω(чист. в-ва)= m(чист. в-ва)/m(смеси) →
→ m(чист. в-ва)= m(смеси) • ω(чист. в-ва)
или
Вначале определяют массу примеси:
m(примеси)= m(смеси) • ω(примеси),
а затем вычитают её из массы смеси:
m(чист. в-ва)= m(смеси) - m(примеси)
Слайд 7 При прокаливании 400 г натриевой селитры получили 33,6 л кислорода. какова
массовая доля примесей в селитре?
Слайд 8
Решение:
Находим чистую массу нитрата натрия (натриевой селитры):
Пишем уравнение реакции, подставляем сверху
объем кислорода, снизу данные согласно уравнению:
x г 33,6 л
2NaNO3 = 2NaNO2 + O2↑
170 г 22,4 л
M(NaNO3) = 23 + 14 + 16 • 3 = 85 (г/моль)
m(NaNO3) = M • n = 85 г/моль • 2 моль = 170 г
v(O2) = 22,4 л/моль • 1 моль = 22,4 л
Составляем пропорцию: x г — 33,6 л 170 г — 22,4 л х = 170 г • 33,6 л / 22,4 л = 255 г
Находим массу примесей: 400 г − 255 г = 145 г
Находим массовую долю примесей: ω = 145г / 400 г = 0,36 = 36%
Ответ: 36 %
Составляем пропорцию: x г — 33,6 л 170 г — 22,4 л х = 170 г • 33,6 л / 22,4 л = 255 г
Находим массу примесей: 400 г − 255 г = 145 г
Находим массовую долю примесей: ω = 145г / 400 г = 0,36 = 36%
Ответ: 36 %
Слайд 92. Сколько литров углекислого газа можно получить из 119 грамм известняка,
содержащего 16 % примесей?
Слайд 10
Решение:
Находим массовую долю карбоната кальция в известняке:
ω(CaCO3) = 100% − 16%
= 84%
Находим чистую массу карбоната кальция: m(CaCO3) = 119 г • 84% = 119 г • 0,84 = 100 г
Пишем уравнение реакции, подставляем сверху данные по условию задачи, снизу данные согласно уравнению: 100 г x л CaCO3 = CaO + CO2↑ 100 г 22,4 л M(CaCO3) = 40 + 12 + 16 • 3 = 100 (г/моль) m(CaCO3) = M • n = 100 г/моль • 1 моль = 100 г v(CO2) = 22,4 л/моль • 1 моль = 22,4 л
Составляем пропорцию: 100 г — x л 100 г — 22,4 л х = 100 г • 22,4 л / 100 г = 22,4 л
Ответ: 22,4 л
Находим чистую массу карбоната кальция: m(CaCO3) = 119 г • 84% = 119 г • 0,84 = 100 г
Пишем уравнение реакции, подставляем сверху данные по условию задачи, снизу данные согласно уравнению: 100 г x л CaCO3 = CaO + CO2↑ 100 г 22,4 л M(CaCO3) = 40 + 12 + 16 • 3 = 100 (г/моль) m(CaCO3) = M • n = 100 г/моль • 1 моль = 100 г v(CO2) = 22,4 л/моль • 1 моль = 22,4 л
Составляем пропорцию: 100 г — x л 100 г — 22,4 л х = 100 г • 22,4 л / 100 г = 22,4 л
Ответ: 22,4 л
Слайд 113. Какой объём кислорода и воздуха потребуется, чтобы сжечь 224 м3
оксида углерода (II), если содержание в нём негорючих примесей в объёмных долях равно 0,25 (или 25 %).
Слайд 12
Решение:
1) Вычисляем, сколько чистого оксида углерода (II) содержится в смеси
100 % – 25 % = 75 % (чистого СО)
в 100 м3 смеси содержится 75 м3 СО
в 224 м3 ----------------- x м3; x = =168 (м3) – V(CO)
2) Определяем, какой объём кислорода потребуется, чтобы сжечь 168 м3 оксида углерода (II).
Запишем уравнение химической реакции, расставим коэффициенты:
168 м3 у м3
2 СО + О2 = 2СО2
2 моль 1 моль
Vm 22,4 м3/моль
V (CO) = 2 ×22,4 =44,8 (м3) V (O2) = 1×22,4 = 22,4 (м3)
y == 84 V (O2) = 84 м3
3) Находим объём воздуха, необходимый для реакции.
Воздух содержит 0,209 объёмных долей (или20,9 %) кислорода. Отсюда следует:
100 м3 воздуха содержит 20,9 м3 кислорода
z м3 ------------------------ 84 м3 кислорода; z = = 401,9 (м3) - V (возд.)
Ответ: 84 м3 кислорода; 401,9 м3 воздуха.
Слайд 13Домашнее задание:
1.Повторить записи в тетради.
2.Решить задачи:
а). Вычислите, какой объём (н. у.)
углекислого газа можно получить при взаимодействии 100 г известняка, содержащего 20 % некарбонатных примесей, с избытком соляной кислоты.
б). При сгорании 187,5 г угля образовалось 336 л оксида углерода (IV) (н. у.). Вычислите массовую долю углерода в угле.