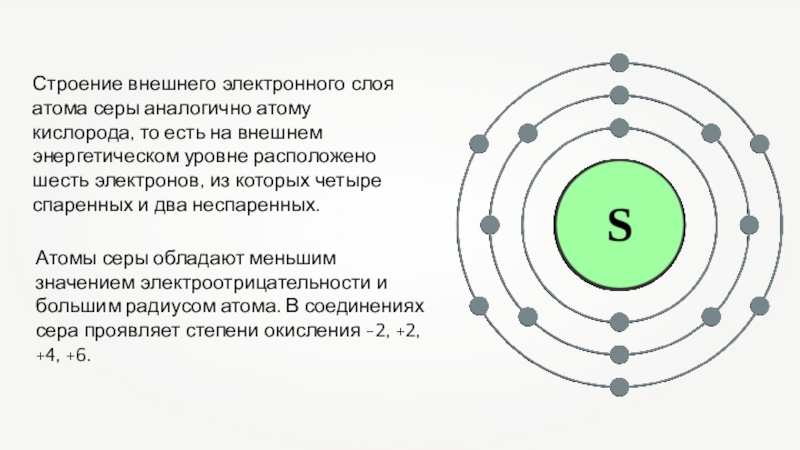
Атомы серы обладают меньшим значением электроотрицательности и большим радиусом атома. В соединениях сера проявляет степени окисления -2, +2, +4, +6.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Урок по теме Сера
Содержание
- 1. Урок по теме Сера
- 2. Строение внешнего электронного слоя атома серы аналогично
- 3. Слайд 3
- 4. Слайд 4
- 5. Слайд 5
- 6. Химические свойства серыMg + S = MgS2Al
- 7. Химические свойства серыZn + S = ZnSС
- 8. Химические свойства серыS + O2 = SO2Из
- 9. Слайд 9
- 10. Слайд 10
- 11. Если организму недостаточно серы, то наблюдается хрупкость и ломкость костей, а также выпадение волос.
- 12. Слайд 12
- 13. – производство серной кислоты;– в качестве горючего
- 14. Слайд 14
- 15. Антуан Лоран Лавуазье 1743–1794 гг. Установил элементарную природу
- 16. Название «сера» восходит к лат. sera —
Строение внешнего электронного слоя атома серы аналогично атому кислорода, то есть на внешнем энергетическом уровне расположено шесть электронов, из которых четыре спаренных и два неспаренных. Атомы серы обладают меньшим значением электроотрицательности и большим радиусом атома. В
Слайд 2Строение внешнего электронного слоя атома серы аналогично атому кислорода, то есть
на внешнем энергетическом уровне расположено шесть электронов, из которых четыре спаренных и два неспаренных.
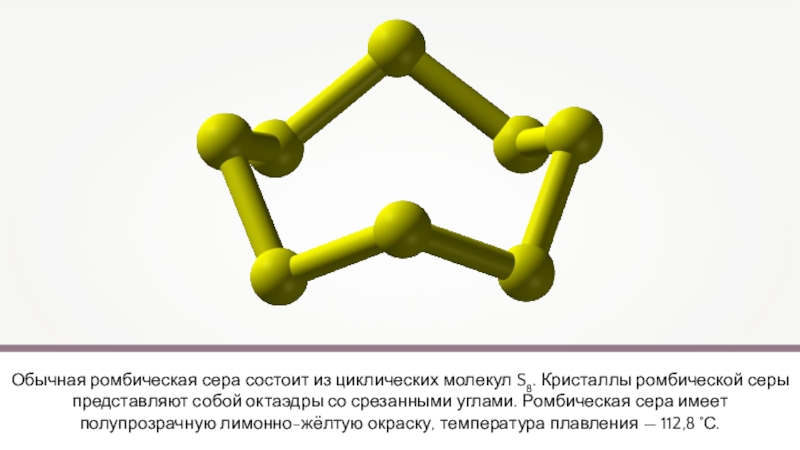
Слайд 6
Химические свойства серы
Mg + S = MgS
2Al + 3S = Al2S3
Взаимодействует
со многими металлами, кроме золота и платины:
Взаимодействует со всеми щелочными, щёлочноземельными металлами, а также медью, ртутью и серебром при обычных условиях:
Cu + S = CuS
Hg + S = HgS
Слайд 7
Химические свойства серы
Zn + S = ZnS
С остальными металлами сера реагирует
при нагревании:
Окислительные свойства сера проявляет при взаимодействии с некоторыми неметаллами:
H2 + S = H2S
Слайд 8
Химические свойства серы
S + O2 = SO2
Из неметаллов с серой не
реагируют только азот, йод и благородные газы. При взаимодействии с кислородом сера проявляет восстановительные свойства:
Слайд 11Если организму недостаточно серы,
то наблюдается хрупкость и ломкость костей, а
также выпадение волос.
Слайд 13– производство серной кислоты;
– в качестве горючего вещества входит в состав
чёрного пороха и спичечных головок;
– в сельском хозяйстве для борьбы с вредителями растений;
– в медицине для лечения кожных заболеваний;
– производство бумаги, красок, резины, косметических препаратов.
– в сельском хозяйстве для борьбы с вредителями растений;
– в медицине для лечения кожных заболеваний;
– производство бумаги, красок, резины, косметических препаратов.
Применение серы
Слайд 15
Антуан Лоран Лавуазье
1743–1794 гг.
Установил элементарную природу серы 1 ноября 1772
г. в опытах по сжиганию.
Слайд 16Название «сера» восходит к лат. sera — «воск» или лат. serum
— «сыворотка». Лат. «sulphur» предположительно восходит к индоевропейскому корню «swelp» — «гореть».