- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Урок по теме Ионный обменТема урокаГруппа Дата ТСО
Содержание
- 1. Урок по теме Ионный обменТема урокаГруппа Дата ТСО
- 2. Реакции ионного обмена
- 3. Учебно-воспитательные цели и задачи урока:Повторить и закрепить
- 4. Сформировать понятие качественной реакции;Выяснить причину обратимости ионного обмена;Рассмотреть условия, при которых реакции обмена идут до конца.
- 5. Обобщение изученного материала по теме: "Электролитическая диссоциация"
- 6. Поведение и свойства каких веществ объясняет теория
- 7. Для чего вводят понятие степени диссоциации?Чем принципиально
- 8. Сванте АРРЕНИУС (19.II.1859 − 2.X.1927)
- 9. Тестовый письменный контроль по двум вариантам по теме: «Электролитическая диссоциация».
- 10. Правильные варианты ответов 1 вариант
- 11. Тема урока:Реакции ионного обмена
- 12. Pb(NO3)2 + 2KI = PbI2 ↓+ 2
- 13. При составлении ионных уравнений необходимо помнить:Сильные электролиты
- 14. Порядок написания полного и сокращенного ионного уравненияЗаписать
- 15. 3. Записать уравнение в ионной формеPb2+ +2NO3-
- 16. В реакции могут вступать слабые электролиты или
- 17. С участием ионов могут протекать как обменные, так и окислительно-восстановительные реакции5Na2SO3+2KMnO4+3H2SO4==2MnSO4+5Na2SO4+K2 SO4+3H2O
- 18. Реакции ионного обмена в водных растворах могут
- 19. В состав каких классов соединений могут входить
- 20. Составление полного ионного и молекулярного уравнения по
- 21. записать формулы реагентов в молекулярной форме ;
- 22. Приведите примеры трех уравнений реакций, которые можно
- 23. Могут ли одновременно существовать в растворе следующие
- 24. Составьте молекулярные и ионные уравнения реакций: PbS
- 25. 1. Научились составлять уравнения
- 26. Зная свойства ионов, можно предсказать результаты реакций
- 27. Выполнить задания по опорному конспекту. Ю.М. Ерохин,
Слайд 3Учебно-воспитательные
цели и задачи урока:
Повторить и закрепить знания по теме «Электролитическая диссоциация»;
Углубить понятие о свойствах электролитов как свойствах ионов;
Научиться составлять полные и сокращенные ионные уравнения реакций;
Слайд 4
Сформировать понятие качественной реакции;
Выяснить причину обратимости ионного обмена;
Рассмотреть условия, при которых
Слайд 6Поведение и свойства каких веществ объясняет теория ЭД?
Какие вещества называются электролитами?
Чем объясняются особые свойства электролитов?
Как определяется заряд иона?
Какова роль воды в диссоциации электролитов? Возможна ли диссоциация в неводных растворах?
Слайд 7
Для чего вводят понятие степени диссоциации?
Чем принципиально отличаются сильная кислота от
Приведите примеры сильных электролитов.
Чем объясняются общие свойства кислот, оснований?
С помощью каких веществ можно обнаружить присутствие ионов Н+, ОН-?
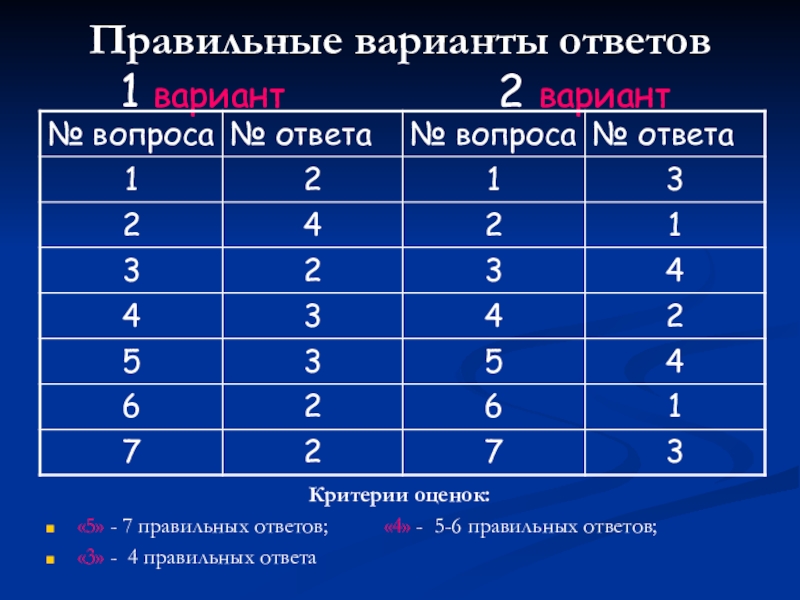
Слайд 10Правильные варианты ответов 1 вариант
Критерии оценок:
«5» - 7 правильных ответов; «4» - 5-6 правильных ответов;
«3» - 4 правильных ответа
Слайд 12Pb(NO3)2 + 2KI = PbI2 ↓+ 2 KNO3
Почему в
Взаимодействие ионов в растворе называется ионной реакцией
Слайд 13При составлении ионных уравнений необходимо помнить:
Сильные электролиты полностью диссоциируют на ионы;
Вещества,
Сумма зарядов в левой и правой частях уравнения равны нулю.
Слайд 14Порядок написания полного и сокращенного ионного уравнения
Записать уравнение в молекулярной форме,
Pb(NO3)2 + 2KI = PbI2 + 2 KNO3
2. Обозначить вещества, покидающие сферу реакции
Слайд 153. Записать уравнение в ионной форме
Pb2+ +2NO3- +2K++2I- = PbI2 ↓+2K+
4. Исключить из обеих частей уравнения одинаковые ионы
Pb2+ +2NO3- +2K++2I- = PbI2 ↓+2K+ +2NO3-
5. Записать оставшиеся ионы
Pb2+ +2I- = PbI2 ↓
Сокращенное ионное уравнение:
отражает сущность реакции
Слайд 16В реакции могут вступать слабые электролиты или нерастворимые в воде соединения
СаСО3
СаСО3 + 2H + +2Cl - ↔ Ca2+ + 2Cl- + CO2 ↑ + H 2O
СаСО3 + 2H + ↔ Ca2+ + CO2 ↑ + H 2O
Будет такая реакция идти до конца?
Слайд 17С участием ионов могут протекать как обменные, так и окислительно-восстановительные реакции
5Na2SO3+2KMnO4+3H2SO4=
=2MnSO4+5Na2SO4+K2
Слайд 18Реакции ионного обмена в водных растворах могут протекать
Необратимо до конца
когда ионы,
а) нерастворимые (↓)
б) малодиссоциированные (Н2О)
в) газообразные (↑)
Обратимо,
т.е. одновременно в двух противоположных направлениях
если среди исходных веществ и среди продуктов имеются слабые электролиты или нерастворимые вещества
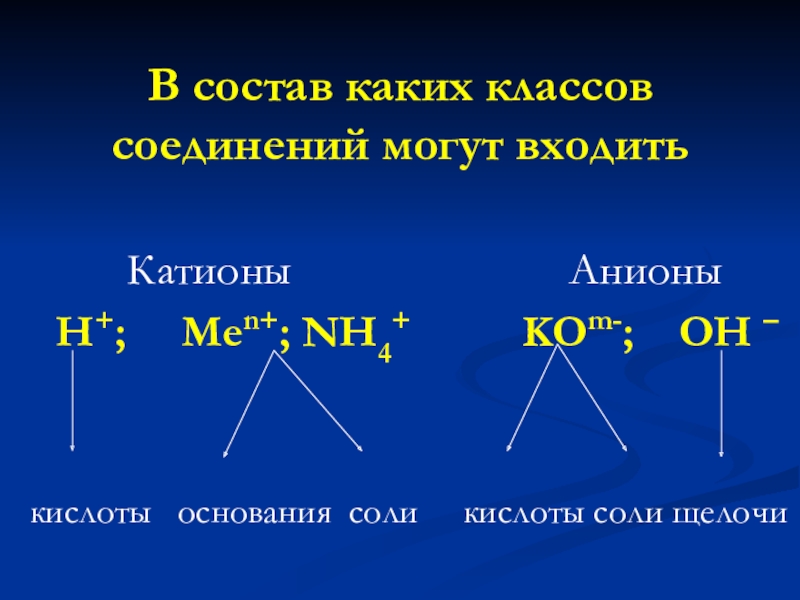
Слайд 19В состав каких классов соединений могут входить
H+; Men+; NH4+ KOm-; OH –
кислоты основания соли кислоты соли щелочи
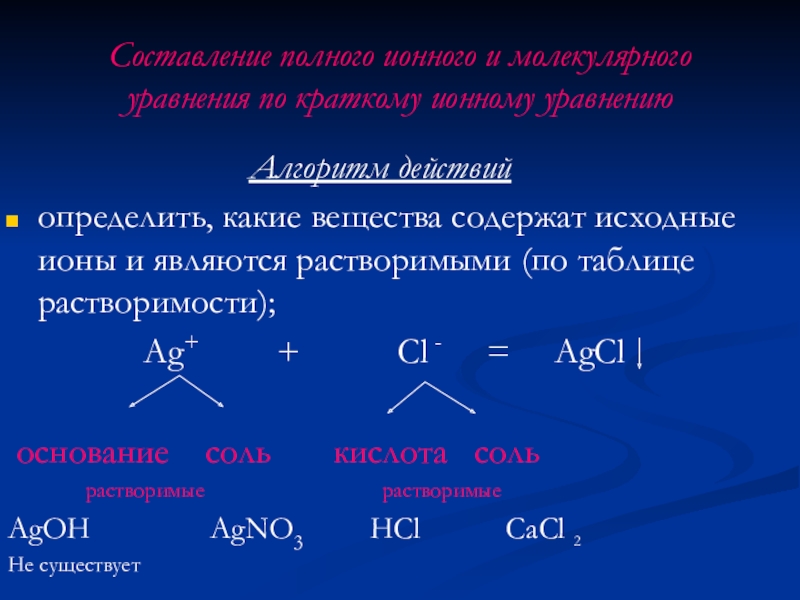
Слайд 20Составление полного ионного и молекулярного уравнения по краткому ионному уравнению
Алгоритм действий
определить,
Ag+ + Cl - = AgCl
основание соль кислота соль
растворимые растворимые
AgOH AgNO3 HCl CaCl 2
Не существует
Слайд 21
записать формулы реагентов в молекулярной форме ;
AgNO3 + CaCl
составить уравнение реакции в молекулярной и ионной форме
AgNO3 + CaCl 2 = 2AgCl + Ca(NO3)2
Слайд 22
Приведите примеры трех уравнений реакций, которые можно выразить одним ионным уравнением:
Закрепление
Слайд 23
Могут ли одновременно существовать в растворе следующие ионы: a) Na+ и
При действии растворов каких веществ : NaCl, KClO3 или ВaCl2
на раствор AgNO3 выпадет осадок AgCl?
Слайд 24Составьте молекулярные и ионные уравнения реакций:
PbS + HCl =
Fe(OH)3 + HNO3=
Какие
Слайд 25 1. Научились составлять уравнения реакций, которые отражают сущность
2. Выяснили, что сущность реакции нейтрализации сводится к взаимодействию ионов Н+ (носителя кислотных свойств) и ОН - (носителя щелочных свойств), в результате чего получается вода. Это можно рассматривать как диалектическое единство противоположных начал.
Вывод:
Слайд 26
Зная свойства ионов, можно предсказать результаты реакций между электролитами.
4. Выяснили условия,
Слайд 27Выполнить задания по опорному конспекту.
Ю.М. Ерохин, В.И.Фролов "Сборник задач и
Подготовиться к лабораторной работе №1
Задание на дом: