- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Урок по теме: Амны (2 вариант)
Содержание
- 1. Урок по теме: Амны (2 вариант)
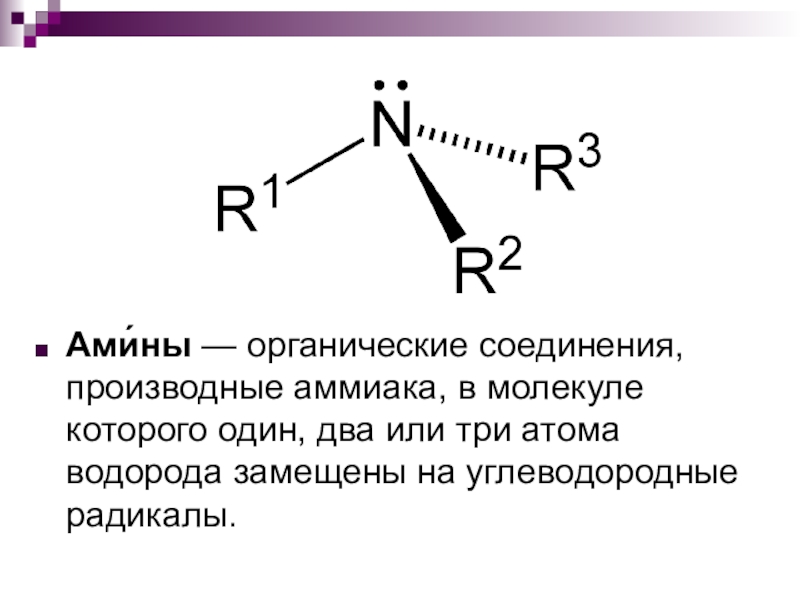
- 2. Ами́ны — органические соединения, производные аммиака, в молекуле
- 3. НоменклатураК названию органических групп, связанных с азотом,
- 4. В некоторых случаях применяют устоявшиеся названия, которые
- 5. КлассификацияАмины классифицируют по двум структурным признакам:По количеству
- 6. Слайд 6
- 7. Физические свойстваПервые представители ряда аминов — метиламин CH3NH2,
- 8. Химические свойстваАмины, являясь производными аммиака, имеют сходное
- 9. Третичные амины также присоединяют HCl, но при
- 10. Химические свойства:1. Горение:
- 11. 3. Взаимодействие с кислотами (основные свойства):
- 12. Получение аминовПри взаимодействии аммиака с галогеналкилами, например
- 13. В отличие от алифатических галогеналкилов, арилгалогениды, например,
- 14. При взаимодействии альдегидов и кетонов с аммонийной
- 15. Нитросоединения (содержащие группу –NO2) при восстановлении образуют
- 16. Применение аминов Основное применение аминов –
- 17. Алифатические диамины – исходные соединения для получения
- 18. На основе сульфаниловой кислоты синтезируют противовоспалительные лекарственные
- 19. Вредное воздействиеАмины являются очень токсичными веществами. Опасно
Ами́ны — органические соединения, производные аммиака, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.
Слайд 2Ами́ны — органические соединения, производные аммиака, в молекуле которого один, два или
три атома водорода замещены на углеводородные радикалы.
Слайд 3Номенклатура
К названию органических групп, связанных с азотом, добавляют слово «амин», при
этом группы упоминают в алфавитном порядке, например, СН3NHС3Н7 – метилпропиламин, СН3N(С6Н5)2 – метилдифениламин.
Правила допускают также составлять название, взяв за основу углеводород, в котором аминогруппу рассматривают как заместитель. В таком случае ее положение указывают с помощью числового индекса:
2-аминопентан
Для некоторых аминов сохранились тривиальные (упрощенные) названия: С6Н5NH2 – анилин (название по правилам номенклатуры – фениламин).
Правила допускают также составлять название, взяв за основу углеводород, в котором аминогруппу рассматривают как заместитель. В таком случае ее положение указывают с помощью числового индекса:
2-аминопентан
Для некоторых аминов сохранились тривиальные (упрощенные) названия: С6Н5NH2 – анилин (название по правилам номенклатуры – фениламин).
Слайд 4В некоторых случаях применяют устоявшиеся названия, которые представляют собой искаженные правильные
названия: Н2NСН2СН2ОН – моноэтаноламин (правильно – 2-аминоэтанол); (ОНСН2СН2)2NH – диэтаноламин, правильное название – бис(2-гидроксиэтил)амин. Тривиальные, искаженные и систематические (составленные по правилам номенклатуры) названия довольно часто сосуществуют в химии.
Слайд 5Классификация
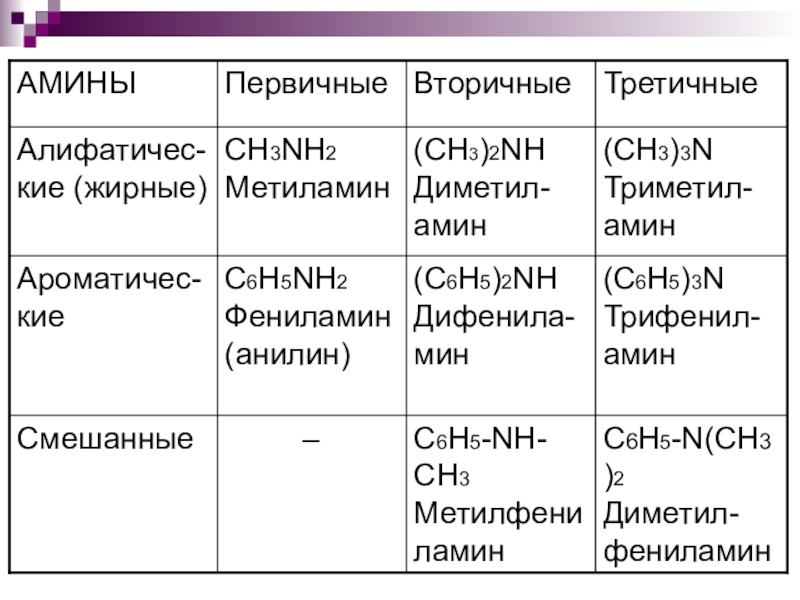
Амины классифицируют по двум структурным признакам:
По количеству радикалов, связанных с атомом
азота, различают первичные, вторичные и третичные амины.
По характеру углеводородного радикала амины подразделяются на алифатические (жирные), ароматические и смешанные (или жирноароматические).
По характеру углеводородного радикала амины подразделяются на алифатические (жирные), ароматические и смешанные (или жирноароматические).
Простейший представитель - метиламин
Слайд 7Физические свойства
Первые представители ряда аминов — метиламин CH3NH2, диметиламин (CH3)2NH, триметиламин (CH3)3N
и этиламин C2H5NH2 — при комнатной температуре газообразные, далее при увеличении числа атомов в R амины становятся жидкостями, а при увеличении длины цепи R до 10 атомов С — кристаллическими веществами. Растворимость аминов в воде убывает по мере увеличения длины цепи R и при возрастании числа органических групп, связанных с азотом (переход к вторичным и третичным аминам). Запах аминов напоминает запах аммиака, высшие (с большими R) амины практически лишены запаха.
Слайд 8Химические свойства
Амины, являясь производными аммиака, имеют сходное с ним строение и
проявляют подобные ему свойства. Для них также характерно образование донорно-акцепторной связи. Азот предоставляет неподеленную электронную пару, исполняя роль донора. В качестве акцептора электоронов может выступать, например, протон Н+, образуя ион R3NH+. Возникшая ковалентная связь N-H полностью эквивалентна остальным связям N-H в амине.
Рис. Присоединение HCl к амину с образованием донорно-акцепторной связи. Атом азота дает для образования связи пару электронов. Роль акцептора исполняет протон, который, присоединясь к азоту, образует катион метиламмония, как в неорганических аммонийных солях.
Слайд 9Третичные амины также присоединяют HCl, но при нагревании полученной соли в
растворе кислоты она распадается, при этом R отщепляется от атома N:
(C2H5)3N + HCl ? [(C2H5)3NH]Сl
[(C2H5)3NH]Сl ? (C2H5)2NH + C2H5Сl
При сравнении этих двух реакций видно, что C2H5-группа и Н, как бы меняются местами, в итоге из третичного амина образуется вторичный.
(C2H5)3N + HCl ? [(C2H5)3NH]Сl
[(C2H5)3NH]Сl ? (C2H5)2NH + C2H5Сl
При сравнении этих двух реакций видно, что C2H5-группа и Н, как бы меняются местами, в итоге из третичного амина образуется вторичный.
Слайд 10Химические свойства:
1. Горение:
4CH3NH2 + 9O2 ? 4CO2
+ 10H2O +2N2
4C6H5NH2 + 31O2 ? 24CO2 + 14H2O + 2N2
2. Взаимодействие с водой:
CH3NH2 + H2O ? CH3NH3+ + OH-
Анилин с водой практически не реагирует.
2. Взаимодействие с водой:
CH3NH2 + H2O ? CH3NH3+ + OH-
Анилин с водой практически не реагирует.
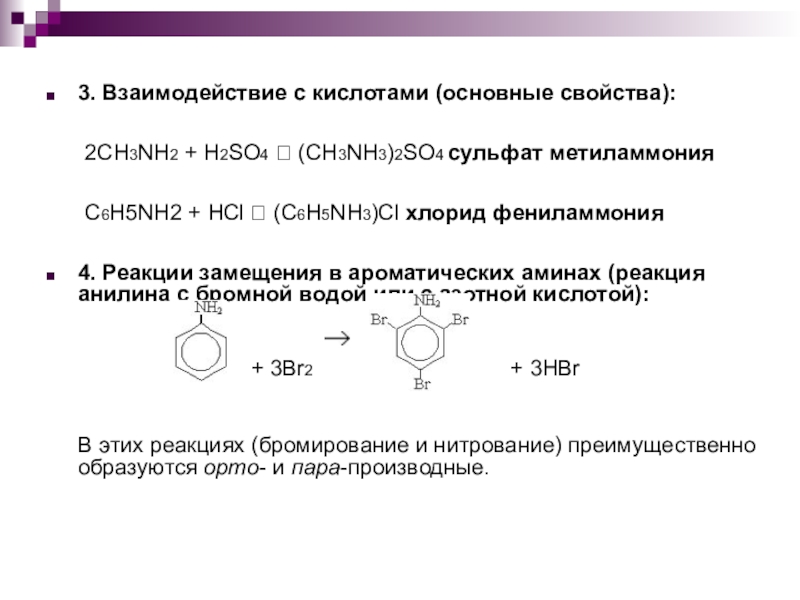
Слайд 113. Взаимодействие с кислотами (основные свойства):
2CH3NH2 + H2SO4
? (CH3NH3)2SO4 сульфат метиламмония
C6H5NH2 + HCl ? (C6H5NH3)Cl хлорид фениламмония
4. Реакции замещения в ароматических аминах (реакция анилина с бромной водой или с азотной кислотой):
+ 3Br2 + 3HBr
В этих реакциях (бромирование и нитрование) преимущественно образуются орто- и пара-производные.
C6H5NH2 + HCl ? (C6H5NH3)Cl хлорид фениламмония
4. Реакции замещения в ароматических аминах (реакция анилина с бромной водой или с азотной кислотой):
+ 3Br2 + 3HBr
В этих реакциях (бромирование и нитрование) преимущественно образуются орто- и пара-производные.
Слайд 12Получение аминов
При взаимодействии аммиака с галогеналкилами, например RCl, образуется смесь первичных,
вторичных и третичных аминов. Образующийся побочный продукт HCl присоединяется к аминам, образуя аммониевую соль, но при избытке аммиака соль разлагается, что позволяет проводить процесс вплоть до образования четвертичных аммониевых солей:
Слайд 13В отличие от алифатических галогеналкилов, арилгалогениды, например, С6Н5Cl, реагируют с аммиаком
с большим трудом, синтез возможен только при катализаторах, содержащих медь. В промышленности алифатические амины получают каталитическим взаимодействием спиртов с NH3 при 300–500° С и давлении 1–20 МПа, в результате получают смесь первичных, вторичных и третичных аминов.
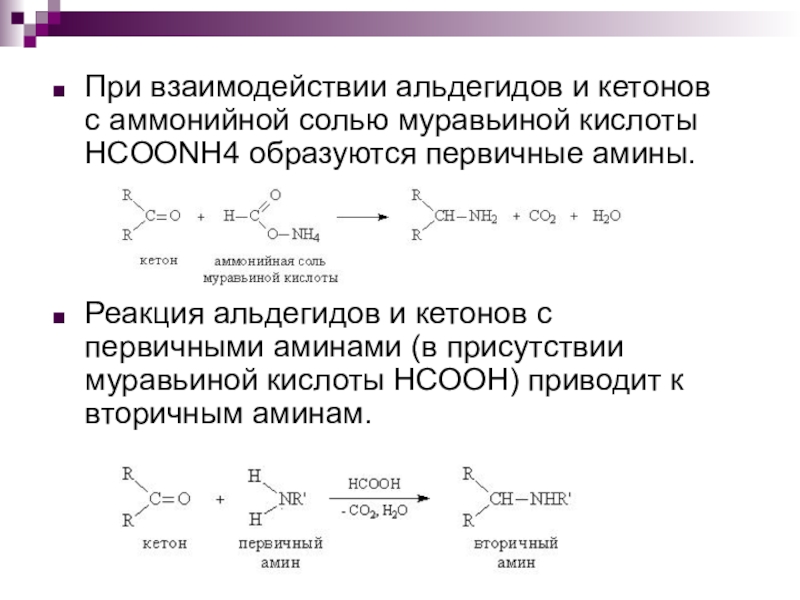
Слайд 14При взаимодействии альдегидов и кетонов с аммонийной солью муравьиной кислоты HCOONH4
образуются первичные амины.
Реакция альдегидов и кетонов с первичными аминами (в присутствии муравьиной кислоты НСООН) приводит к вторичным аминам.
Реакция альдегидов и кетонов с первичными аминами (в присутствии муравьиной кислоты НСООН) приводит к вторичным аминам.
Слайд 15Нитросоединения (содержащие группу –NO2) при восстановлении образуют первичные амины. Этот метод,
предложенный Н.Н.Зининым, мало применяется для алифатических соединений, но важен для получения ароматических аминов и лег в основу промышленного производства анилина:
Слайд 16Применение аминов
Основное применение аминов – как
промежуточные
продукты при получении
различных органических веществ. Ведущая
роль принадлежит анилину, на основе которого производится широкий спектр анилиновых красителей, причем цветовая «специализация» закладывается уже на стадии получения самого анилина. Сверхчистый анилин без примеси гомологов называют в промышленности «анилин для синего» (имеется в виду цвет будущего красителя). «Анилин для красного» должен содержать, помимо анилина, смесь орто- и пара-толуидина (СН3С6Н4NH2).
различных органических веществ. Ведущая
роль принадлежит анилину, на основе которого производится широкий спектр анилиновых красителей, причем цветовая «специализация» закладывается уже на стадии получения самого анилина. Сверхчистый анилин без примеси гомологов называют в промышленности «анилин для синего» (имеется в виду цвет будущего красителя). «Анилин для красного» должен содержать, помимо анилина, смесь орто- и пара-толуидина (СН3С6Н4NH2).
Слайд 17Алифатические диамины – исходные соединения для получения полиамидов, например, найлона, широко
применяемого для изготовления волокон, полимерных пленок, а также узлов и деталей в машиностроении (полиамидные зубчатые передачи).
Из алифатических диизоцианатов получают полиуретаны, которые обладают комплексом технически важных свойств: высокой прочностью в сочетании с эластичностью и очень высоким сопротивлением истиранию (полиуретановые обувные подошвы), а также хорошей адгезией к широкому кругу материалов (полиуретановые клеи). Широко их применяют и во вспененной форме (пенополиуретаны).
Из алифатических диизоцианатов получают полиуретаны, которые обладают комплексом технически важных свойств: высокой прочностью в сочетании с эластичностью и очень высоким сопротивлением истиранию (полиуретановые обувные подошвы), а также хорошей адгезией к широкому кругу материалов (полиуретановые клеи). Широко их применяют и во вспененной форме (пенополиуретаны).
Слайд 18На основе сульфаниловой кислоты синтезируют противовоспалительные лекарственные препараты сульфаниламиды.
Соли диазония
применяют в фоточувствительных материалах для светокопирования, которое позволяет получать изображение, минуя обычную галоидосеребряную фотографию.
Слайд 19Вредное воздействие
Амины являются очень токсичными веществами. Опасно как вдыхание их паров,
так и контакт с кожей. Амины, например анилин, способны всасываться сквозь кожу в кровь и нарушать функции гемоглобина, что может привести к летальному исходу. Симптомами отравления крови амином являются посинение кончиков пальцев, носа, губ, одышка, учащенное дыхание и сердцебиение, потеря сознания. В случае попадания амина на незащищенные участки кожи необходимо быстро и аккуратно, не увеличивая площадь поражения, очистить пораженный участок кожи ваткой, смоченной в спирте, вывести пострадавшего на свежий воздух, обратиться к врачу.