- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Урок по теме: Аминокислоты
Содержание
- 1. Урок по теме: Аминокислоты
- 2. ОпределениеАминокислоты - это органические вещества, содержащие две
- 3. Общая формулаСтруктура α-аминокислоты с аминогруппой слева и карбоксильной группой справа
- 4. Изомерия и номенклатураВ зависимости от взаимного расположения
- 5. γ β
- 6. Наибольшее значение имеют α-аминокислоты, поскольку только они
- 7. СООН
- 8. КлассификацияприродныесинтетическиеПо способности человека синтезировать их из предшественников:Незаменимые:
- 9. Физические свойстваБесцветные кристаллические вещества, плавящиеся с разложением
- 10. Химические свойства Как кислоты, они взаимодействуют
- 11. Полипептидные связи
- 12. Белки и их структурыСуществует великое множество белков.
- 13. ДенатурацияПри нагревании, под действием сильных кислот, солей
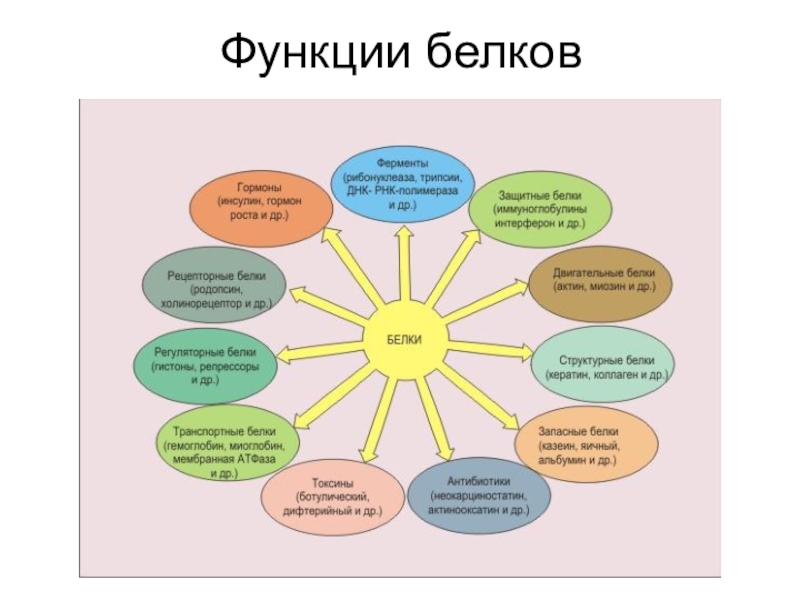
- 14. Функции белков
- 15. Энергетическая ценностьБелки являются необходимой частью нашей пищи.
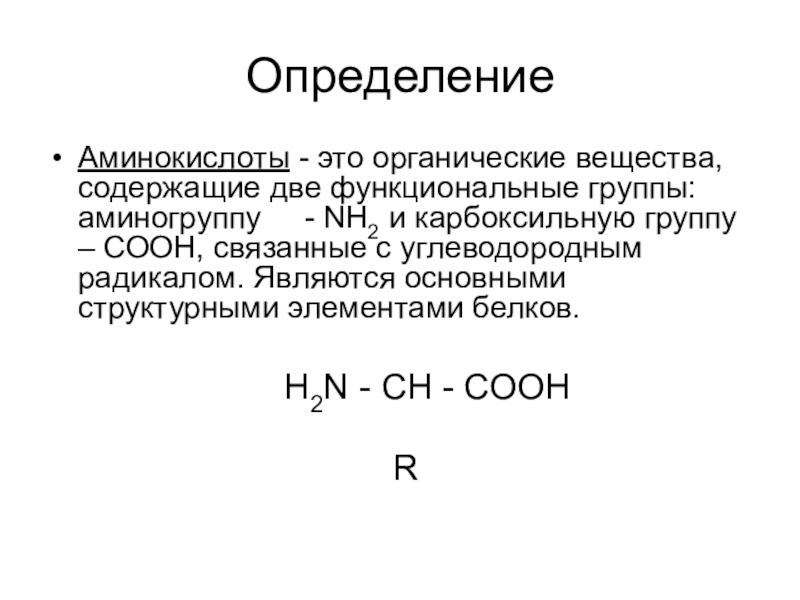
ОпределениеАминокислоты - это органические вещества, содержащие две функциональные группы: аминогруппу - NH2 и карбоксильную группу – СООН, связанные с углеводородным радикалом. Являются основными структурными элементами белков.
Слайд 2Определение
Аминокислоты - это органические вещества, содержащие две функциональные группы: аминогруппу
- NH2 и карбоксильную группу – СООН, связанные с углеводородным радикалом. Являются основными структурными элементами белков.
H2N - CH - COOH
R
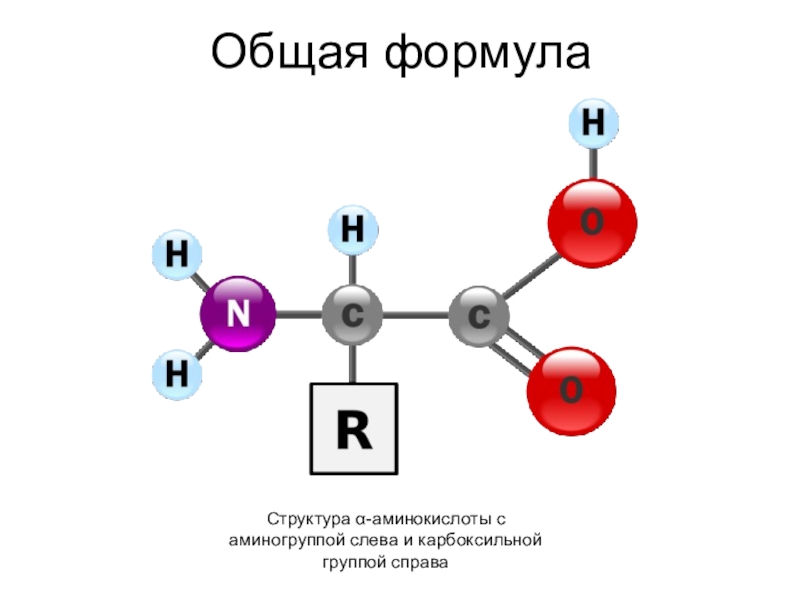
H2N - CH - COOH
R
Слайд 4Изомерия и номенклатура
В зависимости от взаимного расположения функциональных групп в углеводородной
цепи различают α-,β-,γ- и т.д. аминокислоты. Обозначение атомов при этом начинают с углерода, ближнего к карбоксильной группе. За основу названия берется название соответствующей карбоновой кислоты.
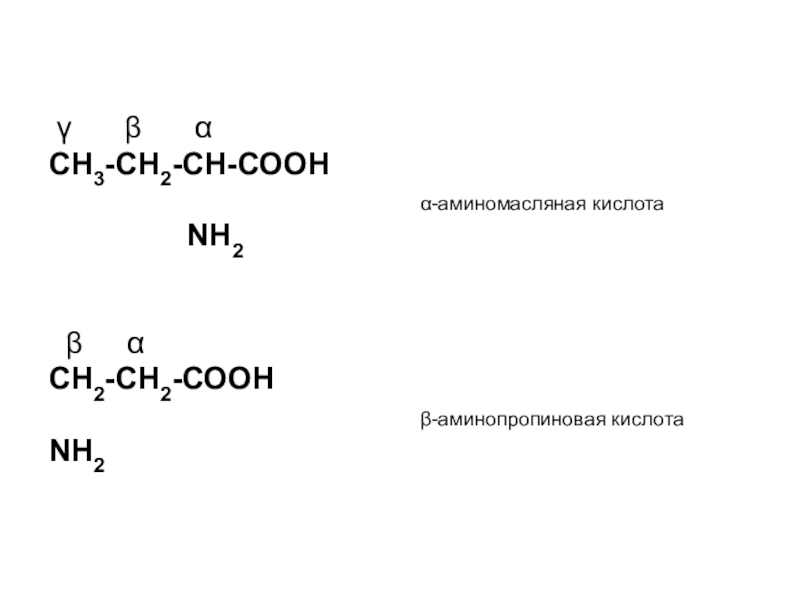
Слайд 5 γ β α
СН3-СН2-СН-СООН
α-аминомасляная кислота
NН2
β α
СН2-СН2-СООН
β-аминопропиновая кислота
NН2
NН2
β α
СН2-СН2-СООН
β-аминопропиновая кислота
NН2
Слайд 6Наибольшее значение имеют α-аминокислоты, поскольку только они встречаются в живой природе
и служат исходными веществами для синтеза белков в живых организмах.
У всех α-аминокислот, кроме аминоуксусной кислоты или глицина, α-углеродный атом имеет четыре различных заместителя, т.е. является симметрическим или хиральным. Для аминокислоты возможно существование двух оптических изомеров.
У всех α-аминокислот, кроме аминоуксусной кислоты или глицина, α-углеродный атом имеет четыре различных заместителя, т.е. является симметрическим или хиральным. Для аминокислоты возможно существование двух оптических изомеров.
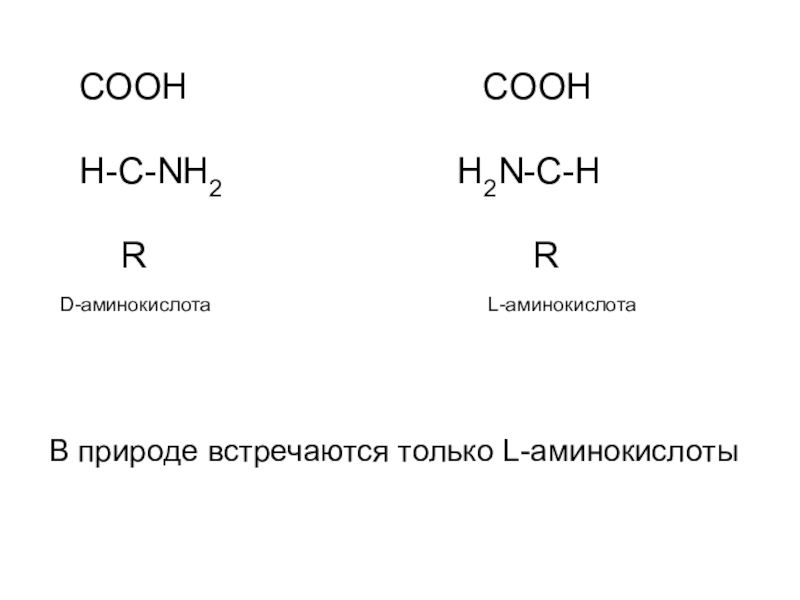
Слайд 7 СООН
CООН
Н-С-NН2 H2N-С-Н
R R
D-аминокислота L-аминокислота
В природе встречаются только L-аминокислоты
Н-С-NН2 H2N-С-Н
R R
D-аминокислота L-аминокислота
В природе встречаются только L-аминокислоты
Слайд 8Классификация
природные
синтетические
По способности человека синтезировать их из предшественников:
Незаменимые: Триптофан, Фенилаланин, Лизин, Треонин,
Метионин, Лейцин, Изолейцин, Валин;
Заменимые: Тирозин, Цистеин, Гистидин, Аргинин, Глицин, Аланин, Серин, Глутамат, Глутамин, Аспартат, Аспарагин, Пролин.
Заменимые: Тирозин, Цистеин, Гистидин, Аргинин, Глицин, Аланин, Серин, Глутамат, Глутамин, Аспартат, Аспарагин, Пролин.
Слайд 9Физические свойства
Бесцветные кристаллические вещества, плавящиеся с разложением при температуре выше 200о
С. Они растворимы в воде и в зависимости от состава радикала могут быть сладкими, горькими или безвкусными.
Слайд 10Химические свойства
Как кислоты, они взаимодействуют с основаниями:
H2N-CH-COOH + NaOH ? H2N-CH-COONA + H2O
| |
R R
Как карбоновые кислоты, взаимодействуют со спиртами:
H2N-CH-COOH + HOR’ ? H2N-CH-COOR’ + H2O
| |
R R
Как основания, реагируют с кислотами
Также могут вступать в реакцию поликонденсации друг с другом.
| |
R R
Как карбоновые кислоты, взаимодействуют со спиртами:
H2N-CH-COOH + HOR’ ? H2N-CH-COOR’ + H2O
| |
R R
Как основания, реагируют с кислотами
Также могут вступать в реакцию поликонденсации друг с другом.
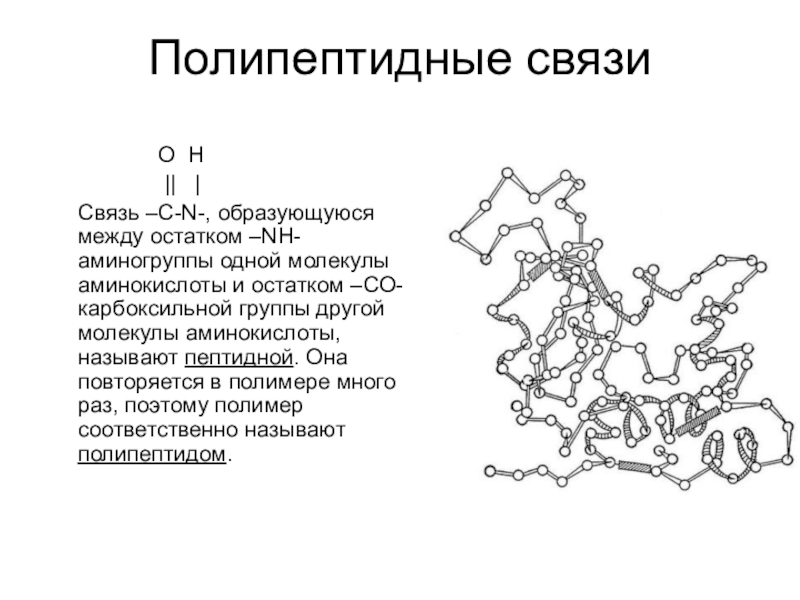
Слайд 11Полипептидные связи
O
H
|| |
Связь –C-N-, образующуюся между остатком –NH- аминогруппы одной молекулы аминокислоты и остатком –CO- карбоксильной группы другой молекулы аминокислоты, называют пептидной. Она повторяется в полимере много раз, поэтому полимер соответственно называют полипептидом.
|| |
Связь –C-N-, образующуюся между остатком –NH- аминогруппы одной молекулы аминокислоты и остатком –CO- карбоксильной группы другой молекулы аминокислоты, называют пептидной. Она повторяется в полимере много раз, поэтому полимер соответственно называют полипептидом.
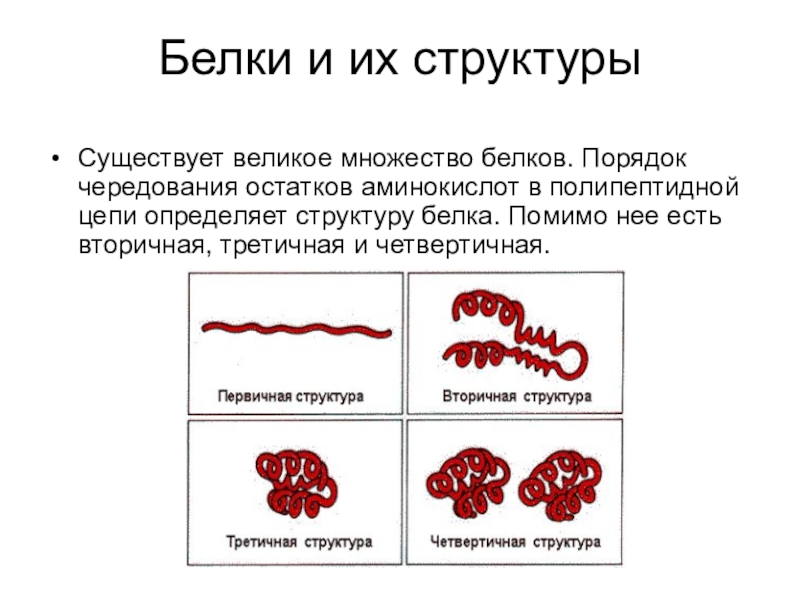
Слайд 12Белки и их структуры
Существует великое множество белков. Порядок чередования остатков аминокислот
в полипептидной цепи определяет структуру белка. Помимо нее есть вторичная, третичная и четвертичная.
Слайд 13Денатурация
При нагревании, под действием сильных кислот, солей тяжелых металлов и некоторых
других реагентов происходит свертывание белков – денатурация. При этом изменения происходят во всех структурах белка кроме первичной. Биологические функции теряются. Большинство белков свертывается при 100о С.
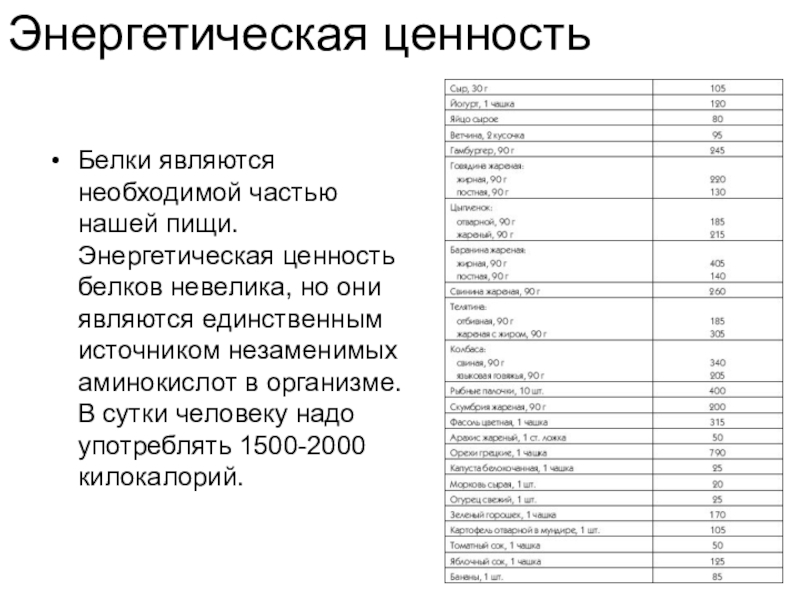
Слайд 15Энергетическая ценность
Белки являются необходимой частью нашей пищи. Энергетическая ценность белков невелика,
но они являются единственным источником незаменимых аминокислот в организме. В сутки человеку надо употреблять 1500-2000 килокалорий.