- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Уро химии на темуХимические свойства солей
Содержание
- 1. Уро химии на темуХимические свойства солей
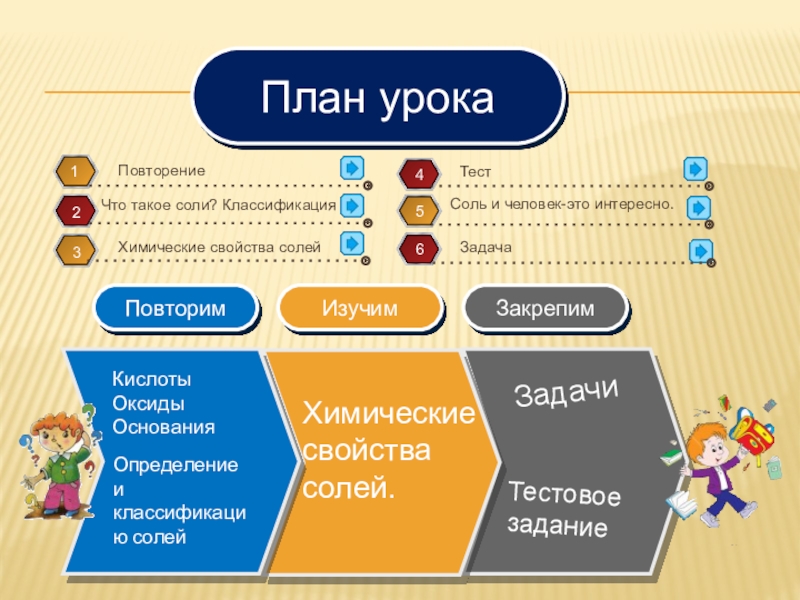
- 2. Кислоты Оксиды ОснованияХимические свойства солей. ЗадачиТестовое заданиеПлан урокаОпределение и классификацию солей
- 3. ЗАДАЧИ:Изучить химические свойства солей;Развивать умения: -
- 4. Проверочный тест1. Ряд, состоящий только из кислотных
- 5. Проверочный тест1. Ряд, состоящий только из кислотных
- 6. Повторим кальция гидроксид
- 7. НАЙТИ ТРЕТИЙ ЛИШНИЙ:a) AlCI3 ,BaO ,CuCI2б) CaSO4 ,Fe(NO3)2 ,H2SO4В) HgS ,FeCI2 ,Zn(OH)2
- 8. Соли – сложные вещества, образованные атомами металлов
- 9. Поиграйте в «крестики-нолики».Покажите выигрышный путь, который составляет формулы солей .Дайте названия этим солям.
- 10. ХИМИЧЕСКИЕ СВОЙСТВАСОЛЕЙ
- 11. 1. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИСОЛЬ + МЕТАЛЛ →
- 12. ЗАДАНИЕДопишите уравнения реакций: Al +
- 13. 2. ВЗАИМОДЕЙСТВИЕ С КИСЛОТАМИсоль₁ + кислота₁
- 14. CaCO ₃ + 2 HCl = CaCl2 + H₂CO₃BaCl2 + H2SO4 = BaSO4 + 2HCl
- 15. Na₂SiO₃ + 2HCI = 2NaCl + H₂SiO₃↓
- 16. ЗАДАНИЕДопишите уравнение реакции: AgNO₃ + HCl → AgCl↓ + HNO₃
- 17. 3. ВЗАИМОДЕЙСТВИЕ С ОСНОВАНИЯМИсоль₁ +основание₁ = соль₂
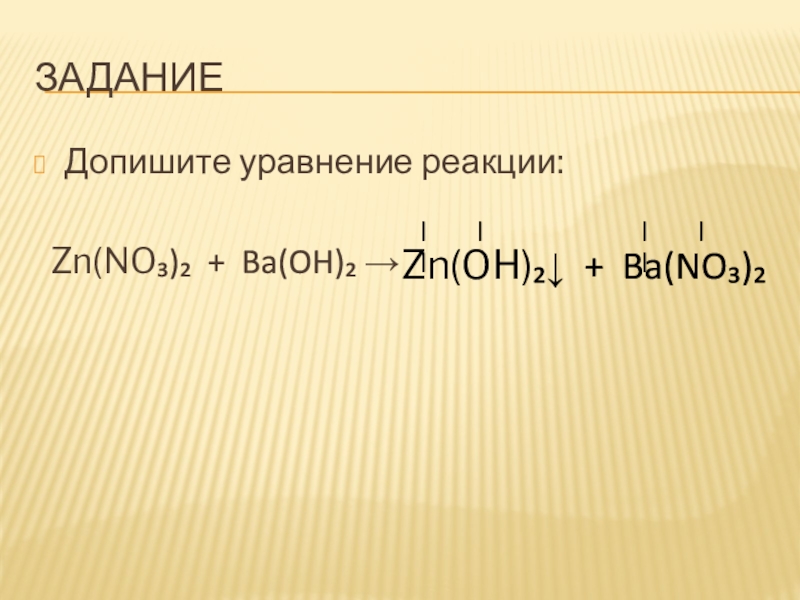
- 18. ЗАДАНИЕДопишите уравнение реакции: Zn(NO₃)₂ + Ba(OH)₂ →Zn(OH)₂↓ + Ba(NO₃)₂IIIIII
- 19. 4. ВЗАИМОДЕЙСТВИЕ С СОЛЯМИсоль₁ +соль₂ =
- 20. ЗАДАНИЕДопишите уравнение реакции:MgCl₂ + Na₂CO₃ → MgCO₃↓ + NaClIIIIII2
- 21. СОЛЬ +МеталлКислотаОснованиеСольНоваяСОЛЬНвый металлНовая кислотаНовое основаниеНовая соль+
- 22. Т Е С Т1. Карбонат калия -
- 23. Т Е С Т4. С каким металлом
- 24. Задача
- 25. Дано:
- 26. ИНТЕРЕСНОЕ О СОЛЯХ В НАШЕМ ОРГАНИЗМЕ1. Недостаток
- 27. 3. Йодированная соль противопоказана:а) детям;б) противопоказаний нет;в)
- 28. 6. К каким последствиям может привести чрезмерное
- 29. ДОМАШНЕЕ ЗАДАНИЕ§ 14 Задание 127,128 ,129.Подготовить сообщение на тему «Соли в природе. Их значение».
Слайд 1
«ХИМИК ДОЛЖЕН ВО ВСЁМ СОМНЕВАТЬСЯ, ПОКА НЕ УБЕДИТСЯ
Слайд 2Кислоты Оксиды Основания
Химические свойства солей.
Задачи
Тестовое задание
План урока
Определение и классификацию солей
Слайд 3ЗАДАЧИ:
Изучить химические свойства солей;
Развивать умения:
- сравнивать вещества;
- умение наблюдать и делать выводы;
- подготовка к внешнему независимому оцениванию.
Слайд 4Проверочный тест
1. Ряд, состоящий только из кислотных оксидов
а) SO3,
2. Ряд, состоящий из только из одноосновных кислот
а) HF, H2CO3, H3PO4, б) H2SiO3, HBr, H2S, в) HCl, HNO3, HI?
3. Изменит цвет индикатора
а) RbOH, б) Zn(OH)2 в) Cu(OH)2?
4. Ряд, состоящий из растворимых оснований
а) LiOH, Ba(OH)2, б) Fe(OH)3, Mg(OH)2, в) Al(OH)3, RbOH?
5. Самая сильная из предложенных кислот
а) H2SiO3, б) HNO3, в) H2S?
Слайд 5Проверочный тест
1. Ряд, состоящий только из кислотных оксидов
а)
2. Ряд, состоящий из только из одноосновных кислот
в) HCl, HNO3, HI
3. Изменит цвет индикатора
а) RbOH
4. Ряд, состоящий из растворимых оснований
а) LiOH, Ba(OH)2
5. Самая сильная из предложенных кислот
б) HNO3
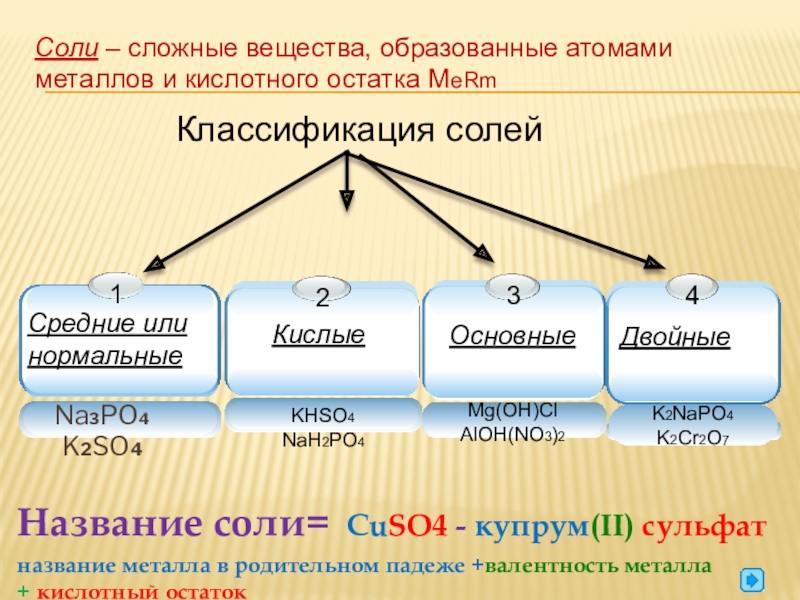
Слайд 8Соли – сложные вещества, образованные атомами металлов и кислотного остатка MeRm
Классификация
Na3PO4
K2SO4
Название соли= CuSO4 - купрум(II) cульфат
название металла в родительном падеже +валентность металла
+ кислотный остаток
Слайд 9Поиграйте в «крестики-нолики».Покажите выигрышный путь, который составляет формулы солей .Дайте названия
Слайд 111. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ
СОЛЬ + МЕТАЛЛ → новая СОЛЬ(растворимая) + Металл↓
каждый предыдущий металл вытесняет менее активный металл из раствора соли
Fe + CuSO₄ = FeSO₄ + Cu↓
для таких реакций не рекомендуется использовать щелочные
металлы (Li, Na, K ), так как они взаимодействуют с водой.
II
II
Слайд 12ЗАДАНИЕ
Допишите уравнения реакций:
Al + FeSO₄ →
III
II
Fe + Al₂(SO₄)₃
2
3
3
Cu + MgCl₂ →
реакции нет (медь стоит после магния
в ряду активности металлов)
Слайд 13 2. ВЗАИМОДЕЙСТВИЕ С КИСЛОТАМИ
соль₁ + кислота₁ → соль₂ + кислота₂
(сильная
Ряд активности кислот
H₂SO₄ , HNO₃, H₃PO₄, H₂SO₃, H₂CO₃, H₂S, H₂SiO₃
HCl
каждая предыдущая кислота вытесняет последующую
из раствора ее соли
условия взаимодействия с кислотами - если образуется осадок или выделяется газ.
Слайд 173. ВЗАИМОДЕЙСТВИЕ С ОСНОВАНИЯМИ
соль₁ +основание₁ = соль₂ +основание₂↓
CuSO₄ + 2NaOH =
(р) (щелочь) (н)
II
I
I
II
Слайд 194. ВЗАИМОДЕЙСТВИЕ С СОЛЯМИ
соль₁ +соль₂ = новая соль₁↓ + новая
BaCl₂ + Na₂SO₄ = BaSO₄↓ + 2NaCl
II
II
I
I
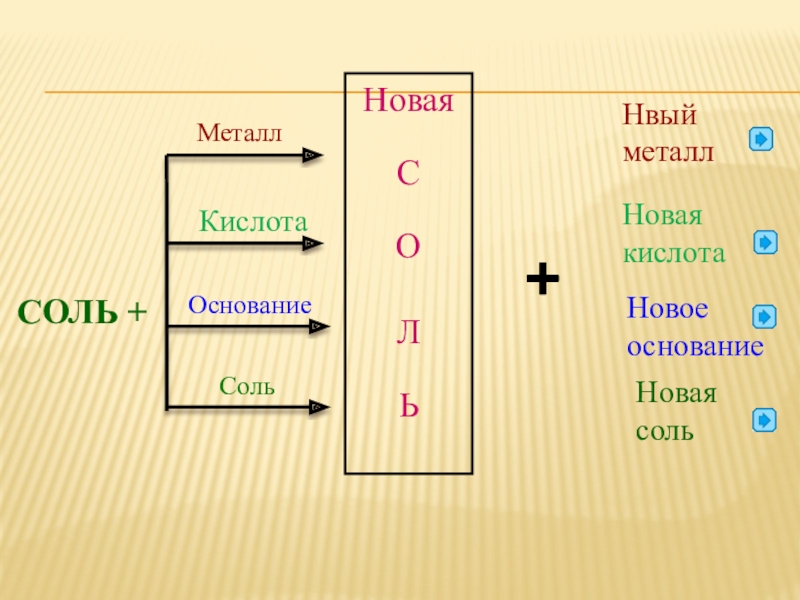
Слайд 21 СОЛЬ +
Металл
Кислота
Основание
Соль
Новая
С
О
Л
Ь
Нвый металл
Новая кислота
Новое основание
Новая соль
+
Слайд 22Т Е С Т
1. Карбонат калия - K₂CO₃ реагирует c :
в) магнием - Mg г) водородом - H₂
2. Сульфат меди (II) - CuSO₄ реагирует с :
а) хлоридом бария - BaCl₂ б) медью - Cu
в) оксидом фосфора (V) - P₂O₅ г) углеродом - C
3. Раствор хлорида железа (III) реагирует с :
а) основанием натрия - NaOH б) оксидом магния - MgO
в) серебром - Ag г) серой - S
б
а
а
Слайд 23Т Е С Т
4. С каким металлом реагирует нитрат меди (II)
а) золотом б) серебром в) железом
5. В цепочке превращений Na₂O → X → NaCl
веществом Х является:
а) Na б) NaOH в) HCl
в
б
Слайд 25 Дано:
n (CuO) = 0,1 моль CuO + 2HNO3 = Cu(NO3)2 + H2O
HNO3 n = 1 моль n = 1 моль
_________________________
m (Cu(NO3)2) - ? n (CuO) = n (Cu(NO3)2 = 0,1 моль
n (Cu(NO3)2) - ?
m = n Х M
M (Cu(NO3)2 = 64 + 2(14 + 3 Х16) = 188 (г/моль)
m (Cu(NO3)2 = 0,1 моль Х 188 г/моль = 18,8 (г)
Ответ: масса нитрата меди (II) равна 18,8 грамм, а его количество вещества – 0,1 моль.
РЕШЕНИЕ ЗАДАЧИ
Слайд 26ИНТЕРЕСНОЕ О СОЛЯХ В НАШЕМ ОРГАНИЗМЕ
1. Недостаток соли вызывает тягу к:
а)
б) сладкому;
в) кислому.
2. Недостаточное потребление соли и ее переизбыток может способствовать возникновению одних и техже заболеваний:
а) гипертонии, инсультов, инфарктов;
б) гриппа и простудных заболеваний;
в) аллергии и болезней кожи.
б
а
Слайд 273. Йодированная соль противопоказана:
а) детям;
б) противопоказаний нет;
в) больным туберкулезом и гипертонией.
4.
а) неограниченно;
б) не более 3–4 месяцев при хранении в закрытой таре;
в) около года, если она влажная.
5. Сколько надо потреблять ежедневно поваренной соли,
чтобы быть здоровым?
а) чайную ложку;
б) столовую ложку;
в) сколько хочешь.
в
б
а
Слайд 286. К каким последствиям может привести чрезмерное
употребление
а) гриппу;
б) аллергии;
в) гипертонии, отекам, остеопорозу, болезням почек.
7. Что объединяет продукты: мюсли, хлеб, твердые сыры,
молоко иностранного производства, которые кажутся
несолеными на вкус?
а) отсутствие микроэлементов;
б) отсутствие витаминов;
в) высокое содержание натрия.
8. Сколько соли содержится в теле человека?
а) 1 кг (пачка);
б) 250 г (3–4 солонки);
в) 5 г (чайная ложка).
в
в
б