- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Творческая работа на тему: соли
Содержание
- 1. Творческая работа на тему: соли
- 2. Тема творческой работы: «Соли!»
- 3. Цель работы:1) соли, их классификация и свойства;2)
- 4. Что же такое соли?!Со́ли
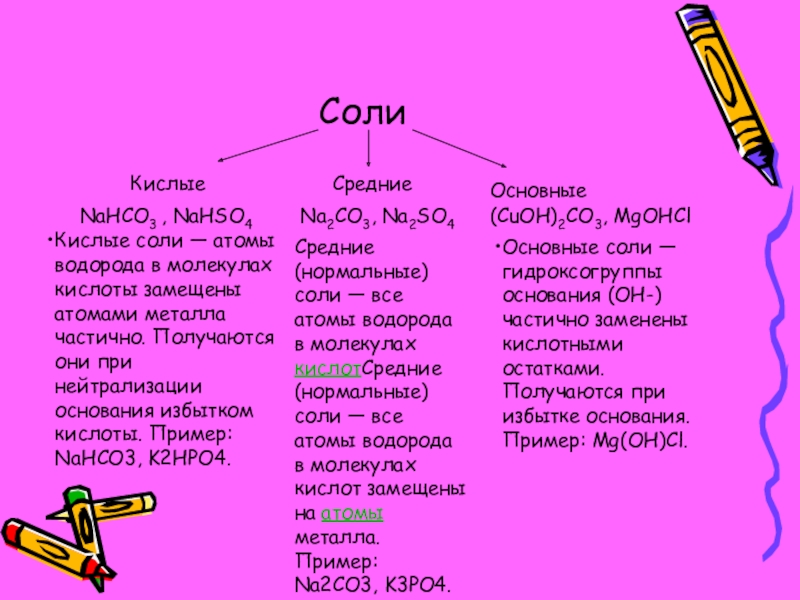
- 5. СолиКислыеСредниеОсновныеNaHCO3 , NaHSO4 Na2CO3, Na2SO4(CuOH)2CO3, MgOHClСредние (нормальные)
- 6. Многие минералыМногие минералы — соли, образующие залежи
- 7. Нахождение в природе
- 8. Методы получения:
- 9. Существуют различные методы получения солей:
- 10. Взаимодействие кислотВзаимодействие кислот с металламиВзаимодействие кислот с
- 11. Взаимодействие кислотных оксидов со щелочами, основными и
- 12. Взаимодействие солей с кислотами, щелочами, металлами, другими
- 13. Взаимодействие металлов с неметаллами. Fe + S
- 14. Химические свойства
- 15. Химические свойства определяются свойствами катионовХимические свойства определяются свойствами катионов и анионов, входящих в их состав.
- 16. Соли взаимодействуют с кислотами и основаниями, если
- 17. Соли взаимодействуют с металлами, если свободный металл
- 18. Соли взаимодействуют между собой, если продукт реакции
- 19. Некоторые соли разлагаются при нагревании: CuCO3 →
- 20. Применение солей
- 21. Соли повсеместно используются как в производстве, так и в повседневной жизни.
- 22. 1. Соли соляной кислоты. Из хлоридов больше
- 23. 2. Соли серной кислоты. В строительстве и
- 24. 3. Соли азотной кислоты. Нитраты больше всего
- 25. 4. Из ортософатов важнейшим является отртофосфат кальция.
- 26. 5. Соли угольной кислоты. Карбонат кальция используют
- 27. Спасибо за внимание!!!
- 28. Список литературы:Справочник школьника Авторы: М.Б.ВоловичР.А.ЛидинУчебник по химии 8 классАвторы: О. С.Габриелян
Тема творческой работы: «Соли!»
Слайд 3
Цель работы:
1) соли, их классификация и свойства;
2) сформировать понятие о солях
как классе электролитов;
3)рассмотреть общие свойства солей в свете ТЭД.
3)рассмотреть общие свойства солей в свете ТЭД.
Слайд 4
Что же такое соли?!
Со́ли — класс химических соединений,
кристаллические вещества, по внешнему виду похожие на обычную поваренную соль.
Слайд 5Соли
Кислые
Средние
Основные
NaHCO3 , NaHSO4
Na2CO3, Na2SO4
(CuOH)2CO3, MgOHCl
Средние (нормальные) соли — все атомы
водорода в молекулах кислотСредние (нормальные) соли — все атомы водорода в молекулах кислот замещены на атомы металла. Пример: Na2CO3, K3PO4.
Кислые соли — атомы водорода в молекулах кислоты замещены атомами металла частично. Получаются они при нейтрализации основания избытком кислоты. Пример: NaHCO3, K2HPO4.
Основные соли — гидроксогруппы основания (OH-) частично заменены кислотными остатками. Получаются при избытке основания. Пример: Mg(OH)Cl.
Слайд 6Многие минералыМногие минералы — соли, образующие залежи (например, галитМногие минералы —
соли, образующие залежи (например, галит NaCl, сильвинМногие минералы — соли, образующие залежи (например, галит NaCl, сильвин KCl, флюорит CaF2).
Слайд 10Взаимодействие кислотВзаимодействие кислот с металламиВзаимодействие кислот с металлами, основными и амфотерными
оксидамиВзаимодействие кислот с металлами, основными и амфотерными оксидами и гидроксидами.
H2SO4 + Mg → MgSO4 + H2↑;
H2SO4 + CuO → CuSO4 + H2O;
HCl + Mg(OH)2(изб.) → Mg(OH)Cl + H2O;
NaOH + 2KOH + H3PO4 → K2NaPO4 + 3H2O.
H2SO4 + Mg → MgSO4 + H2↑;
H2SO4 + CuO → CuSO4 + H2O;
HCl + Mg(OH)2(изб.) → Mg(OH)Cl + H2O;
NaOH + 2KOH + H3PO4 → K2NaPO4 + 3H2O.
Слайд 11Взаимодействие кислотных оксидов со щелочами, основными и амфотерными оксидами.
SiO2 +
CaO → CaSiO3;
Ca(OH)2 + CO2 → CaCO3↓ + H2O.
Ca(OH)2 + CO2 → CaCO3↓ + H2O.
Слайд 12Взаимодействие солей с кислотами, щелочами, металлами, другими солями и нелетучими кислотными
оксидами (если образуется выходящий из сферы реакции продукт).
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑;
CuSO4 + Fe → FeSO4 + Cu↓;
CuCl2 + Na2S → 2NaCl + CuS↓;
2Na2CO3 + 2MgCl2 + H2O → [Mg(OH)]2CO3 + CO2↑ + 4NaCl.
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑;
CuSO4 + Fe → FeSO4 + Cu↓;
CuCl2 + Na2S → 2NaCl + CuS↓;
2Na2CO3 + 2MgCl2 + H2O → [Mg(OH)]2CO3 + CO2↑ + 4NaCl.
Слайд 13Взаимодействие металлов с неметаллами.
Fe + S → FeS.
Взаимодействие оснований с
неметаллами.
Ca(OH)2 + Cl2 → Ca(OCl)Cl + H2O.
Ca(OH)2 + Cl2 → Ca(OCl)Cl + H2O.
Слайд 15Химические свойства определяются свойствами катионовХимические свойства определяются свойствами катионов и анионов,
входящих в их состав.
Слайд 16Соли взаимодействуют с кислотами и основаниями, если в результате реакции получается
продукт, который выходит из сферы реакции (осадок, газ, мало диссоциирующие вещества, например, вода):
BaCl2 + H2SO4 → BaSO4↓ + 2HCl;
NaHCO3 + HCl → NaCl + H2O + CO2↑;
Na2SiO3 + 2HCl → 2NaCl + H2SiO3↓.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl;
NaHCO3 + HCl → NaCl + H2O + CO2↑;
Na2SiO3 + 2HCl → 2NaCl + H2SiO3↓.
Слайд 17Соли взаимодействуют с металлами, если свободный металл находится левее металла в
составе соли в ряду напряжений:
Cu + HgCl2 → CuCl2 + Hg.
Cu + HgCl2 → CuCl2 + Hg.
Слайд 18Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции;
в том числе эти реакции могут проходить с изменением степеней окисления атомов реагентов:
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl;
AgNO3 + NaCl → AgCl↓ + NaNO3;
K2Cr2O7 + 3Na2SO3 + 4H2SO4 → Cr2(SO4)3 + 3Na2SO4 + K2SO4 + 4H2O.
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl;
AgNO3 + NaCl → AgCl↓ + NaNO3;
K2Cr2O7 + 3Na2SO3 + 4H2SO4 → Cr2(SO4)3 + 3Na2SO4 + K2SO4 + 4H2O.
Слайд 19Некоторые соли разлагаются при нагревании:
CuCO3 → CuO + CO2↑;
NH4NO3 →
N2O↑ + 2H2O;
NH4NO2 → N2↑ + 2H2O.
NH4NO2 → N2↑ + 2H2O.
Слайд 221. Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия
и хлорид калия.
Хлорид натрия (поваренную соль) выделяют из озерной и морской воды, а также добывают в соляных шахтах. Поваренную соль используют в пищу. В промышленности хлорид натрия служит сырьём для получения хлора, гидроксида натрия и сода.
Хлорид калия используют в сельском хозяйстве как калийное удобрение
Слайд 232. Соли серной кислоты. В строительстве и в медицине широко используют
жжёный гипс. Будучи смешан с водой, он быстро застывает, образуя дигидрат сульфата кальция, т.е. гипс.
Декагидрат сульфата натрия используют в качестве сырья для получения соды.
Слайд 243. Соли азотной кислоты. Нитраты больше всего используют в качестве удобрений
в сельском хозяйстве. Важнейшим из них является нитрат натрия, нитрат калия, нитрат кальция и нитрат аммория. Обычно эти соли называют селитрами.
Слайд 254. Из ортософатов важнейшим является отртофосфат кальция. Эта соль служит основной
составной частью минералов - фосфоритов и апатитов. Форсфориты и апатиты используются в качестве сырья в производстве фосфорных удобрений, например, суперфосфата и преципитата.
Слайд 265. Соли угольной кислоты. Карбонат кальция используют в качестве сырья для
получения извести.
Карбонат натрия (соду) применяют в производстве стекла и при варке мыла.
Карбонат кальция в природе встречается и в виде известняка, мела и мрамора.