- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Творческая работа на тему: Оксиды
Содержание
- 1. Творческая работа на тему: Оксиды
- 2. Цель работы:Изучить строение оксидов в свете теории
- 3. ОксидыОксиды — это сложные вещества, в составе
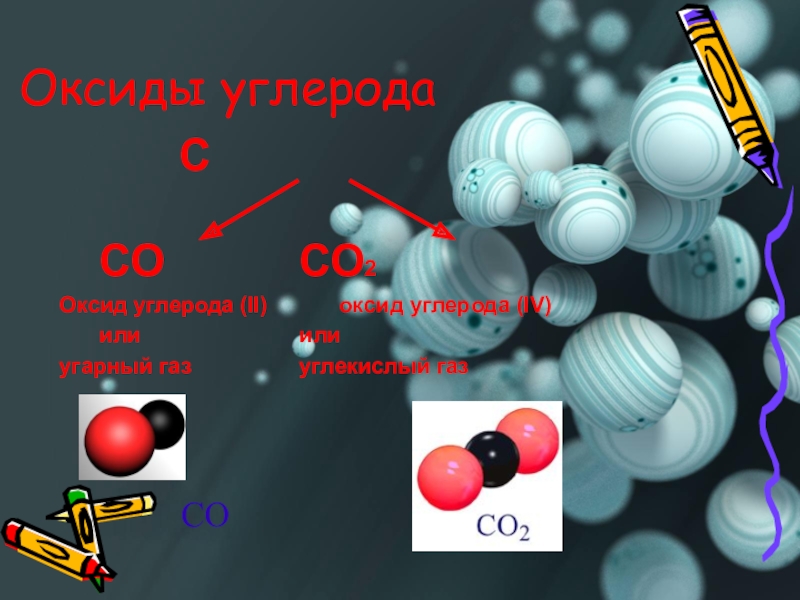
- 4. Оксиды углерода С СО СО2 Оксид углерода (II) оксид углерода (IV) или или угарный газ углекислый газСО
- 5. Оксид углерода (II)иначе угарный газ — бесцветный,
- 6. Оксид углерода (IV)или углекислый газ– газ без
- 7. Слайд 7
- 8. «Оксиды, их классификация и свойства».
- 9. Агрегатное состояниеЖидкое (вода)Твердое (песок, оксиды металлов)Газообразное (оксиды углерода)
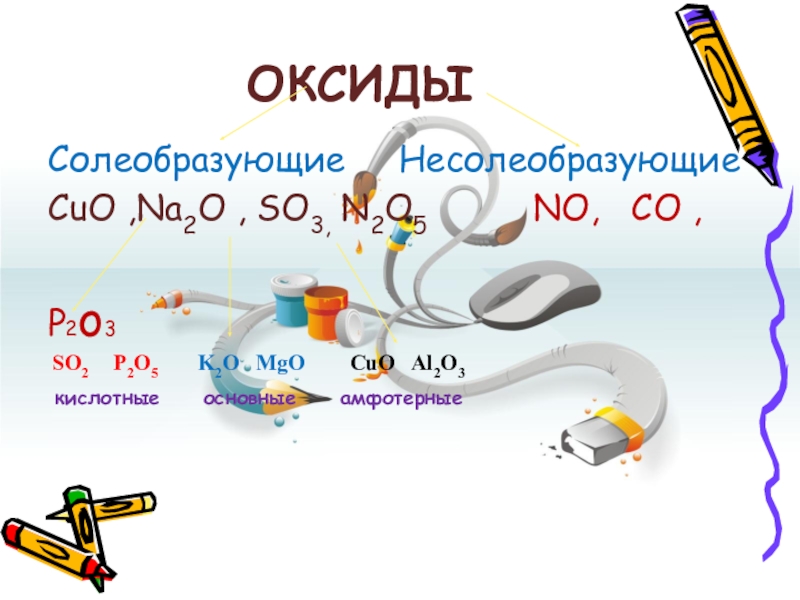
- 10. ОКСИДЫСолеобразующие НесолеобразующиеCuO ,Na2O , SO3,
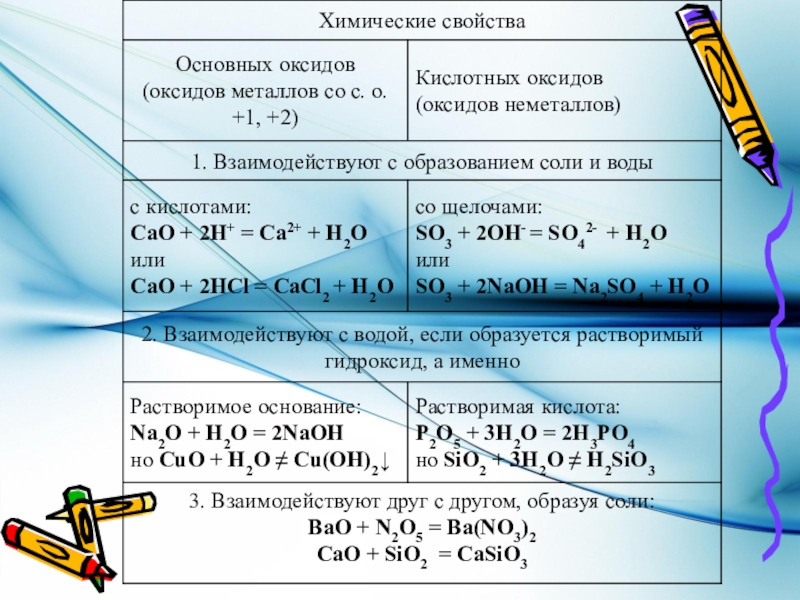
- 11. Типичные реакции основных оксидов1. Основный оксид +
- 12. Кислоты соответствуют
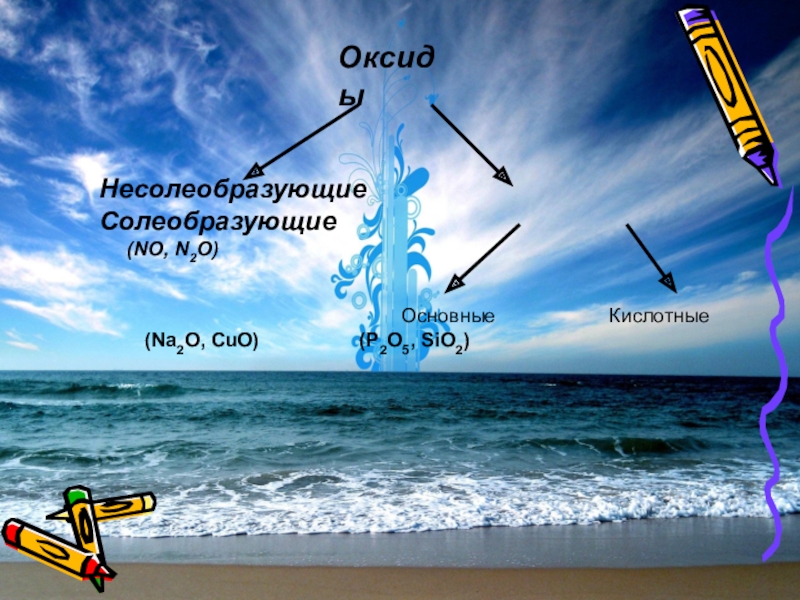
- 13. Оксиды Несолеобразующие
- 14. Слайд 14
- 15. 1. Применяют для сварки и резки материалов
- 16. Важнейшие оксиды В природе и жизни человека
- 17. Твердые оксиды Оксиды – широко распространенный в природе класс неорганических веществ
- 18. SiO2 Оксид кремния (IV)Кварцевый песокРечной песокКремнезем
- 19. SiO2 Оксид кремния (IV)Очень чистый кристаллический SiO2 известен в виде минералов горного хрусталя
- 20. FeO и Fe2O3 оксиды железа (II) и (III)Красный железнякБурый железнякМагнитный железняк
- 21. Газообразные оксидыВходят в состав атмосферы: углекислый газ
- 22. Оксид кальция СаОБелое тугоплавкое вещество, «гасится водой»,
Слайд 2Цель работы:
Изучить строение оксидов в свете теории электролитической диссоциации.
Обобщить сведения об
Рассмотреть свойства кислотных и основных оксидов.
Слайд 3Оксиды
Оксиды — это сложные вещества, в составе которых два
Оксиды железа входят в состав красного, бурого и магнитного железняка, из которых получают железо и его сплавы — сталь, чугун.
Оксид кальция — негашеная известь. Из негашеной извести получают гашеную (известь Са(ОН)2), которую широко применяют в строительстве.
Оксид кремния — это кварц, горный хрусталь, песок кварцевый, речной и морской, входит в состав окрашенных в разнообразные цвета минералов и поделочных камней — аметисты, топазы, агаты, опалы, яшмы.
Оксид углерода — углекислый газ содержится в выдыхаемом нами воздухе, в выбросах автомобильных двигателей, заводов, ...
Слайд 4Оксиды углерода
С
СО СО2
Оксид углерода (II) оксид углерода (IV)
или или
угарный газ углекислый газ
СО
Слайд 5Оксид углерода (II)
иначе угарный газ — бесцветный, не имеющий запаха, плохо
Молекулы СО очень прочны, поскольку связь между атомами углерода и кислорода в них тройная.
Для оксида углерода (II) характерны восстановительные свойства. Например, он восстанавливает металлы из оксидов:
CuO + CO = Cu + CO2
На воздухе угарный газ горит:
2CO + O2 = 2CO2
Слайд 6Оксид углерода (IV)
или углекислый газ
– газ без цвета и запаха. Это
Растворение оксида углерода (IV) — обратимый процесс:
H2O + CO2 ↔ H2CO3
Для углекислого газа не характерны ни окислительные, ни восстановительные свойства, хотя некоторые наиболее активные металлы горят в оксиде:
CO2 + 2Mg = 2MgO + С
Слайд 9Агрегатное состояние
Жидкое (вода)
Твердое (песок, оксиды металлов)
Газообразное (оксиды углерода)
Слайд 10ОКСИДЫ
Солеобразующие Несолеобразующие
CuO ,Na2O , SO3, N2O5
P2o3
SO2 P2O5 K2O MgO CuO Al2O3
кислотные основные амфотерные
Слайд 11Типичные реакции основных оксидов
1. Основный оксид + кислота
K2O + H2SO4 K2SO4 + H2O
K2O + 2H+ + SO42- 2K+ + SO42- + H2O
K2O + 2H+ 2K+ + H2O
Слайд 12
Кислоты соответствуют Кислотные
Щелочи соответствуют Основные оксиды
Состав и классификация оксидов
Слайд 151. Применяют для сварки и резки материалов O2
2. В
3. Газ, имеющий запах -
4. Малорастворим в воде O2
5. Разлагается при нагревании -
6. Поддерживает горение O2
7. При t=-183 0С превращается в жидкость O2
8. Получают из природного газа -
9. Легче воздуха -
10. Входит в состав минералов, горных пород O2
Оксиды...
Слайд 19SiO2
Оксид кремния (IV)
Очень чистый кристаллический SiO2
известен в виде
Слайд 21Газообразные оксиды
Входят в состав атмосферы:
углекислый газ CO2
угарный газ СО
-оксиды азота NO, NO2 , N2 O
-оксиды серы SO2 , SO3 и другие
Слайд 22Оксид кальция СаО
Белое тугоплавкое вещество, «гасится водой», образуя гашеную известь
Получают из
Применяется в строительстве для получения вяжущих материалов