- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Тема урока: Угольная кислота и ее соли
Содержание
- 1. Тема урока: Угольная кислота и ее соли
- 2. Угольная кислота и её солиЦель: формирование
- 3. «Я… понимаю, что это обыкновенные камни, причудливо
- 4. Хотя я - соль, но под водой
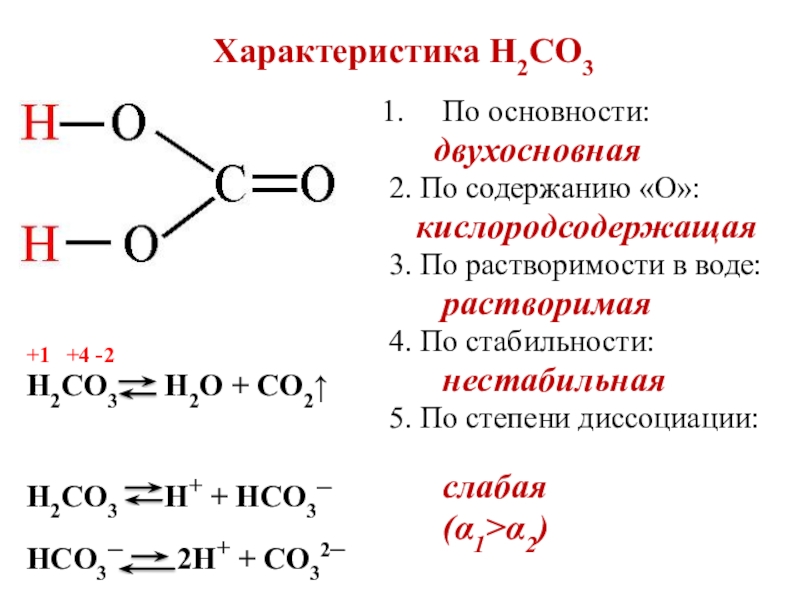
- 5. Характеристика H2СO3По основности: двухосновная2.
- 6. Слайд 6
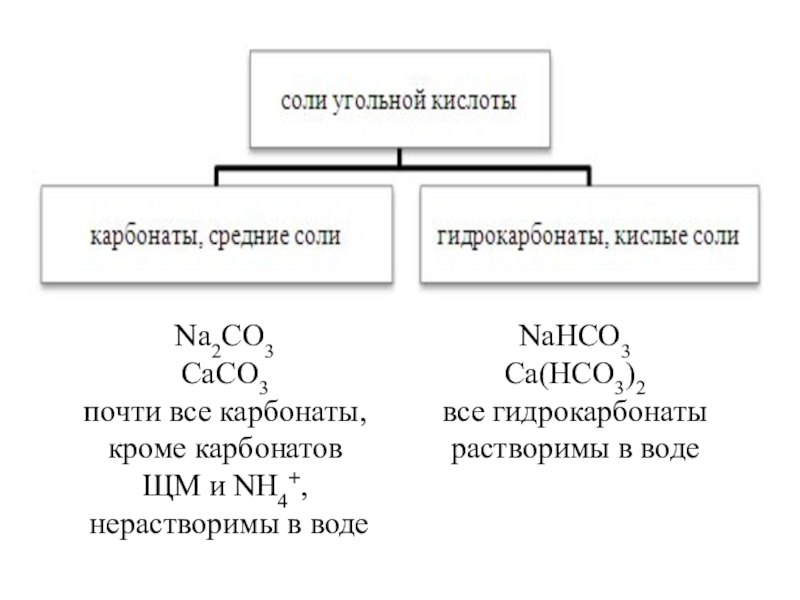
- 7. Взаимопревращения карбонатов и гидрокарбонатов= Ca(HCO3)2-
- 8. Просачиваясь в пещеру сверху, вода понемногу капает,
- 9. Взаимопревращения карбонатов и гидрокарбонатов Стекая со стен
- 10. Качественная реакция на карбонат - ионNa2CO3 + HCl =2 2
- 11. Понятие о жёсткости воды временная
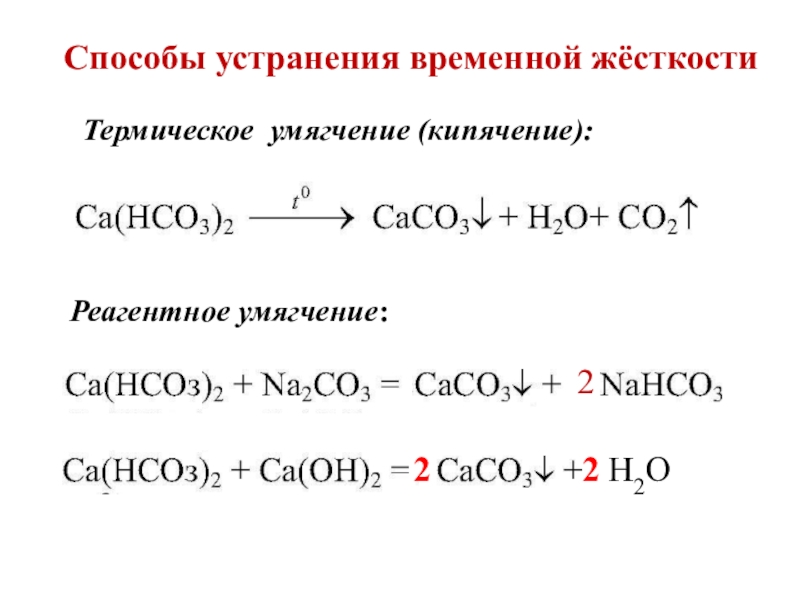
- 12. Способы устранения временной жёсткостиРеагентное умягчение:2Термическое умягчение (кипячение):2Н2О2
- 13. Способы устранения постоянной жёсткостиРеагентное умягчение (добавление соды):CaCl2
- 14. Слайд 14
- 15. Карбонаты в природе
- 16. Карбонаты в природемагнезит MgCO3малахит (CuOH)2CO3 Сидерит FeCO3
- 17. Гидрокарбонаты в природе (лечебно-столовая питьевая вода «Нижне - Ивкинская №2К»)
- 18. Верите ли вы, что…1.Угольная кислота – сильный
- 19. – Почему Н2СО3 образует
- 20. § 29, №7(а) с.138
- 21. Объясните исторический факт с химической точки
- 22. Что же произошло с жемчужиной, и почему Клеопатра смогла выпить «крепкий уксус»?
- 23. Что такое жемчуг?Что объединяет жемчуг с мрамором?
- 24. Жемчуг образуется в раковине моллюска,который реагирует на
- 25. Задание.Запишите уравнение реакции растворения жемчужины в уксусной
Слайд 2Угольная кислота
и её соли
Цель: формирование представлений о строении, свойствах и
Слайд 3«Я… понимаю, что это обыкновенные камни, причудливо обработанные ветром и газированной
- Почему газированной?
- А как прикажете называть эту замёрзшую воду с углекислым газом?»
Б. Штерн. Недостающее звено.
Впервые газированный напиток был получен в 1767г. английским химиком Джозефом Пристли.
Слайд 4Хотя я - соль, но под водой Вас удивлю своей средой. Посуду мыть,
Кто я?
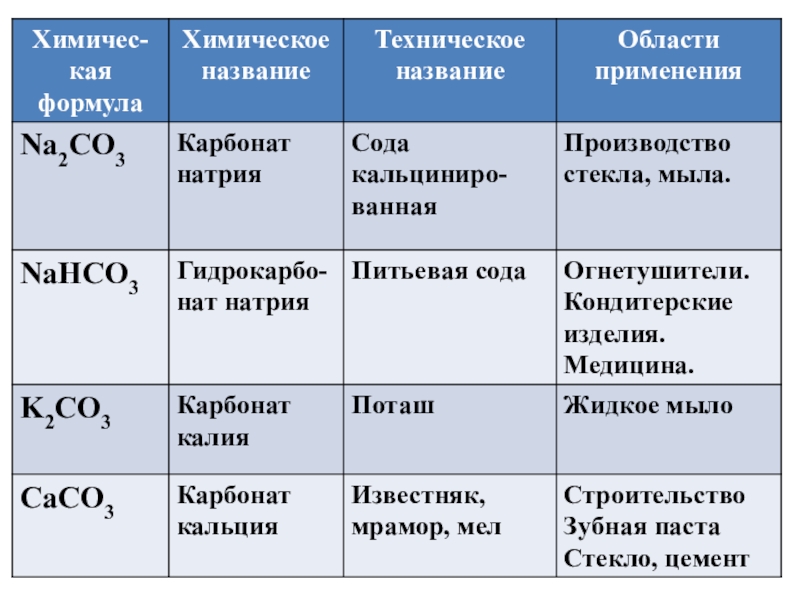
NaHCO3
Na2CO3
Слайд 5Характеристика H2СO3
По основности:
двухосновная
2. По содержанию «О»:
3. По растворимости в воде:
растворимая
4. По стабильности:
нестабильная
5. По степени диссоциации:
слабая
(α1>α2)
+1 +4 -2
Н2СО3 Н+ + НСО3─
НСО3─ 2Н+ + СО32─
Н2СО3 Н2О + СО2↑
Слайд 8Просачиваясь в пещеру сверху, вода понемногу
капает, а растворённые материалы свисают
Так образуются сталактиты.
Взаимопревращения карбонатов и гидрокарбонатов
сталактиты
Дождевая вода, насыщенная
СО2, стекает
по пластам известняка и частично их растворяет.
Так образуются карстовые пещеры.
Слайд 9Взаимопревращения карбонатов и гидрокарбонатов
Стекая со стен пещеры и попадая на
нерастворимого карбоната кальция.
сталагмиты
Слайд 12Способы устранения временной жёсткости
Реагентное умягчение:
2
Термическое умягчение (кипячение):
2
Н2О
2
Слайд 13Способы устранения постоянной жёсткости
Реагентное умягчение (добавление соды):
CaCl2 + Na2CO3 =
CaCO3 ↓
2
Ca2+ + CO3 2- = CaCO3↓
Слайд 18Верите ли вы, что…
1.Угольная кислота – сильный электролит.
2.Угольная кислота образует кислые
3.Карбонат кальция – основа мела, известняка, малахита.
4. Гидрокарбонат кальция обусловливает жёсткость воды, которую можно устранить кипячением.
5. Для распознавания карбонат – ионов используют
взаимодействие с ионами водорода сильных кислот.
Слайд 19 – Почему Н2СО3 образует 2 вида солей? – Как называются эти соли?
Слайд 21Объясните исторический факт
с химической точки зрения
В романе Г.Г. Хаггарда
«… она вынула из уха одну из трёх огромных жемчужин и опустила жемчужину в уксусную кислоту. Наступило молчание. Потрясённые гости, замерев, наблюдали,
как несравненная жемчужина медленно растворяется. Вот от неё не осталось и следа, и тогда Клеопатра подняла кубок, покрутила его, взбалтывая, и выпила всё до последней капли».
Слайд 24Жемчуг образуется
в раковине моллюска,
который реагирует на раздражитель, например песчинку, и
вещество– перламутр,
который обволакивает песчинку и превращает
её в жемчуг.
Перламутр состоит из органического вещества арагонита и карбоната кальция.
Происхождение жемчуга
Слайд 25Задание.
Запишите уравнение реакции растворения жемчужины в уксусной кислоте.
CaCO3 + CH3COOH
Ca(CH3COO)2+ CO2↑+H2O
2
2+ -
ацетат кальция