- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Тема урока: Азот 9 сыныптарға
Содержание
- 1. Тема урока: Азот 9 сыныптарға
- 2. Үй тапсырмасын
- 3. Азоттың қосылыстары. Аммиак.
- 4. Мақсаты: 1) Білімділік. Азоттың оттекті қосылыстарына сипаттама
- 5. . Жоспар.І.Оксидтердің түрлері.2.Құрылымдық формуласы.3.Физикалық қасиеттері.4.Алынуы.5.Химиялық қасиеттері.6.Қолданылуы.7. Аммиак
- 6. Азот оксидтері +1
- 7. NO физикалыққасиеттерітүссіз Қиын сығылады-151,8сығылады-163,7қатаядыСуданашар ериді Ауада тотығады газ
- 8. NO Алынуы:Tабиғатта найзағайTабиғатта найзағай отында мына реакция жүреді:
- 9. NO
- 10. Азот(II)оксидінің химиялық қасиеті:Тотығуы:2NO + O2 = 2NO2N+2
- 11. NO2 физикалыққасиеттеріқоңыр буы улы газ 21,3сұйылады9,3 кристалдықмассаға айналады өткір иістісуда ериді
- 12. NO2
- 13. Химиялық қасиеттері:Суда еруі4NO2 +2H2O + O2 =
- 14. HNO3 + HCl 1:3 патша арағы
- 15. “Бұл иісін бір иіскесең өмір бойы ұмытылмастай
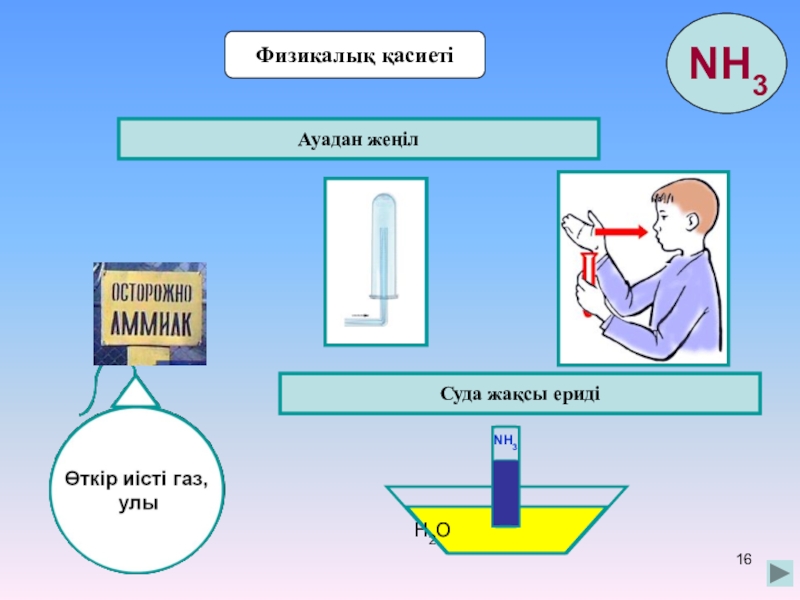
- 16. Физикалық қасиетіАуадан жеңілСуда жақсы еридіH2ONH3
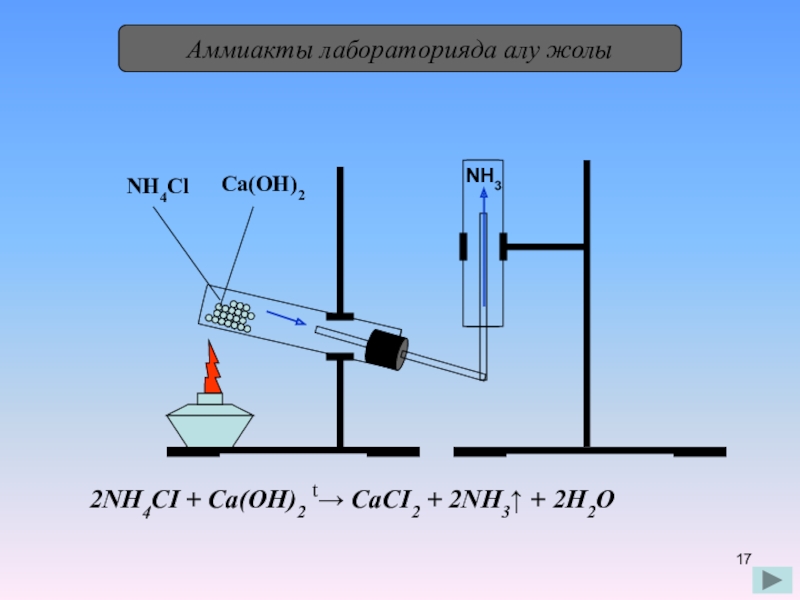
- 17. Аммиакты лабораторияда алу жолыNH4ClCa(OH)2NH32NH4СІ + Са(ОН)2 t→ СаСІ2 + 2NH3↑ + 2Н2О
- 18. Аммиакты өнеркәсіпте алу жолы N2 + H2ТурбокомпрессоркатализаторЖылуалмастырғышсалқындатқышсепаратор NH3
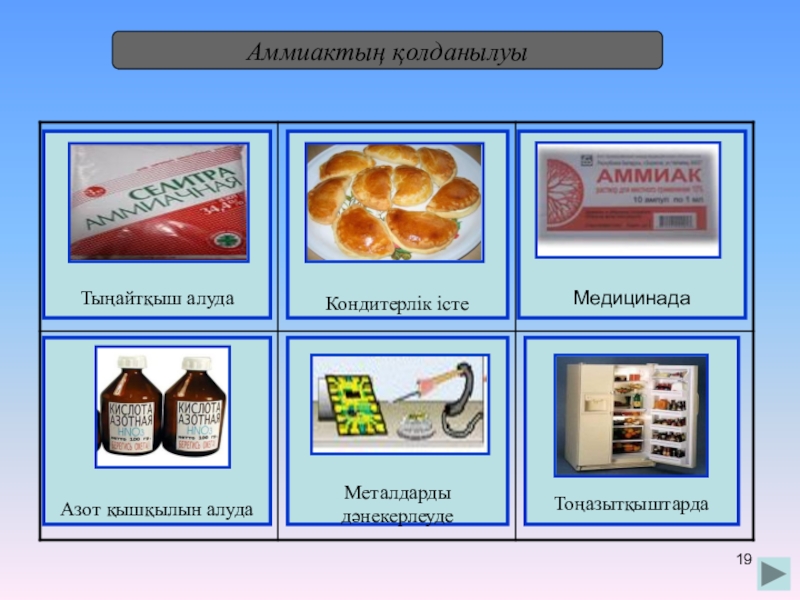
- 19. Аммиактың қолданылуы
- 20. NH3 Азот-Бейметалл пойызы
- 21. Тест жұмысы.Азот атомында қанша s
- 22. Үйге тапсырма§ 17 Табиғаттағы азот айналымы.
Үй тапсырмасын сұрау “Күкірт” тобына: 1. Күкірт қышқылы туралы не білесіздер? 2.Күкірт қышқылының формуласы 3. Күкірт қышқылының қолданылуы. «Азот» тобына: 1. Күкірт қышқылының құрылымдық формуласы 2. Күкірт қышқылының физикалық
Слайд 2 Үй тапсырмасын сұрау “Күкірт” тобына: 1. Күкірт қышқылы туралы не білесіздер? 2.Күкірт қышқылының
формуласы
3. Күкірт қышқылының қолданылуы.
«Азот» тобына:
1. Күкірт қышқылының құрылымдық формуласы
2. Күкірт қышқылының физикалық қасиеті
3.Су мен күкірт қышқылын қалай араластырады
Слайд 4Мақсаты:
1) Білімділік. Азоттың оттекті қосылыстарына сипаттама беру, б
білім негіздерін қалыптастыру. Аммиак
молекуласының электрондық және кеңістіктік
құрлысымен танысу, соған орай аммиакқа тән
қасиеттерін түсініп білу.
2)Дамытушылық: Оқушылардың шығармашылық қабілетінің
шыңдалуына мүмкіндік беру және оны
дамыту.
3) Тәрбиелік: Оқушыларды бірлікке, жолдастыққа, еңбекті
сүюге тәрбиелеу.
Сабақтың көрнекілігі: Интерактивті тақта,
Сабақтың түрі: Аралас сабақ
Сабақтың барысы:
І. Ұйымдастыру бөлімі: амандасу, түгендеу
Слайд 5.
Жоспар.
І.Оксидтердің түрлері.
2.Құрылымдық формуласы.
3.Физикалық қасиеттері.
4.Алынуы.
5.Химиялық қасиеттері.
6.Қолданылуы.
7. Аммиак
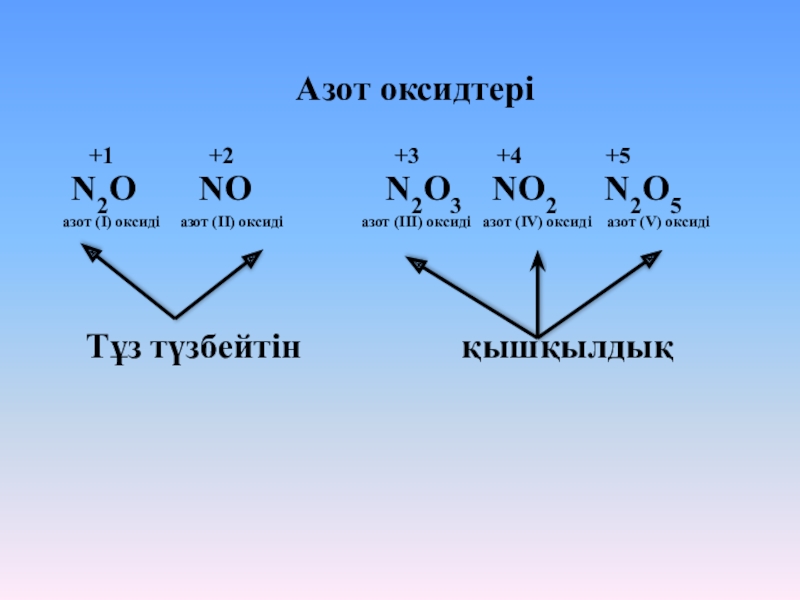
Слайд 6Азот оксидтері
+1
+2 +3 +4 +5
N2O NO N2O3 NO2 N2O5
азот (І) оксиді азот (ІІ) оксиді азот (ІІІ) оксиді азот (ІV) оксиді азот (V) оксиді
Тұз түзбейтін қышқылдық
N2O NO N2O3 NO2 N2O5
азот (І) оксиді азот (ІІ) оксиді азот (ІІІ) оксиді азот (ІV) оксиді азот (V) оксиді
Тұз түзбейтін қышқылдық
Слайд 7
NO
физикалық
қасиеттері
түссіз
Қиын
сығылады
-151,8
сығылады
-163,7
қатаяды
Суда
нашар
ериді
Ауада
тотығады
газ
Слайд 9NO Азот (ІІ) оксиді
Алыну жолдары:
1. Табиғатта, найзағай ойнағанда
t
N2 + O2 = 2NO↑ – Q
2.Өндірісте кt
4NH3 + 5O2 = 4NO↑ + 6H2O
3. Лабораторияда
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
(сұйытылған)
t
N2 + O2 = 2NO↑ – Q
2.Өндірісте кt
4NH3 + 5O2 = 4NO↑ + 6H2O
3. Лабораторияда
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
(сұйытылған)
Слайд 10Азот(II)оксидінің химиялық қасиеті:
Тотығуы:
2NO + O2 = 2NO2
N+2 -2e → N+4
2 тотықсыздандырғыш
4
O20 +4e →2O-2 1 тотықтырғыш
4
O20 +4e →2O-2 1 тотықтырғыш
Слайд 11
NO2
физикалық
қасиеттері
қоңыр
буы
улы
газ
21,3
сұйылады
9,3 кристалдық
массаға
айналады
өткір
иісті
суда
ериді
Слайд 12NO2 Азот
(IV) оксиді
Физикалық қасиеті: қоңыр түсті, өткір иісті, улы газ, суда ериді
Tқайнау = 21°C,
Тбалқу= -11,2°C.
Алыну жолдары:
1) 2NO + O2 = NO2
2) Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
(конц.) .
Физикалық қасиеті: қоңыр түсті, өткір иісті, улы газ, суда ериді
Tқайнау = 21°C,
Тбалқу= -11,2°C.
Алыну жолдары:
1) 2NO + O2 = NO2
2) Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
(конц.) .
t
Слайд 13Химиялық қасиеттері:
Суда еруі
4NO2 +2H2O + O2 = 4HNO3 + Q
N+4 -1e
→N+5 4
4
O20 +4e →2O -2 1
немесе 2NO2 +H2O = HNO3 + HNO2
азот қыш. азотты қыш.
4
O20 +4e →2O -2 1
немесе 2NO2 +H2O = HNO3 + HNO2
азот қыш. азотты қыш.
Слайд 14HNO3 + HCl 1:3 патша арағы деп аталады. Барлық нәрселерді
Аu және pt-ны да ерітеді. Күшті тотықтырушы қасиетке ие.
Аu + HNO3 +3HCl =AuCl3 +NO +2H2O
Аu + HNO3 +3HCl =AuCl3 +NO +2H2O
Слайд 15“Бұл иісін бір иіскесең өмір бойы ұмытылмастай есіңде қалатын газ. Құтыны
ашсаң болды өткір иісі бірден бөлменің ішін алып кетеді. Оның атауы мүсәтірдің ескі атауы “sal ammoniac” сөзінен шыққан. Оны Амон құдайына табынатын жерге жақын Ливиядан өндірген.”
NH3
NH3
Слайд 18Аммиакты өнеркәсіпте алу жолы
N2 + H2
Турбоком
прессор
катализатор
Жылуалмас
тырғыш
салқындатқыш
сепаратор NH3
Слайд 21
Тест жұмысы.
Азот атомында қанша s және p электроны бар?
а) 6s және 9p в) 4s және 3p с) 6s және 10p д) 4s және 4p
2. Нитридтердің құрамында азот неше валентті?
а) 1 в) 4 с) 3 д) 5
3. Азоттың ауадағы көлемдік үлесі қанша?
а) 21% в) 78% с) 75,6% д) 77%
4. Азот 8 электрон қосып алатын сызбанұсқа?
а) N-3 → N+5 в) N+2 → N+5 с) N+5 → N+2 д) N+5 → N-3
5. Азот мына жай заттардың қайсысымен әрекеттеседі?
а)Cl2, Au в) Al, C, P с)F2, Ag, Au д) O2, H2, Mg
6. Азот қайсы қосылыстарында +5 және -3 тотығу дәрежесін көрсетеді?
а) NO2, PH в) NO2, NH3 с) N2O5, NH3 д) N2O5, PH3
7. Азоттың жоғарғы тотығу дәрежесі?
а) +5 в) +3 с) -3 д) 4
2. Нитридтердің құрамында азот неше валентті?
а) 1 в) 4 с) 3 д) 5
3. Азоттың ауадағы көлемдік үлесі қанша?
а) 21% в) 78% с) 75,6% д) 77%
4. Азот 8 электрон қосып алатын сызбанұсқа?
а) N-3 → N+5 в) N+2 → N+5 с) N+5 → N+2 д) N+5 → N-3
5. Азот мына жай заттардың қайсысымен әрекеттеседі?
а)Cl2, Au в) Al, C, P с)F2, Ag, Au д) O2, H2, Mg
6. Азот қайсы қосылыстарында +5 және -3 тотығу дәрежесін көрсетеді?
а) NO2, PH в) NO2, NH3 с) N2O5, NH3 д) N2O5, PH3
7. Азоттың жоғарғы тотығу дәрежесі?
а) +5 в) +3 с) -3 д) 4