- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Строение электронных оболочек атомов
Содержание
- 1. Строение электронных оболочек атомов
- 2. Цели урока.Дать понятие об электронной оболочке атома
- 3. Определите число протонов, электронов и нейтронов для
- 4. Атом состоит из ядра (в нем сосредоточены
- 5. Электроны, которые близки по значениям энергии образуют
- 6. Каждый уровень может вместить в себя определенное
- 7. Энергетические уровни, содержащие максимальное число электронов, называются
- 8. АтомЯдроЭлектронная оболочка1) Р+2) n0Электронные слои илиэнергетические уровнизавершенныенезавершенные
- 9. План (строение электонных оболочек атома).Определить общее число
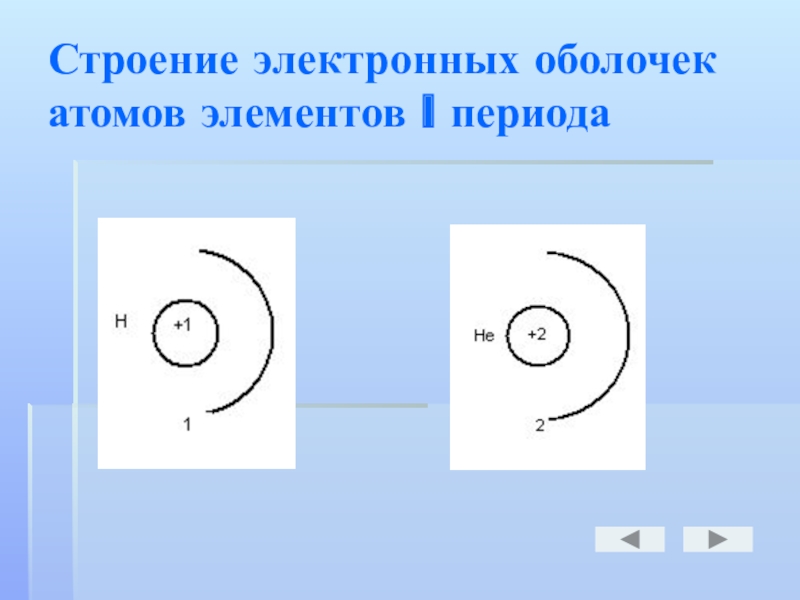
- 10. Строение электронных оболочек атомов элементов l периода
- 11. Строение электронных оболочек атомов элементов ll периода
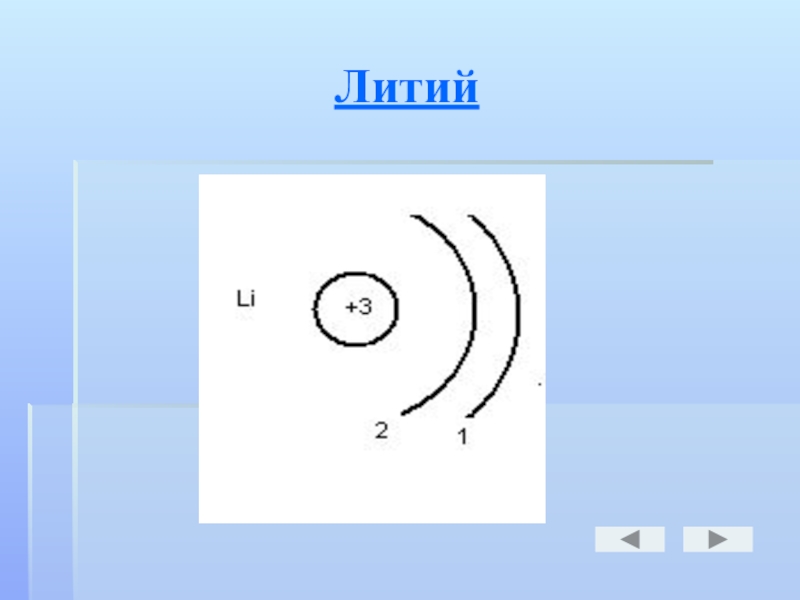
- 12. Литий
- 13. Бериллий
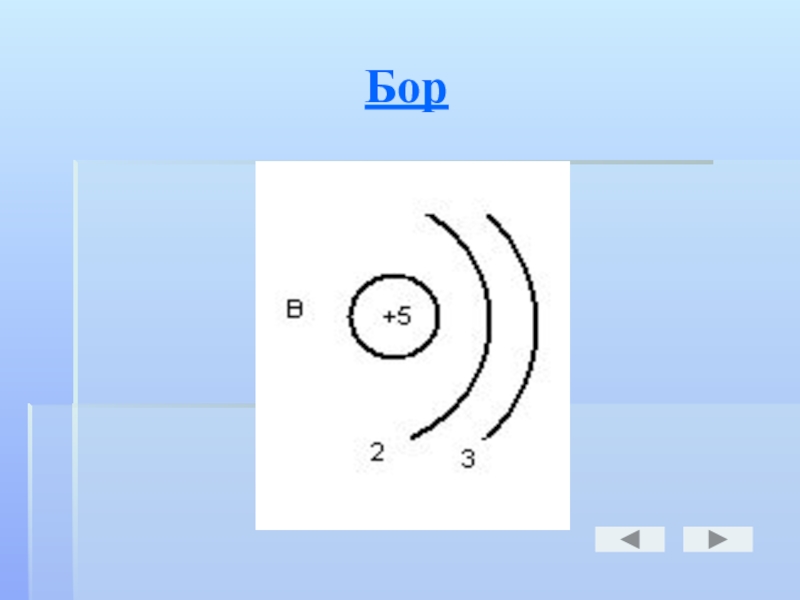
- 14. Бор
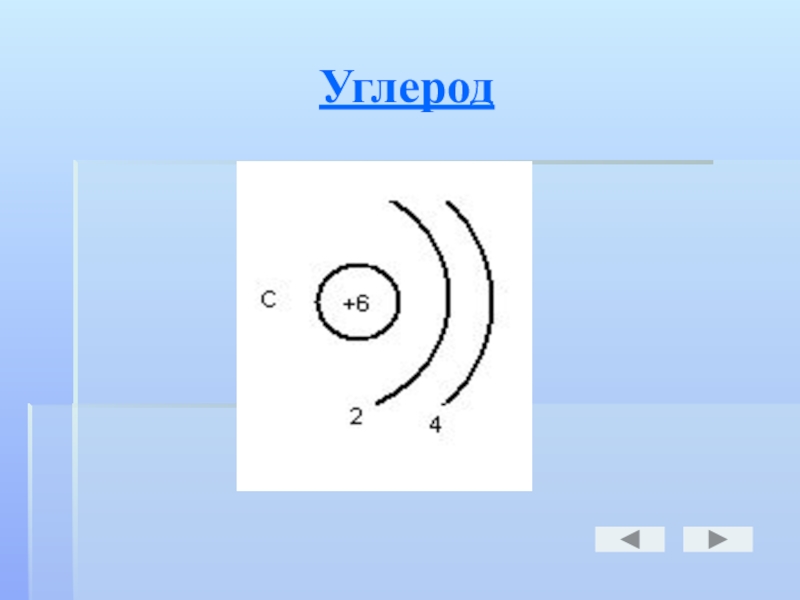
- 15. Углерод
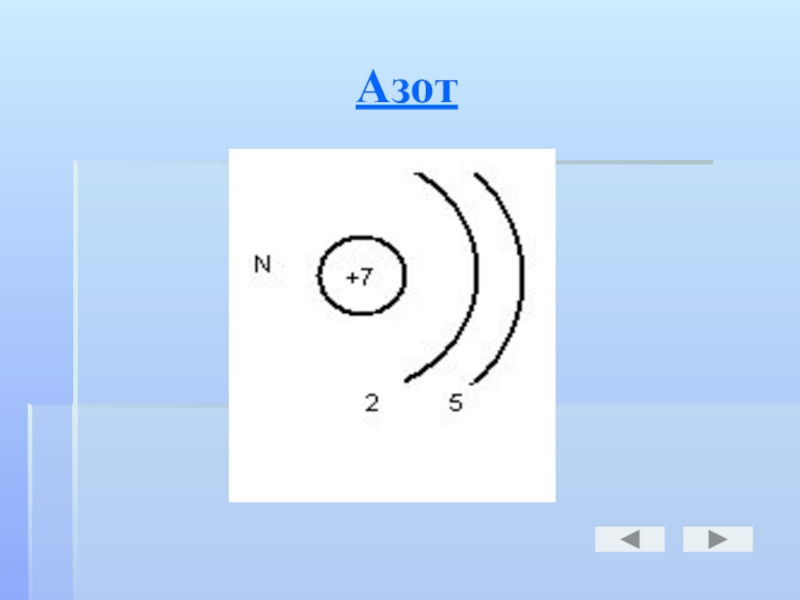
- 16. Азот
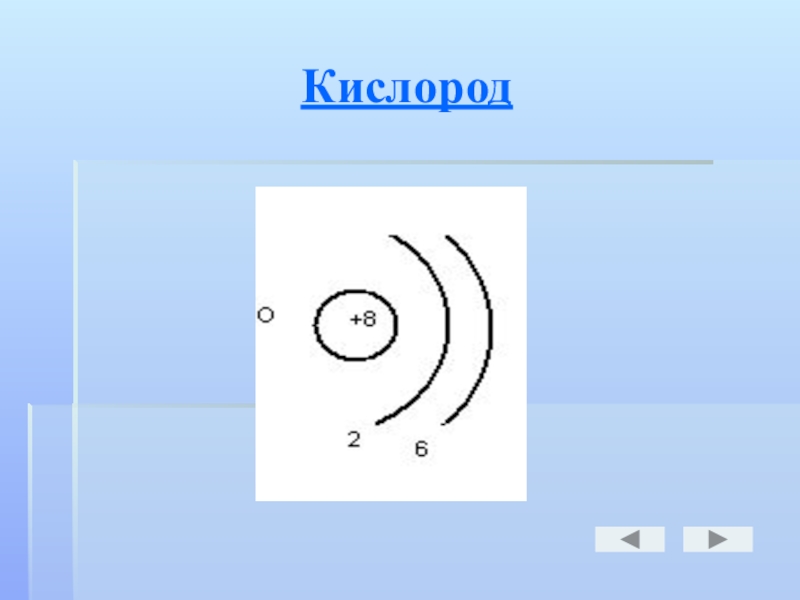
- 17. Кислород
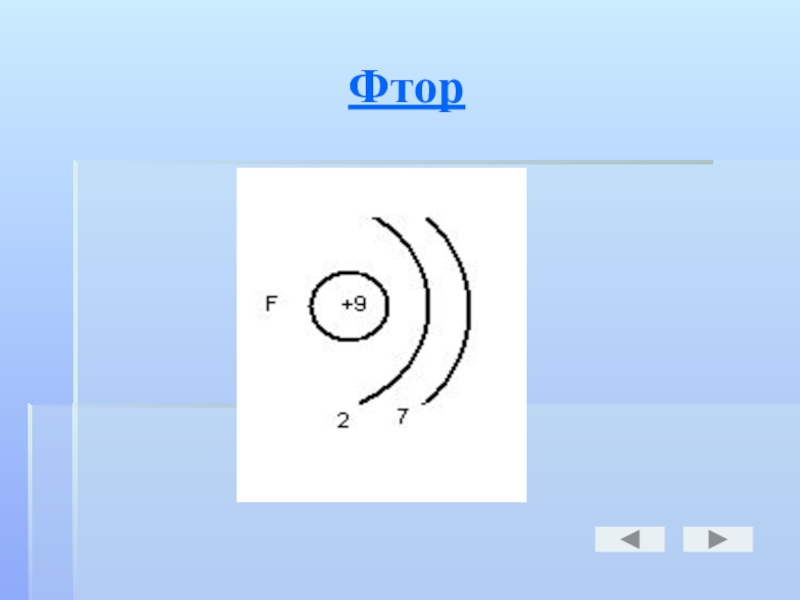
- 18. Фтор
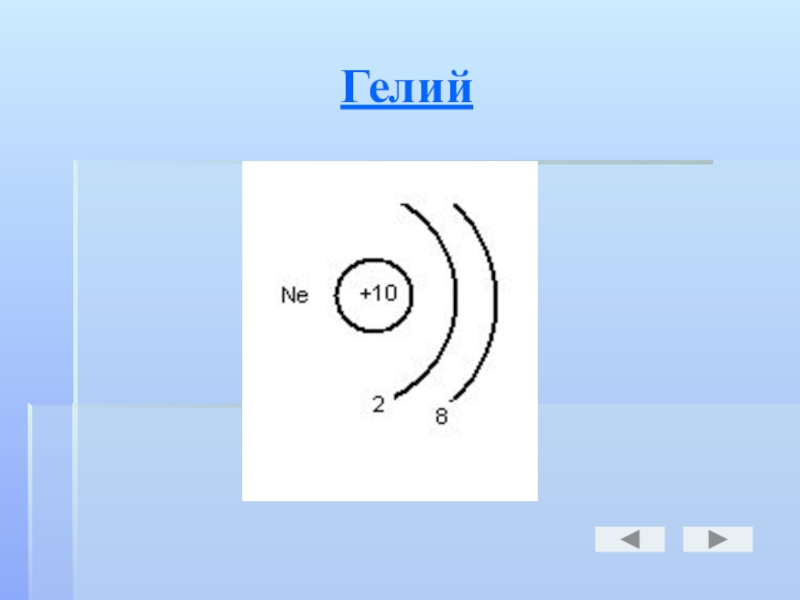
- 19. Гелий
- 20. Строение электронных оболочек атомов элементов lll периода.
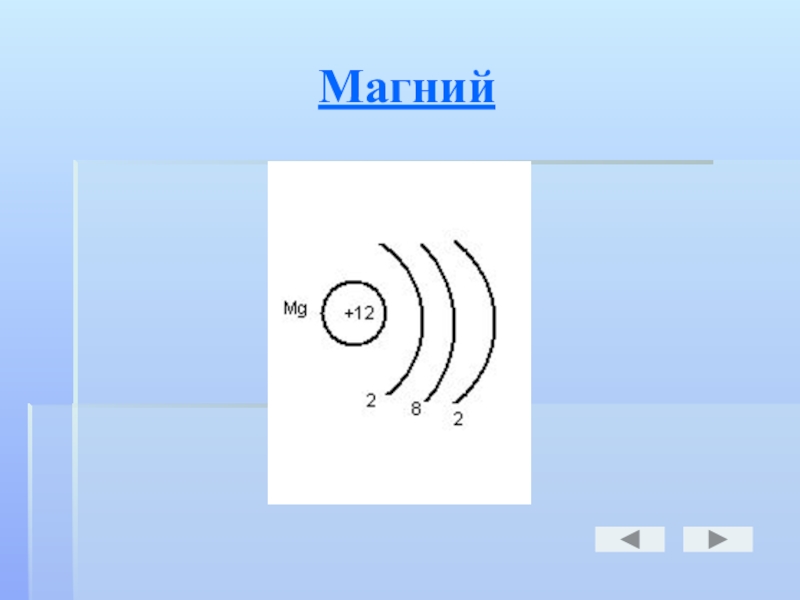
- 21. Магний
- 22. Алюминий
- 23. Кремний
- 24. Фосфор
- 25. Сера
- 26. Хлор
- 27. Аргон
- 28. Сравните строение атома: Азота и фосфораФосфора и
- 29. § 8Упр 1, 3Домашнее задание
Слайд 2Цели урока.
Дать понятие об электронной оболочке атома и энергетических уровнях.
Рассмотреть строение
Сформировать представление о завершенном и незавершенном энергетических уровнях.
Слайд 3
Определите число протонов, электронов и нейтронов для атомов элементов:
2. Определите относительную
Актуализация опорных знаний.
Слайд 4
Атом состоит из ядра (в нем сосредоточены протоны и нейтроны) и
Совокупность электронов, окружающих атомное ядро, называется электронной оболочкой.
Формирование новых ЗУНов.
Слайд 5Электроны, которые близки по значениям энергии образуют электронные слои или энергетические
Число энергетических уровней в атоме химического элемента равно соответствующему ему номеру периода в таблице Д. И. Менделеева:
У атома Al, элемента lll периода – три уровня,
А у атома Pb, элемента Vl периода,– шесть уровней.
Слайд 6Каждый уровень может вместить в себя определенное максимальное число электронов:
1-й -
2-й - 8 электронов;
3-й - 18 электронов (для атомов элементов третьего периода только 8 электронов.)
Слайд 7
Энергетические уровни, содержащие максимальное число электронов, называются завершенными.
Если энергетические уровни содержат
Слайд 8
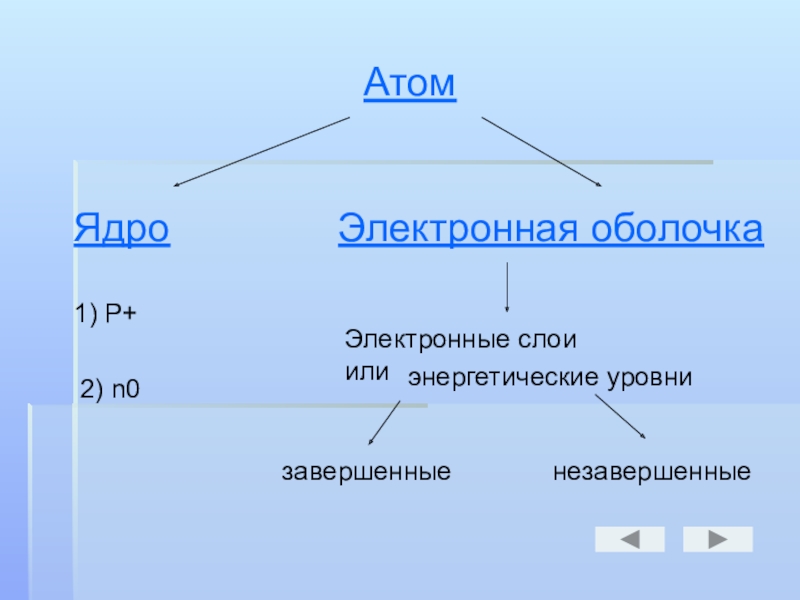
Атом
Ядро
Электронная оболочка
1) Р+
2) n0
Электронные слои или
энергетические уровни
завершенные
незавершенные
Слайд 9План (строение электонных оболочек атома).
Определить общее число электронов на оболочке
Определить число электронных слоев (энергетических уровней) в электронной оболочке (оно равно номеру периода);
Определить число электронов на каждом слое – уровне (на первом – не более двух, на втором – не более восьми, на внешнем уровне число электронов равно номеру группы для элементов главных подгрупп)
Слайд 28
Сравните строение атома:
Азота и фосфора
Фосфора и серы.
Работа с электронным учебником
Развитие новых ЗУНов