- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Спирты. Охрана окружающей среды и производство
Содержание
- 1. Спирты. Охрана окружающей среды и производство
- 2. Строение этилого спирта Этиловый спирт
- 3. Поместим в пробирку
- 4. Очивидно , здесь мы снова встречаемся с
- 5. Однако распределение электронной плотности в молекуле спирта
- 6. Как видим , атом кислорода образует ковалентные
- 7. Гомологический ряд спиртовЭтиловый спирт –один из членов
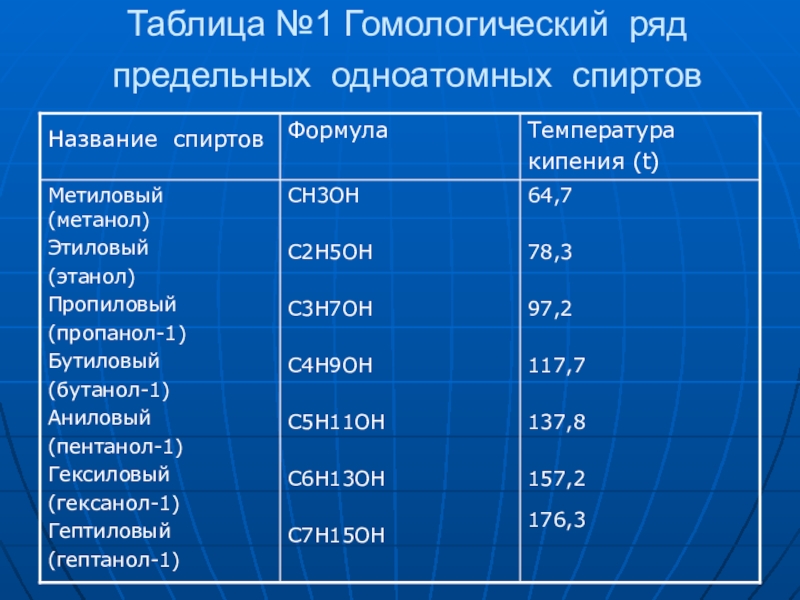
- 8. Таблица №1 Гомологический ряд предельных одноатомных спиртов
- 9. Согласно систематической номеклатуре названия спиртов , производится
- 10. Химические свойства Спирты горят при поджигании ,
- 11. У спиртов может вступать не только гидроксильный
- 12. Дигидрация последующих гомологов приводит к получению других
- 13. Диэтиловый эфир –летучая , легко воспламеняющаяся жидкость
- 14. Физические свойства Вы , несомненно обратили внимание
- 15. В молекулах спирта , как мы выяснили
- 16. Применение и получение спиртов Получение .До
- 17. Применение .На многих производствах спирты применяются в
- 18. Охрана окружающей среды Спирты оказывают негативное воздействие
- 19. Спирт поражает слизистые оболочки желудочно-кишечного тракта ,
Строение этилого спирта Этиловый спирт С8Н6О-бесцветная жидкость со своеобразным законом, легче воды Р=0,8г/см , кипит при t-78,3 С, хорошо растворяется в воде и сам является растворителем многих неорганических и органических веществ. Зная молекулярную формулу
Слайд 2Строение этилого спирта
Этиловый спирт С8Н6О-бесцветная жидкость со своеобразным
законом, легче воды Р=0,8г/см , кипит при t-78,3 С, хорошо растворяется в воде и сам является растворителем многих неорганических и органических веществ. Зная молекулярную формулу спирта и валентность элементов , попытаемся изобразить его строение. Напишем две структурные формулы.
Н Н Н Н
Н-С-О-С-Н (1) (2) Н-С-С-О-Н
Н Н Н Н
Н Н Н Н
Н-С-О-С-Н (1) (2) Н-С-С-О-Н
Н Н Н Н
Слайд 3
Поместим в пробирку со спиртом (не содержащий
воды)
кусочек натрия . Начинается реакция , сопровождающаяся выделением газа . Нетрудно установить , что это водород . При помощи другого , более сложного опыта можно определить , сколько атомов водорода выделяется при реакции из каждой молекулы спирта . В колбу с мелкими кусочками натрия приливается по каплям из воронки определённое количество спирта(1). Выделяющийся из спирта водород вытесняет воду из двугорлой склянки в цилиндр . Обьём вытесненной воды в цилиндре соответствует объему выделившегося водорода .Опыт показывает, что из 0,1 моль спирта удаётся получить 1,12л. водорода . Это означает , что из 1 моль спирта натрий вытесняет 1,12л. т.е. 0,5 моль водорода.
Чтобы подчеркнуть , что в молекуле спирта содержится гидроксильная чруппа-ОН , соединённая с углеводородным радикалом , молекулярную формулу этилового спирта часто пишут так :
СН3-СН2-ОН или С2Н5ОН
кусочек натрия . Начинается реакция , сопровождающаяся выделением газа . Нетрудно установить , что это водород . При помощи другого , более сложного опыта можно определить , сколько атомов водорода выделяется при реакции из каждой молекулы спирта . В колбу с мелкими кусочками натрия приливается по каплям из воронки определённое количество спирта(1). Выделяющийся из спирта водород вытесняет воду из двугорлой склянки в цилиндр . Обьём вытесненной воды в цилиндре соответствует объему выделившегося водорода .Опыт показывает, что из 0,1 моль спирта удаётся получить 1,12л. водорода . Это означает , что из 1 моль спирта натрий вытесняет 1,12л. т.е. 0,5 моль водорода.
Чтобы подчеркнуть , что в молекуле спирта содержится гидроксильная чруппа-ОН , соединённая с углеводородным радикалом , молекулярную формулу этилового спирта часто пишут так :
СН3-СН2-ОН или С2Н5ОН
Слайд 4
Очивидно , здесь мы снова встречаемся с влиянием атомов друг на
друга . Чтобы понять сущность этого влияния , обратимся к электроному строению молекулы . Характер связей С-СuC-Н нам уже хорошо известен – это ковалентные q –связи . Атом О2 образует с атомом “H” и с углеводородным радикалом такие же связи , при этом его наружный электронный слой дополняется до октета .
Формула спирта в таком случае можно изобразить так :
Н Н
Н С С О Н
Н Н
Формула спирта в таком случае можно изобразить так :
Н Н
Н С С О Н
Н Н
Слайд 5
Однако распределение электронной плотности в молекуле спирта не такое равномерное ,
как в углеродах . Связь О-Н полимерная ,так как наибольшая электронная плотность её смещена к атому О2 , как элементу более электроотрицательному . Атом “Н” оказывается как бы более свободным от электронов , менее связаным с молекулой и поэтому может сравнительно легко вытесняется натрием . Смещение электронной плотности можно показать в формуле следующим образом :
Н Н
Н-С-С-О Н
Н Н
Н Н
Н-С-С-О Н
Н Н
Слайд 6
Как видим , атом кислорода образует ковалентные связи другими атомами под
некоторым углом друг к другу , а не по прямой линии . Вспомним , что в наружном электронном слое наряду с двумя спаренными S-электронами и двумя спаренными р-электронами имеются два непареных р-электрона . Оси этих электронных облаков взаимно перпендикулярно . В направлении их и образуются ковалентные связи атома кислорода с другими атомами (фактически в следствии гибридизации и действия других факторов валентный угол несколько отклоняется от прямого). Мы знаем , что молекуле воды имеет подобное пространственное строение.
Слайд 7Гомологический ряд спиртов
Этиловый спирт –один из членов гомологического ряда .Другие спирты
ряда имеют аналогичное химическое и электронное строение . Первый член ряда метиловый спирт . . Н . Н –С –О –Н
Н
Ближащий следующий гомолог этилого спирта пропиловый спирт.
Н Н Н
Н –С –С –С –О –Н
Н Н Н
Н
Ближащий следующий гомолог этилого спирта пропиловый спирт.
Н Н Н
Н –С –С –С –О –Н
Н Н Н
Слайд 9
Согласно систематической номеклатуре названия спиртов , производится от названий спиртов ,
соответствующих углеводородов с добавлением суфикса -0^ ; цифрой указывают атом углерода при котором находится гидроксильная группа . Нумерацию углеродных атомов начинают с того конца , к которому ближе функциональная группа .Изомерия спиртов обуславливается как изомерией углеводородного скелета , так и положением гидроксильной группы
Слайд 10Химические свойства
Спирты горят при поджигании , выделяет кислоту , например:
С2Н5ОН+3О2 -2СО+3Н2О+137
однако при горении у них наблюдаются и различия . Нальём по одному миллилитру разных спиртов в форфоровые чашки и подожжём жидкости . Заметим , что спирты –первые члены ряда легко воспламеняются синеватым почти не светящимся пламенем , и после сгорания их остаётся чёрный налёт .
Взаимодействие этилого спирта с натрием .
2С2Н5ОН+2Na –2C2Н5Оna+H2
Слайд 11
У спиртов может вступать не только гидроксильный атом водорода ,но и
вся гидроксильная группа . Если в колбе с присоеденённым к ней холодильником нагревать этиловый спирт с галогеноводородной кислотой , например с бромоводородной (для образования бромоводорода берут смесь бромида калия или бромида натрия с серной кислотой) , то через некоторое время можно заметить , что в пробирке под слоем воды собирается тяжёлая жидкость–броэтан .
С2Н5ОН+НBr–С2Н5Br+H2O
Эта реакция тоже идёт с ионым расщиплением ковалентной связи С-О. Она напоминает нам реакцию оснований и этилового спирта , образуется бромистан . При нагревании с концентрированной кислотой в качестве католизатора спирты легко дигидратируются , т.е. отщепляет воду . Из этилового
спирта при этом образуется этилен .
Н Н
Н –С –С –Н –СН2=СН2+Н2О
Н ОН
С2Н5ОН+НBr–С2Н5Br+H2O
Эта реакция тоже идёт с ионым расщиплением ковалентной связи С-О. Она напоминает нам реакцию оснований и этилового спирта , образуется бромистан . При нагревании с концентрированной кислотой в качестве католизатора спирты легко дигидратируются , т.е. отщепляет воду . Из этилового
спирта при этом образуется этилен .
Н Н
Н –С –С –Н –СН2=СН2+Н2О
Н ОН
Слайд 12
Дигидрация последующих гомологов приводит к получению других непредельных углеводородов .
Н Н Н
Н –С –С –С –Н СН3 –СН=СН2+Н2О
Н Н ОН
При несколько иных условиях дигидрация спиртов может , происходить с отщеплением молекулы воды не от каждой молекулы спирта , а от двух молекул . Так , при более слабом нагревания этилового спирта с серной кислотой (не выше +140 С и при избытке
спирта) диэтиловый эфир.
С2Н5ОН+ОНС2Н5 –С2Н5 –О –С 2Н5+Н2О
Слайд 13
Диэтиловый эфир –летучая , легко воспламеняющаяся жидкость , применяют в медицине
в качестве наркоза. Он относится к классу простых эфиров–органических веществ , молекулы которых состоят из двух углеводородных радикалов , соединёных посредственно атома кислорода .
С диэтиловым эфиром мы встречались когда выяснили строение этилового спирта . Из двух возможных структур отвечающих формуле С2Н6О , мы выбрали одну позволяющую понять свойства спирта . Другая не принетая нами формула хотя она также отвечает правилом важности , выражает стрение диментилового эфира . Имея одну и эту же молекулярную формулу , эти вещества , следовательно , являются изомерами , принадлежат к различным классам органических соединений .
С диэтиловым эфиром мы встречались когда выяснили строение этилового спирта . Из двух возможных структур отвечающих формуле С2Н6О , мы выбрали одну позволяющую понять свойства спирта . Другая не принетая нами формула хотя она также отвечает правилом важности , выражает стрение диментилового эфира . Имея одну и эту же молекулярную формулу , эти вещества , следовательно , являются изомерами , принадлежат к различным классам органических соединений .
Слайд 14Физические свойства
Вы , несомненно обратили внимание , что , в
отличие от ранее рассматривавшихся предельных и непредельных углеводородов , в данном гомологическом ряду ней газообразных веществ , уже первый член ряда –метиловый спирт –жидкость. Как объяснить такое повышение температуры кипения веществ . Может тем , что при вступлении атома кислорода в молекулу сильно возрастёт молекулярная масса вещества Но у метилового спирта молекулярная масса –32 , у пропана –44 , однако и он представляет собой газообразное вещество . Тогда что же удерживает молекулы метилового спирта , сами по себе довольно лёгкие , в жидком состоянии ?
Слайд 15
В молекулах спирта , как мы выяснили , углеводородный радикал и
атом кислорода не на одной прямой , а под некоторым углом друг к другу . У атома О2 имеются ещё свободные электронные пары . Поэтому он может взаимодействовать с атомом водорода другой молекуы , имеющий некоторый положительный заряд в результате смещения электронов к атому кислороду .
Слайд 16Применение и получение спиртов
Получение .
До начала 30-х годов 20
века его получали исключительно сбраживанием пищ углеводсодержащего сырья , и при обработки зерна(рожь , ячмень , кукуруза , овёс , просо) . В 30-е по 50-е годы было разработанно несколько способов синтеза Э.С. из химического сырья
например : лидрирования ацентальдецида и д.р. . Оси современных способов –односейадистная (прямая) гидраитация . Этилена (CU2=CU2+H2O –C2H5OH) , осуществляется на фосфорно-кислотном католизаторе при 280-300 С и 7,2-8,3 Мн/м (72-83 кг/см ). Так , в США в 1976 г. было выработано около 800 тыс. тонн этонола , в т.ч. 550 тыс. тонн прямой гидротацией (остальное сбраживание пищевого сырья) . В других странах (СССР , Франция и др.) Э.С. получают также двухстадийной (сернокислотной гидраитацией этилена при : 75-80 С и 2,48 Мн/м/24,8 нес/м ) этилен взаимодействует с концетрированой серной кислотой с образованием смеси моно и диэнтилеульфатов [С2Н5OSO2ОН и (С2Н5О)2SO2] , которые затем гидрилизуясь при 100 С и 0,3-0,4 Мн/м дают Э.С. и Н2SO4 .
например : лидрирования ацентальдецида и д.р. . Оси современных способов –односейадистная (прямая) гидраитация . Этилена (CU2=CU2+H2O –C2H5OH) , осуществляется на фосфорно-кислотном католизаторе при 280-300 С и 7,2-8,3 Мн/м (72-83 кг/см ). Так , в США в 1976 г. было выработано около 800 тыс. тонн этонола , в т.ч. 550 тыс. тонн прямой гидротацией (остальное сбраживание пищевого сырья) . В других странах (СССР , Франция и др.) Э.С. получают также двухстадийной (сернокислотной гидраитацией этилена при : 75-80 С и 2,48 Мн/м/24,8 нес/м ) этилен взаимодействует с концетрированой серной кислотой с образованием смеси моно и диэнтилеульфатов [С2Н5OSO2ОН и (С2Н5О)2SO2] , которые затем гидрилизуясь при 100 С и 0,3-0,4 Мн/м дают Э.С. и Н2SO4 .
Слайд 17Применение .
На многих производствах спирты применяются в качестве растворителей . В
химической промышленности они используются для различных синтезов . Метиловый спирт в больших количествах идёт на получение формальдегида , используемого в производстве пластмасс уксусной кислоты и других органических веществ . В настоящее время разрабатывается много новых технологических процессов на основе использования метилового спирта как исходного продукта , поэтому значение его в промышленном производстве нужных народному хозяйству , веществ и материалов будет всё более возрастать . Перспективным считается использование метилового спирта в качестве моторного топлива т.к. добавка его к бензину повышает актановое число горючей смеси и снижает образование вредных веществ в выхлопных газах . Этиловый спирт в больших количествах идёт на производство синтетического каучука . Окислением спирта получают пищевую уксусную кислоту . Путём его дигидратации готовят диэтиловый (медицинский) эфир , с взаимодействием с хлороводородом получают хлорэтан , для местной анестозии. Спирт применяется при изготовлении многих лекарств . В парфюмерии он идёт на изготовление духов и адеколонов .
Слайд 18Охрана окружающей среды
Спирты оказывают негативное воздействие на организм . Особенно
ядовит метиловый спирт . Самое незначительное количество его при приёме внутрь разрушает зрительный нерв и вызывает необратимую слепоту . 5-10 мл спирта вызывает сильное отравление организма , а 30 мл могут привести к смертельному исходу . Этиловый спирт-наркотик , при приёме внутрь он вследствие высокой растворимости быстро всасывает в кровь и сильно действует на организм. Под влиянием спиртного у человека ослабляется внимание затормаживается реакция нарушается корреляция движения , появляется развязанность, грубость в поведении и т.д. , всё это делает его неприятным в обществе . Но вследствии употребления алкоголя ещё более опасны , т.к. у пьющего человека появляется привыкание , погубное пристрастие к нему и в конце в концов он тяжело заболевает алкоголизмом .
Слайд 19
Спирт поражает слизистые оболочки желудочно-кишечного тракта , что ведёт к возникновению
гастрита язвенной болезни желудка , двенадцатой кишки . Печень , где должно происходить разрушение спирта , не справляясь с нагрузкой , начинает перерождаться в результате возможен цирроз . Проникая в головной мозг спирт отравляюще действует на нервные клетки , что проявляется в нарушении сознания , речи , умственных способностей , в появлении , тяжёлых психических растройств и ведёт к деградации личности . Особенно опасен алкоголь для молодых людей , так как в растущем организме интенсивно протекают процессы обмена веществ и они особенно чувствительны к алкоголическому воздействию . Поэтому у молодых быстрее , чем у взрослых , может появиться заболевание – алкоголизм .
Все виды спиртного должны быть полностью исключены из жизни молодёжи !!!
Все виды спиртного должны быть полностью исключены из жизни молодёжи !!!