НФ КМНС ХГМК
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Спирты и фенолы
Содержание
- 1. Спирты и фенолы
- 2. Строение предельных одноатомных спиртов.Спиртами называют соединения, содержащие
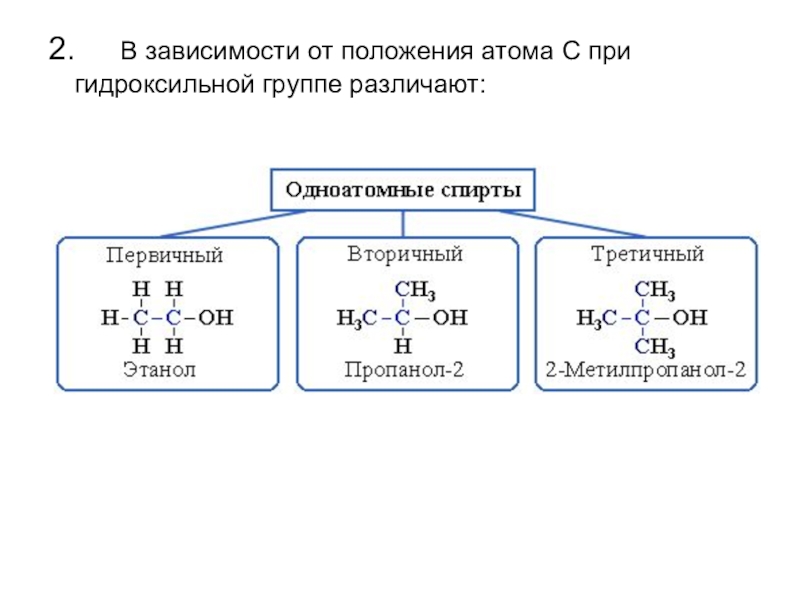
- 3. 2. В зависимости от положения атома С при гидроксильной группе различают:
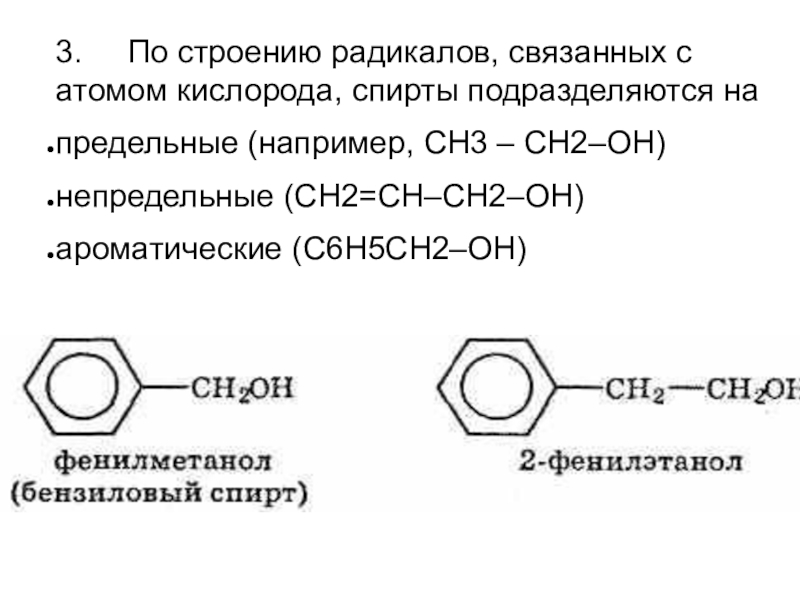
- 4. 3. По строению радикалов, связанных
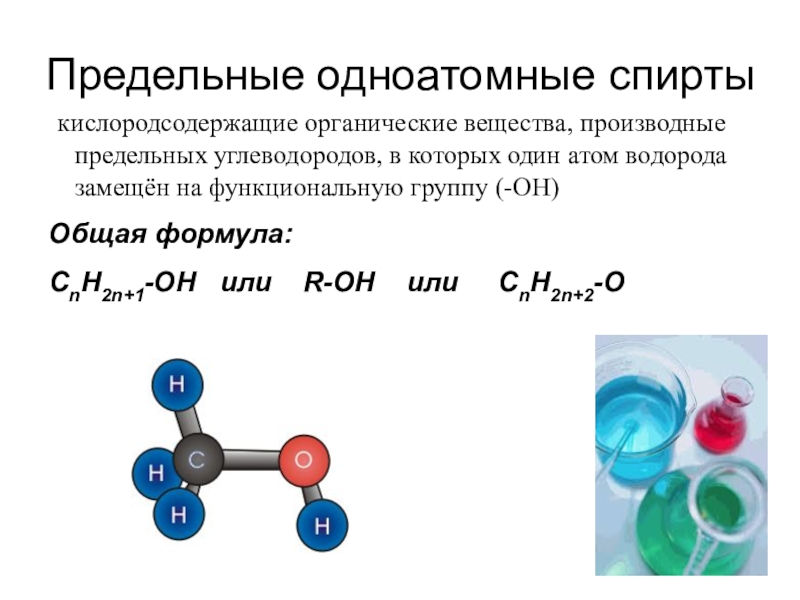
- 5. Предельные одноатомные спирты кислородсодержащие органические вещества, производные
- 6. Номенклатура спиртовСистематические названия даются по названию углеводорода
- 7. Слайд 7
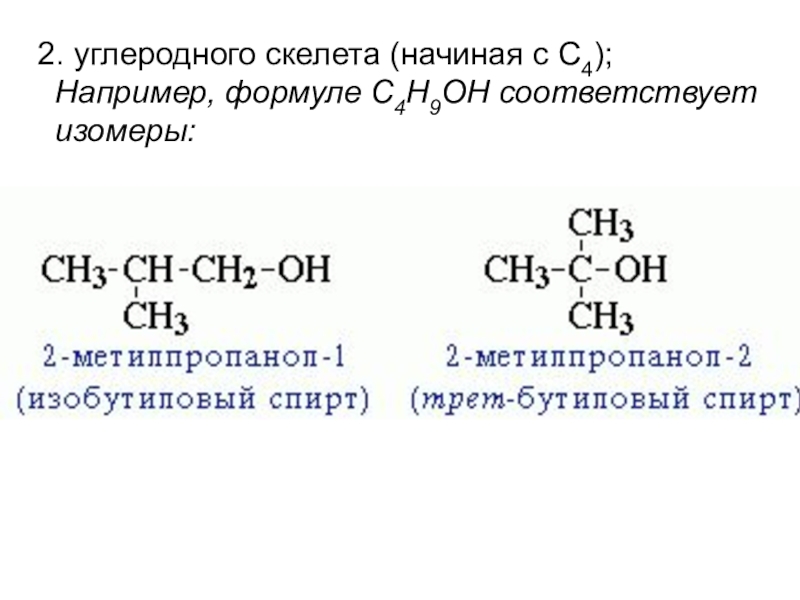
- 8. Изомерия спиртовДля спиртов характерна структурная изомерия: 1. изомерия положения ОН-группы (начиная с С3);
- 9. 2. углеродного скелета (начиная с С4); Например, формуле C4H9OH соответствует изомеры:
- 10. 3. межклассовая изомерия с простыми эфирами Например,этиловый спирт СН3CH2–OH и диметиловый эфир CH3–O–CH3
- 11. Строение спиртовСтроение самого простого спирта — метилового
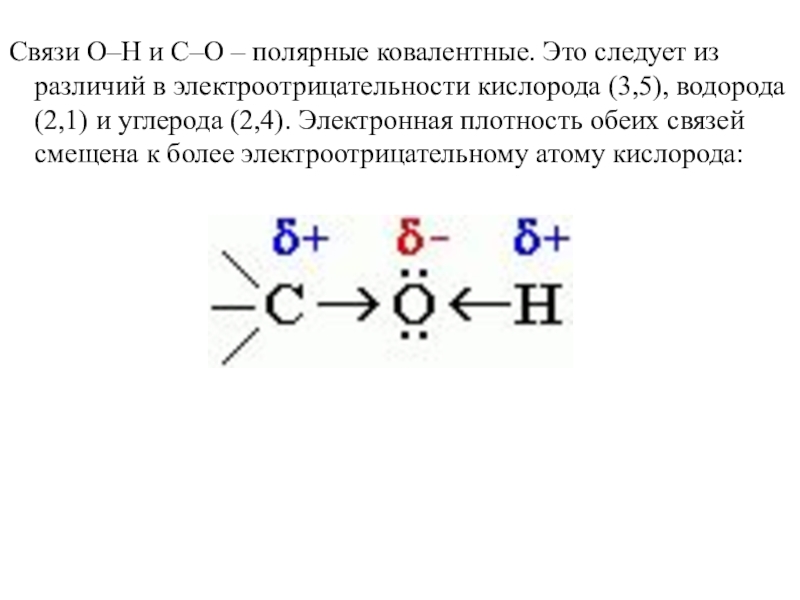
- 12. Связи О–Н и С–О – полярные ковалентные.
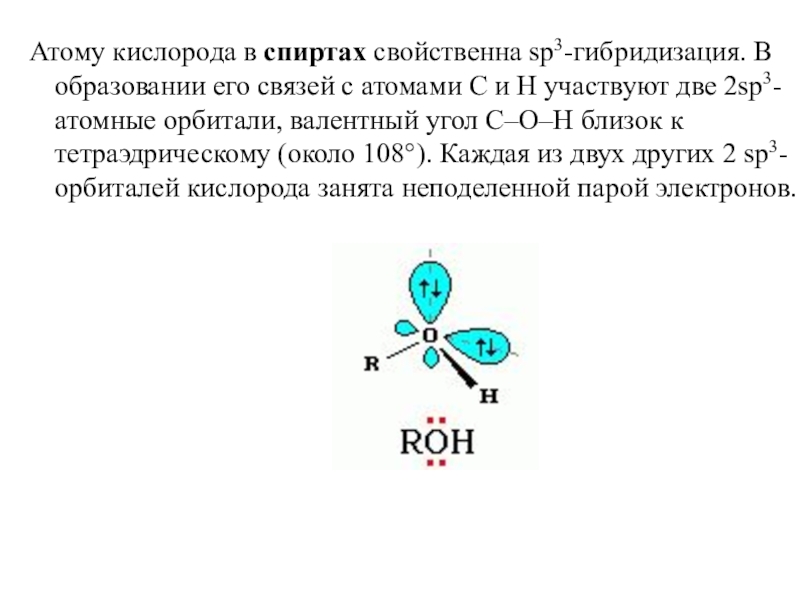
- 13. Атому кислорода в спиртах свойственна sp3-гибридизация. В образовании его
- 14. Физические свойстваМЕТАНОЛ (древесный спирт) – жидкость (tкип=64,5; tпл=-98;
- 15. Химические свойства В химических реакциях гидроксисоединений возможно
- 16. 1. Кислотные свойстваС активными щелочными металлами:2C2H5OH + 2 Na →
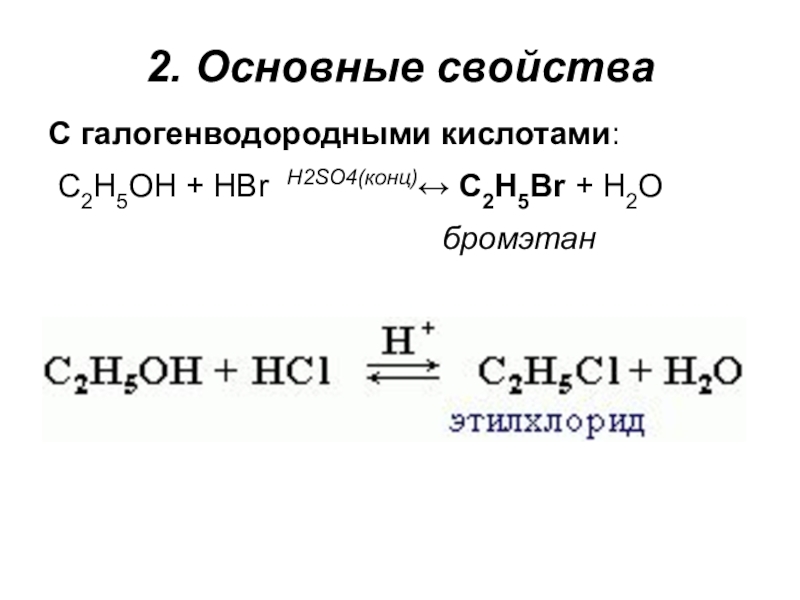
- 17. 2. Основные свойстваС галогенводородными кислотами: C2H5OH + HBr H2SO4(конц)↔ C2H5Br +
- 18. 3. В присутствии окислителей [O] – K2Cr2O7 или KMnO4 спирты окисляются до карбонильных соединений:
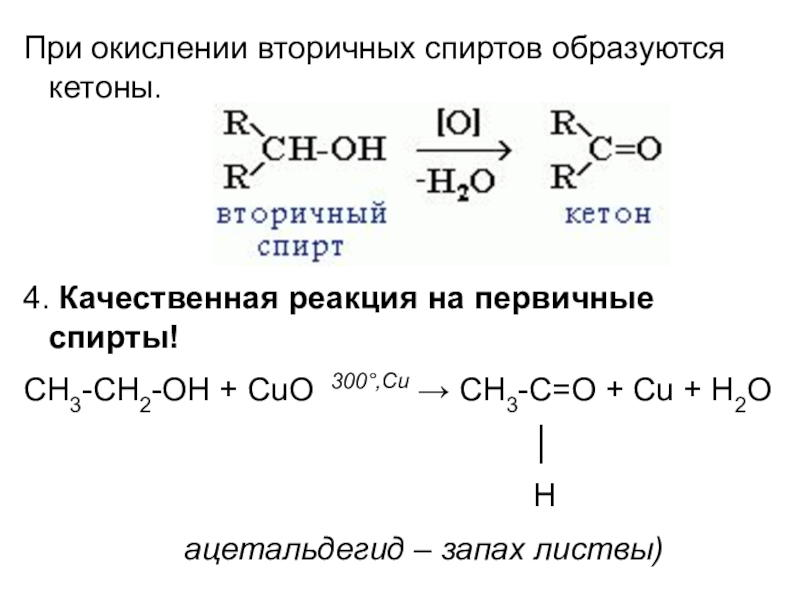
- 19. При окислении вторичных спиртов образуются кетоны.4. Качественная
- 20. 5. Горение (с увеличением массы углеводородного радикала –
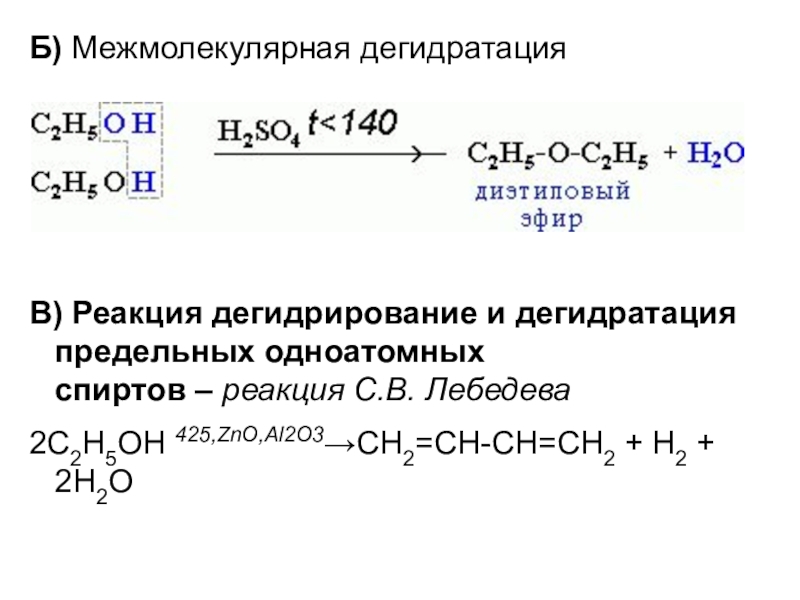
- 21. Б) Межмолекулярная дегидратацияВ) Реакция дегидрирование и дегидратация предельных одноатомных спиртов – реакция С.В. Лебедева 2C2H5OH 425,ZnO,Al2O3→CH2=CH-CH=CH2 + H2 + 2H2O
- 22. 7. Реакции этерификацииСпирты вступают в реакции с
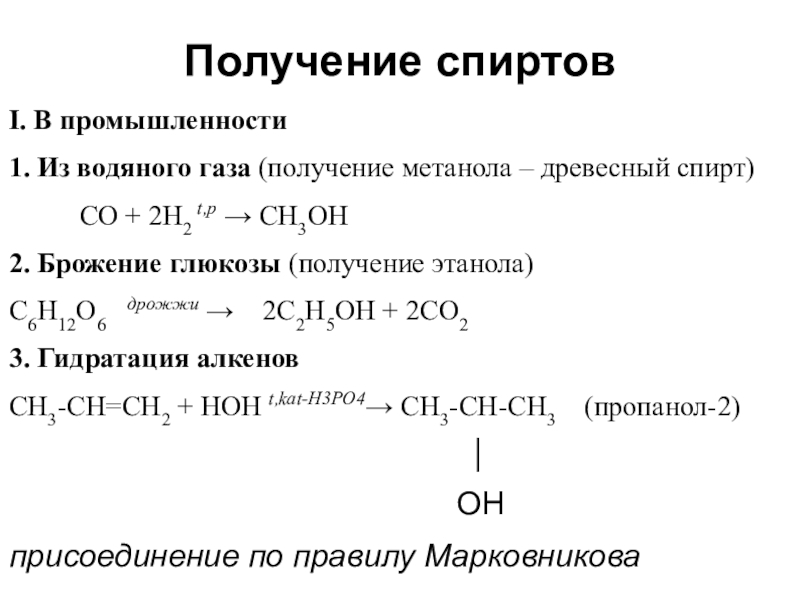
- 23. Получение спиртовI. В промышленности1. Из водяного газа (получение
- 24. II. В лабораторииВзаимодействие галогеналканов R-Г с водными растворами щелочейCH3Cl + NaOH t, водн.р-р.→ CH3OH + NaCl (р. обмен)
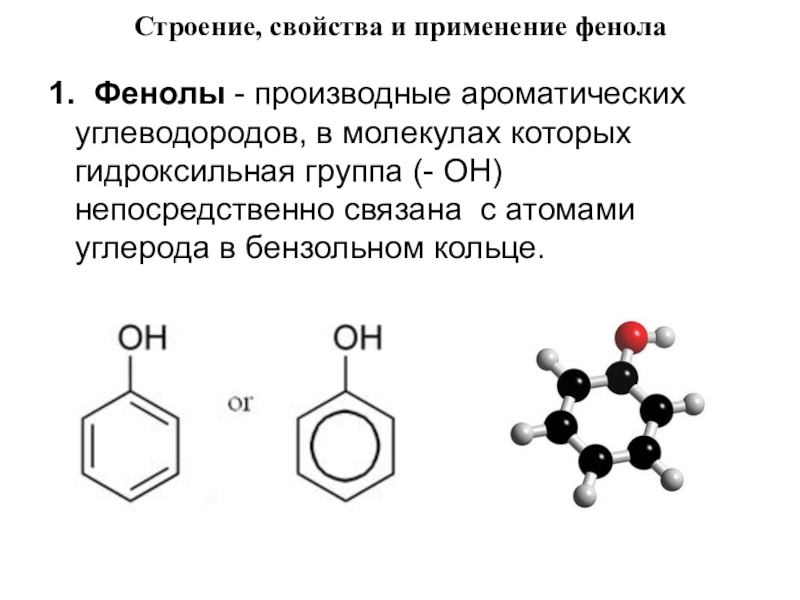
- 25. Строение, свойства и применение фенола 1. Фенолы -
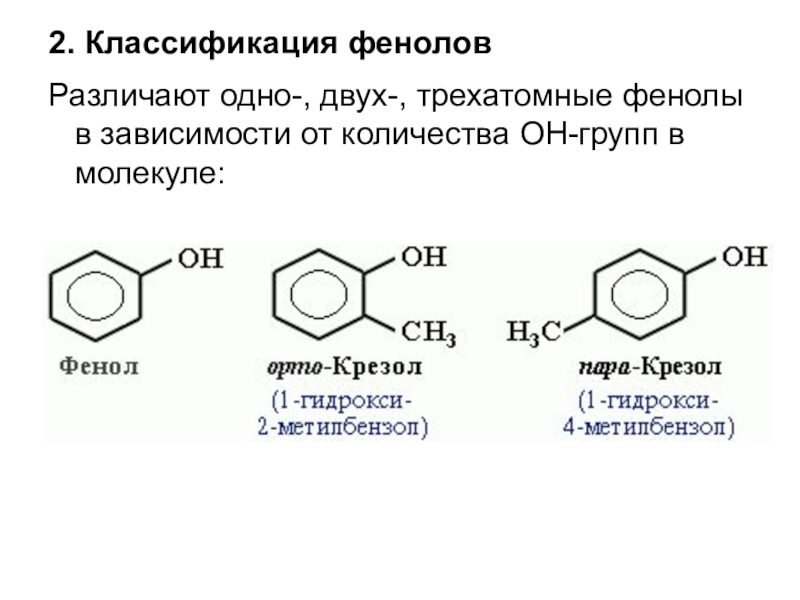
- 26. 2. Классификация феноловРазличают одно-, двух-, трехатомные фенолы в зависимости от количества ОН-групп в молекуле:
- 27. Токсические свойстваФенол ядовит. Вызывает нарушение функций нервной
- 28. Применение фенолов1. Производство синтетических смол, пластмасс, полиамидов 2. Лекарственных препаратов3. Красителей4. Поверхностно-активных веществ5. Антиоксидантов6. Антисептиков7. Взрывчатых веществ
- 29. Список литературыХимия для профессий и специальностей естественно-научного
Строение предельных одноатомных спиртов.Спиртами называют соединения, содержащие одну или несколько гидроксильных групп, непосредственно связанных с углеводородным радикалом.Классификация спиртов1. По числу гидроксильных групп спирты подразделяются наодноатомные (одна группа -ОН)Например, СH3 – OH метанол, CH3 –
Слайд 2Строение предельных одноатомных спиртов.
Спиртами называют соединения, содержащие одну или несколько гидроксильных
групп, непосредственно связанных с углеводородным радикалом.
Классификация спиртов
1. По числу гидроксильных групп спирты подразделяются на
одноатомные (одна группа -ОН)
Например, СH3 – OH метанол, CH3 – CH2 – OH этанол
многоатомные (две и более групп -ОН).
Классификация спиртов
1. По числу гидроксильных групп спирты подразделяются на
одноатомные (одна группа -ОН)
Например, СH3 – OH метанол, CH3 – CH2 – OH этанол
многоатомные (две и более групп -ОН).
Слайд 43. По строению радикалов, связанных с атомом кислорода, спирты
подразделяются на
предельные (например, СH3 – CH2–OH)
непредельные (CH2=CH–CH2–OH)
ароматические (C6H5CH2–OH)
предельные (например, СH3 – CH2–OH)
непредельные (CH2=CH–CH2–OH)
ароматические (C6H5CH2–OH)
Слайд 5Предельные одноатомные спирты
кислородсодержащие органические вещества, производные предельных углеводородов, в которых
один атом водорода замещён на функциональную группу (-OH)
Общая формула:
CnH2n+1-OH или R-OH или CnH2n+2-O
Общая формула:
CnH2n+1-OH или R-OH или CnH2n+2-O
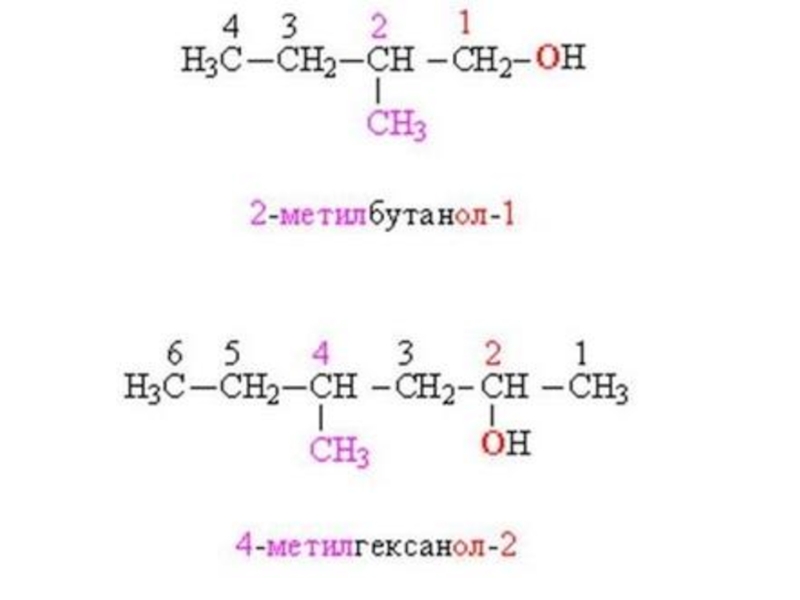
Слайд 6Номенклатура спиртов
Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры,
указывающей положение гидроксигруппы (если это необходимо).
Нумерация ведется от ближайшего к ОН-группе конца цепи.
Цифра, отражающая местоположение ОН-группы, в русском языке обычно ставится после суффикса "ол".
Нумерация ведется от ближайшего к ОН-группе конца цепи.
Цифра, отражающая местоположение ОН-группы, в русском языке обычно ставится после суффикса "ол".
Слайд 8Изомерия спиртов
Для спиртов характерна структурная изомерия:
1. изомерия положения ОН-группы (начиная с С3);
Слайд 103. межклассовая изомерия с простыми эфирами
Например,
этиловый спирт СН3CH2–OH и диметиловый эфир CH3–O–CH3
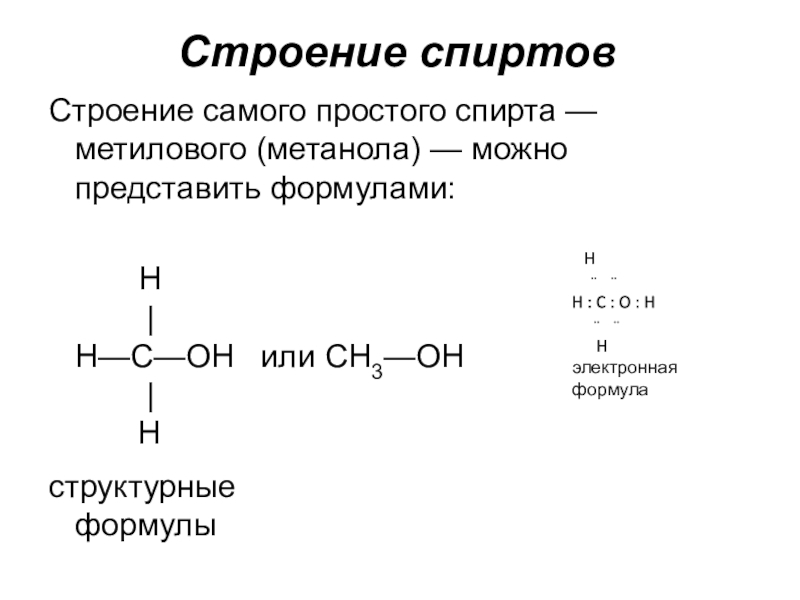
Слайд 11Строение спиртов
Строение самого простого спирта — метилового (метанола) — можно представить
формулами:
H | H—C—OH или CH3—OH | H
структурные формулы
H | H—C—OH или CH3—OH | H
структурные формулы
H
.. ..
H : C : O : H
.. ..
H
электронная
формула
Слайд 12Связи О–Н и С–О – полярные ковалентные. Это следует из различий
в электроотрицательности кислорода (3,5), водорода (2,1) и углерода (2,4). Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Слайд 13Атому кислорода в спиртах свойственна sp3-гибридизация. В образовании его связей с атомами C
и H участвуют две 2sp3-атомные орбитали, валентный угол C–О–H близок к тетраэдрическому (около 108°). Каждая из двух других 2 sp3-орбиталей кислорода занята неподеленной парой электронов.
Слайд 14Физические свойства
МЕТАНОЛ (древесный спирт) – жидкость (tкип=64,5; tпл=-98; ρ = 0,793г/см3), с
запахом алкоголя, хорошо растворяется в воде. Ядовит – вызывает слепоту, смерть наступает от паралича верхних дыхательных путей.
ЭТАНОЛ (винный спирт) – б/цв жидкость, с запахом спирта, хорошо смешивается с водой.
Первые представители гомологического ряда спиртов — жидкости, высшие — твердые вещества. Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде падает. Высшие спирты практически нерастворимы в воде.
ЭТАНОЛ (винный спирт) – б/цв жидкость, с запахом спирта, хорошо смешивается с водой.
Первые представители гомологического ряда спиртов — жидкости, высшие — твердые вещества. Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде падает. Высшие спирты практически нерастворимы в воде.
Слайд 15Химические свойства
В химических реакциях гидроксисоединений возможно разрушение одной из двух связей:
С–ОН
с отщеплением ОН-группы
О–Н с отщеплением водорода
О–Н с отщеплением водорода
Слайд 161. Кислотные свойства
С активными щелочными металлами:
2C2H5OH + 2 Na → 2C2H5ONa + H2
этилат
натрия
Алкоголяты подвергаются гидролизу, это доказывает,что у воды более сильные кислотные свойства
C2H5ONa + H2O ↔ C2H5OH + NaOH
Алкоголяты подвергаются гидролизу, это доказывает,что у воды более сильные кислотные свойства
C2H5ONa + H2O ↔ C2H5OH + NaOH
Слайд 172. Основные свойства
С галогенводородными кислотами:
C2H5OH + HBr H2SO4(конц)↔ C2H5Br + H2O
бромэтан
Слайд 183. В присутствии окислителей [O] – K2Cr2O7 или KMnO4 спирты окисляются до карбонильных соединений:
Слайд 19При окислении вторичных спиртов образуются кетоны.
4. Качественная реакция на первичные спирты!
СH3-CH2-OH
+ CuO 300°,Cu → CH3-C=O + Cu + H2O
│
H
ацетальдегид – запах листвы)
│
H
ацетальдегид – запах листвы)
Слайд 205. Горение (с увеличением массы углеводородного радикала – пламя становится всё более коптящим)
CnH2n+1-OH
+ O2 t → CO2 + H2O + Q
6. Реакции отщепления
А)Внутримолекулярная дегидратация
6. Реакции отщепления
А)Внутримолекулярная дегидратация
Слайд 21Б) Межмолекулярная дегидратация
В) Реакция дегидрирование и дегидратация предельных одноатомных спиртов – реакция С.В. Лебедева
2C2H5OH 425,ZnO,Al2O3→CH2=CH-CH=CH2 +
H2 + 2H2O
Слайд 227. Реакции этерификации
Спирты вступают в реакции с минеральными и органическими кислотами,
образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
Слайд 23Получение спиртов
I. В промышленности
1. Из водяного газа (получение метанола – древесный спирт)
CO
+ 2H2 t,p → CH3OH
2. Брожение глюкозы (получение этанола)
C6H12O6 дрожжи → 2C2H5OH + 2CO2
3. Гидратация алкенов
СH3-CH=CH2 + HOH t,kat-H3PO4→ CH3-CH-CH3 (пропанол-2)
│
OH
присоединение по правилу Марковникова
2. Брожение глюкозы (получение этанола)
C6H12O6 дрожжи → 2C2H5OH + 2CO2
3. Гидратация алкенов
СH3-CH=CH2 + HOH t,kat-H3PO4→ CH3-CH-CH3 (пропанол-2)
│
OH
присоединение по правилу Марковникова
Слайд 24II. В лаборатории
Взаимодействие галогеналканов R-Г с водными растворами щелочей
CH3Cl + NaOH t, водн.р-р.→ CH3OH + NaCl (р. обмен)
Слайд 25Строение, свойства и применение фенола
1. Фенолы - производные ароматических углеводородов, в молекулах
которых гидроксильная группа (- ОН) непосредственно связана с атомами углерода в бензольном кольце.
Слайд 262. Классификация фенолов
Различают одно-, двух-, трехатомные фенолы в зависимости от количества
ОН-групп в молекуле:
Слайд 27Токсические свойства
Фенол ядовит. Вызывает нарушение функций нервной системы. Пыль, пары и
раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу. Попадая в организм, Фенол очень быстро всасывается даже через неповрежденные участки кожи и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюхой, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Зачастую фенол является причиной онкозаболеваний.
Слайд 28Применение фенолов
1. Производство синтетических смол, пластмасс, полиамидов
2. Лекарственных препаратов
3. Красителей
4. Поверхностно-активных веществ
5. Антиоксидантов
6. Антисептиков
7. Взрывчатых веществ
Слайд 29Список литературы
Химия для профессий и специальностей естественно-научного профиля: учебник / (О.
С. Габриелян, И. Г. Остроумова, Е. Е. Остроумов, С. А. Сладков). 2012.
Габриевян О.С. химия в тестах, задачах и упражнениях: учебное пособие для студ. Учреждений сред. Проф. Образования/ о. С. Габриелян, Г. Г. Лысова. 2012 г.
https://sites.google.com/site/himulacom/zvonok-na-urok/10-klass---tretij-god-obucenia
http://files.school-collection.edu.ru/dlrstore/6e95befe-c50f-8838-b2c7-b870215a598e/1012356A.htm
Габриевян О.С. химия в тестах, задачах и упражнениях: учебное пособие для студ. Учреждений сред. Проф. Образования/ о. С. Габриелян, Г. Г. Лысова. 2012 г.
https://sites.google.com/site/himulacom/zvonok-na-urok/10-klass---tretij-god-obucenia
http://files.school-collection.edu.ru/dlrstore/6e95befe-c50f-8838-b2c7-b870215a598e/1012356A.htm








![Спирты и фенолы 3. В присутствии окислителей [O] – K2Cr2O7 или KMnO4 спирты окисляются до карбонильных соединений: 3. В присутствии окислителей [O] – K2Cr2O7 или KMnO4 спирты окисляются до карбонильных соединений:](/img/thumbs/f315eb674d266f767695d5efe10c5745-800x.jpg)