- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Соли, их классификация и химические свойства в свете ТЭД
Содержание
- 1. Соли, их классификация и химические свойства в свете ТЭД
- 2. Цели урока:* дать понятие о солях как
- 3. Что такое основание в свете теории электролитической
- 4. Задание 2. С какими из перечисленных веществ
- 5. Что такое соли?Соли – это сложные вещества, состоящие из атомов металлов, связанных с кислотными остатками.
- 6. Солями называют электролиты, которые при
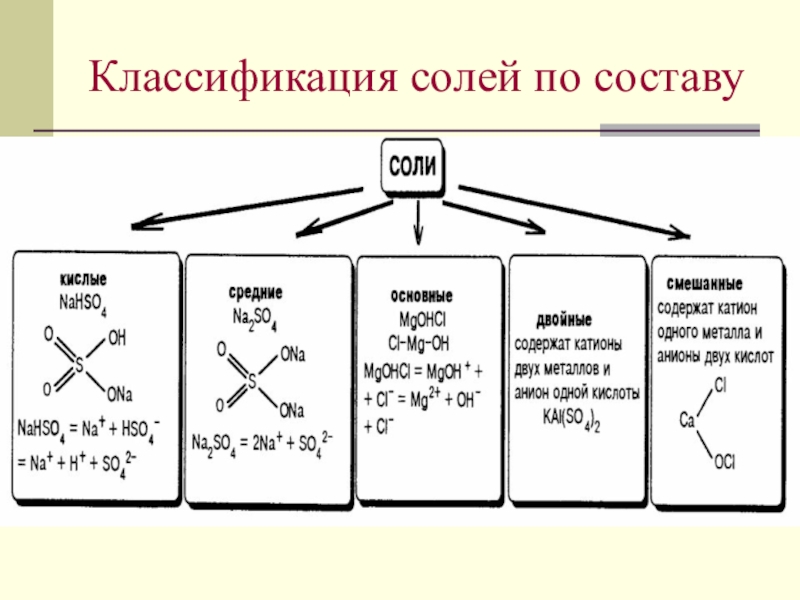
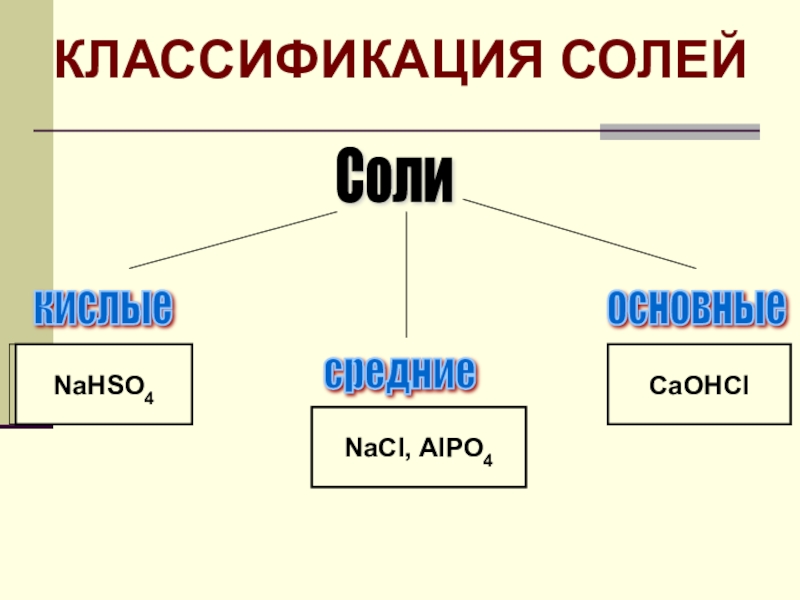
- 7. Классификация солей по составу
- 8. Соли кислые средние основные Na2SO4NaHSO4CaOHClNaHSO4NaCI, AIPO4CaOHCIКЛАССИФИКАЦИЯ СОЛЕЙ
- 9. Классификация солей:
- 10. HHSO4NaNaNa2SO4 2Na+
- 11. Название средних солей
- 12. HHSO4NaNaHSO4 Na+ +
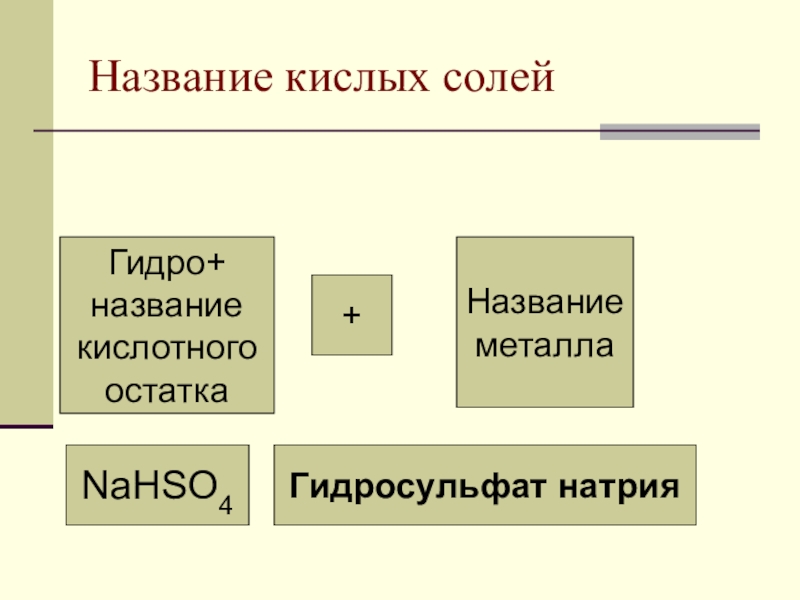
- 13. Название кислых солейГидро+названиекислотногоостатка+НазваниеметаллаNaHSO4 Гидросульфат натрияГидросульфат натрия
- 14. Как вы думаете, одинаково ли диссоциируют средние
- 15. Вывод:Средние соли (в свете теории ТЭД) –
- 16. Кислые соли диссоциируют ступенчато:Первая ступень диссоциации:NaНСO3 =Na+ +НCO3–Вторая
- 17. Вывод:Кислые соли (в свете теории ТЭД)– это
- 18. Важно!!!Таким образом, соли в отличие от кислот
- 19. Лабораторная работа3. соль +кислота = другая соль
- 20. Лабораторная работа2. соль + щелочь = другая
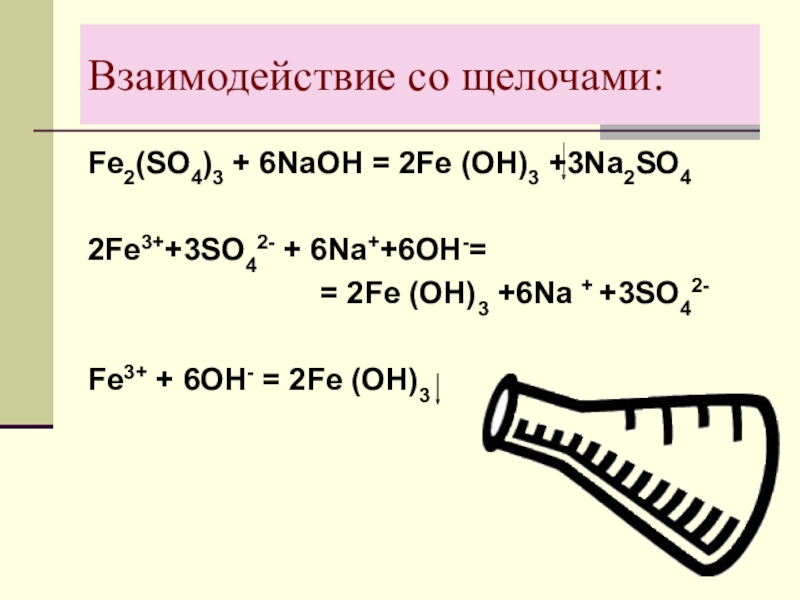
- 21. Взаимодействие со щелочами:Fе2(SО4)3 + 6NаОН = 2Fе
- 22. Лабораторная работа 4. соль + металл
- 23. Взаимодействие солей с металлами:Fе + СuSO4 =
- 24. Лабораторная работа1. соль1 + соль2 =
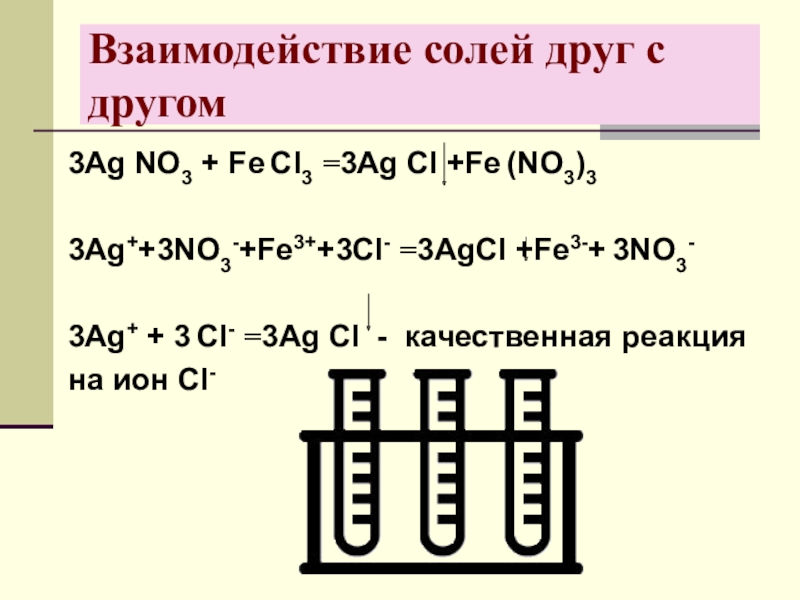
- 25. Взаимодействие солей друг с другом3Аg NО3 +
- 26. Химические свойства солей1. металл + соль →2.
- 27. Применение солей Многие соли применяют в
- 28. Домашнее задание:Учебник пар. 42 читать;Раб.тетр. стр.190-195 заполнить
Цели урока:* дать понятие о солях как классе электролитов, * рассмотреть их классификацию по составу, * охарактеризовать общие свойства солей в свете ионных представлений.
Слайд 2Цели урока:
* дать понятие о солях как классе электролитов,
* рассмотреть
их классификацию по составу,
* охарактеризовать общие свойства солей в свете ионных представлений.
* охарактеризовать общие свойства солей в свете ионных представлений.
Слайд 3Что такое основание в свете теории электролитической диссоциации?
Задание 1: Выберите
тот ряд, в котором
находятся только основания и
дайте им названия.
А) СаO, Zn(OH)2, MgCO3
В) Cr(OH)3, Al(OH)3, Сa(OH)2
С) NaOH, KOH, NH4Cl
Д) CO2, HCl, FeOHCO3
находятся только основания и
дайте им названия.
А) СаO, Zn(OH)2, MgCO3
В) Cr(OH)3, Al(OH)3, Сa(OH)2
С) NaOH, KOH, NH4Cl
Д) CO2, HCl, FeOHCO3
Слайд 4Задание 2. С какими из перечисленных веществ реагирует раствор гидроксида натрия?
1.
Гидроксид калия
2. Вода
3. Серная кислота
4. Оксид бария
5. Медь
6. Хлорид бария
7. Оксид углерода (IV)
8. Соляная кислота
9. Магний
10. Раствор фенолфталеина
2. Вода
3. Серная кислота
4. Оксид бария
5. Медь
6. Хлорид бария
7. Оксид углерода (IV)
8. Соляная кислота
9. Магний
10. Раствор фенолфталеина
Слайд 5Что такое соли?
Соли – это сложные вещества, состоящие из атомов металлов,
связанных с кислотными остатками.
Слайд 6 Солями называют электролиты, которые при диссоциации образуют катионы металлов и
катионы аммония и анионы кислотных остатков.
Слайд 9Классификация солей:
полное
замещение
замещение
Кислоты
Гидроксиды
Кислые соли
(гидросоли)
КНSO4, Ca(HSO3)2
Основные соли
(гидроксосоли)
МgOНСl,
Fe(OH)NOз
Средние
(нормальные)соли
Na2SO4, K2CO3
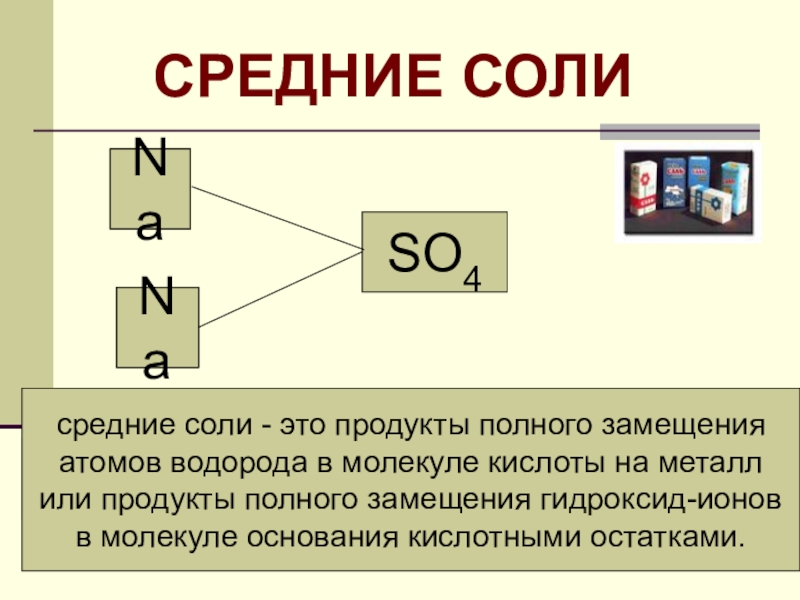
Слайд 10
H
H
SO4
Na
Na
Na2SO4 2Na+ +SO42-
средние соли - это
продукты полного замещения
атомов водорода в молекуле кислоты на металл
или продукты полного замещения гидроксид-ионов
в молекуле основания кислотными остатками.
атомов водорода в молекуле кислоты на металл
или продукты полного замещения гидроксид-ионов
в молекуле основания кислотными остатками.
СРЕДНИЕ СОЛИ
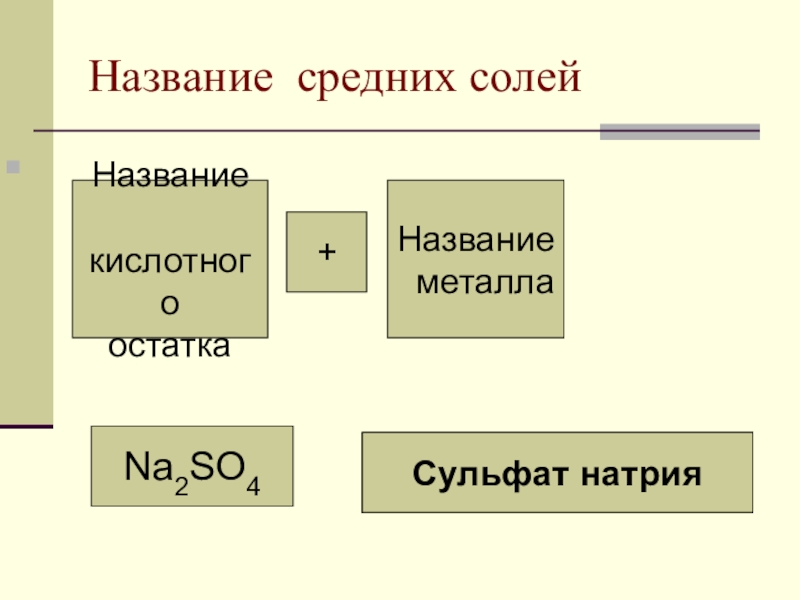
Слайд 11Название средних солей
Название
кислотного
остатка
Название
металла
+
Na2SO4
Сульфат натрия
Cульфат натрия
Слайд 12
H
H
SO4
Na
NaHSO4 Na+ + HSO4-
кислые соли – это
продукты неполного
замещения атомов водорода в
молекулах многоосновных кислот на
металл.
замещения атомов водорода в
молекулах многоосновных кислот на
металл.
КИСЛЫЕ СОЛИ
Слайд 13Название кислых солей
Гидро+
название
кислотного
остатка
+
Название
металла
NaHSO4
Гидросульфат натрия
Гидросульфат натрия
Слайд 14Как вы думаете, одинаково ли диссоциируют средние и кислые соли?
Средние соли
практически полностью диссоциируют на ионы в одну ступень:
Na2CO3 =2Na+ +CO32–
ZnSO4 =Zn2+ +SO42–
Na2CO3 =2Na+ +CO32–
ZnSO4 =Zn2+ +SO42–
Слайд 15Вывод:
Средние соли (в свете теории ТЭД) – электролиты, которые при диссоциации
образуют катионы металлов и анионы кислотных остатков.
Слайд 16Кислые соли диссоциируют ступенчато:
Первая ступень диссоциации:
NaНСO3 =Na+ +НCO3–
Вторая ступень диссоциации:
НCO3–
Н+ +CO32–
Какие ионы образуются при диссоциации кислых солей?
Какие ионы образуются при диссоциации кислых солей?
Слайд 17Вывод:
Кислые соли (в свете теории ТЭД)– это электролиты, которые при диссоциации
образуют положительно заряженные ионы металлов и водорода и отрицательно заряженные ионы кислотных остатков.
Слайд 18Важно!!!
Таким образом, соли в отличие от кислот и оснований не отщепляют
каких-либо одинаковых для всех солей ионов, поэтому у них отсутствуют общие свойства, обусловленные наличием одинаковых ионов.
Слайд 19Лабораторная работа
3. соль +кислота = другая соль + другая кислота
Условие протекания:
А) типичная реакция обмена, протекает только в том случае ,если образуется осадок или газ.
Ва(NО3)2+Н2SO4 = Ва SO4↓+2НNО3
Ва2++2NО3-+2Н++SO42- =ВаSO4↓ +2Н++2NО3-
Ва2+ + SO42- = Ва SO4↓ - качественная
реакция на катион Ва2+
Слайд 20Лабораторная работа
2. соль + щелочь = другая соль + другое основание
Условие
протекания:
А) растворы солей можно определить по цвету катиона, катионы Cu2+ придают раствору синий цвет, катионы Fe2+ - желтоватый.
Б)некоторые катионы можно обнаружить, осаждая их гидроксид ионами, при этом получаются осадки различных цветов:
Cu(OH)2 – голубой, Fe(OH)2 – болотный, Al (OH)3 – белый, желеобразный.
В) растворимые соли реагируют со щелочами сообразованием новой соли и нерастворимого основания.
А) растворы солей можно определить по цвету катиона, катионы Cu2+ придают раствору синий цвет, катионы Fe2+ - желтоватый.
Б)некоторые катионы можно обнаружить, осаждая их гидроксид ионами, при этом получаются осадки различных цветов:
Cu(OH)2 – голубой, Fe(OH)2 – болотный, Al (OH)3 – белый, желеобразный.
В) растворимые соли реагируют со щелочами сообразованием новой соли и нерастворимого основания.
Слайд 21Взаимодействие со щелочами:
Fе2(SО4)3 + 6NаОН = 2Fе (ОН)3 +3Nа2SО4
2Fе3++3SО42- +
6Nа++6ОН-=
= 2Fе (ОН)3 +6Nа + +3SО42-
Fе3+ + 6ОН- = 2Fе (ОН)3
= 2Fе (ОН)3 +6Nа + +3SО42-
Fе3+ + 6ОН- = 2Fе (ОН)3
Слайд 22Лабораторная работа
4. соль + металл = другая соль
+ другой металл
Условия протекания:
А) Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений.
Б)Обе соли( и реагирующая , и образующаяся в результате реакции) должны быть растворимыми.
В) Металлы не должны взаимодействовать с водой, поэтому металлы главных подгрупп I и II групп Периодической системы Д.И.Менделеева –щелочные и щелочноземельные –не вытесняют другие металлы из растворов солей.
Условия протекания:
А) Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений.
Б)Обе соли( и реагирующая , и образующаяся в результате реакции) должны быть растворимыми.
В) Металлы не должны взаимодействовать с водой, поэтому металлы главных подгрупп I и II групп Периодической системы Д.И.Менделеева –щелочные и щелочноземельные –не вытесняют другие металлы из растворов солей.
Слайд 23Взаимодействие солей с металлами:
Fе + СuSO4 = Fе SO4+ Cu
Fе0 +
Сu2+ + SO42- = Fе2+ + SO42-+ Cu0
Fе0 + Сu2+ = Fе2+ + Cu0
Fе0 + Сu2+ = Fе2+ + Cu0
Слайд 24Лабораторная работа
1. соль1 + соль2 = соль3 + соль4
Условие
протекания:
А) Растворы солей можно определять по аниону, для этого нужно подобрать реактив с катионом способным осадить определяемый анион.
Б) Реактивом могут быть растворимые соли.
В) Растворы солей реагируют с растворами солей, если в результате образуется осадок.
А) Растворы солей можно определять по аниону, для этого нужно подобрать реактив с катионом способным осадить определяемый анион.
Б) Реактивом могут быть растворимые соли.
В) Растворы солей реагируют с растворами солей, если в результате образуется осадок.
Слайд 25Взаимодействие солей друг с другом
3Аg NО3 + Fе Cl3 =3Аg Сl
+Fе (NО3)3
3Аg++3NО3-+Fе3++3Cl- =3АgСl +Fе3-+ 3NО3-
3Аg+ + 3 Cl- =3Аg Сl - качественная реакция
на ион Cl-
3Аg++3NО3-+Fе3++3Cl- =3АgСl +Fе3-+ 3NО3-
3Аg+ + 3 Cl- =3Аg Сl - качественная реакция
на ион Cl-
Слайд 26Химические свойства солей
1. металл + соль →
2. соль + щелочь→ ↓
или ↑
3. соль + кислота→ ↓ или ↑
4. соль + соль→ ↓
3. соль + кислота→ ↓ или ↑
4. соль + соль→ ↓
Слайд 27Применение солей
Многие соли применяют в быту (поваренная соль, сода),
в качестве минеральных удобрений, при производстве стекла, моющих средств, взрывчатых веществ.