- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Соединения азота. Оксиды азота.
Содержание
- 1. Соединения азота. Оксиды азота.
- 2. Азот Происходит от греческого слова azoos -
- 3. История азотаСоединения азота - селитра, азотная кислота,
- 4. Азот немного легче воздуха; плотность 1,2506 кг/м3
- 5. Только с такими активными металлами, как литий,
- 6. Оксиды азота
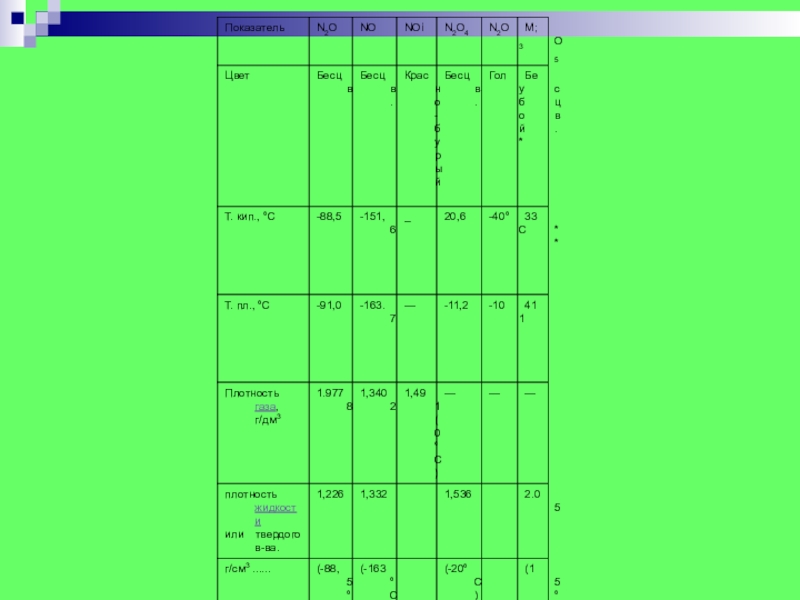
- 7. Оксид азота (I) N2O Бесцветный газ со
- 8. Оксид азота (II) NO. Бесцветный газ, запах
- 9. Оксид азота (III) N2O3. Темная сине-фиолетовая жидкость
- 10. Оксид азота (IV) NO2 Красновато-бурый, обладающий характерным
- 11. Оксид азота (V) N2O5 Азотный ангидрид. Белое
- 12. Слайд 12
- 13. Другие виды использованияТак же оксид азота N2O используют в двигателях, для временного повышения мощности
- 14. Использование закиси азота (N2O) как средства
- 15. Использование в спортеЕще оксиды азота используются в
Азот Происходит от греческого слова azoos - безжизненный, по-латыни Nitrogenium. Химический знак элемента - N. Азот - химический элемент V группы периодической системы Менделеева, порядковый номер 7, относительная атомная масса 14,0067; бесцветный газ, не имеющий запаха
Слайд 2Азот
Происходит от греческого слова azoos - безжизненный, по-латыни Nitrogenium. Химический
знак элемента - N. Азот - химический элемент V группы периодической системы Менделеева, порядковый номер 7, относительная атомная масса 14,0067; бесцветный газ, не имеющий запаха и вкуса.
Слайд 3История азота
Соединения азота - селитра, азотная кислота, аммиак - были известны
задолго до получения азота в свободном состоянии. В 1772 г. Д. Резерфорд, сжигая фосфор и другие вещества в стеклянном колоколе, показал, что остающийся после сгорания газ, названный им “удушливым воздухом”, не поддерживает дыхания и горения. В 1787 г. А. Лавуазье установил, что “жизненный” и “удушливый” газы, входящие в состав воздуха, это простые вещества, и предложил название “азот”. В 1784 г. Г. Кавендиш показал, что азот входит в состав селитры; отсюда и происходит латинское название азота (от позднелатинского nitrum - селитра и греческого gennao - рождаю, произвожу), предложенное в 1790 году Ж. А. Шапталем. К началу ХIX в. были выяснены химическая инертность азота в свободном состоянии и исключительная роль его в соединениях с другими элементами в качестве связанного азота.
Слайд 4Азот немного легче воздуха; плотность 1,2506 кг/м3 ( при 0С и
101325 н/м2 или 760 мм. рт. ст. ), tпл-209,86С, tкип-195,8С. Азот сжижается с трудом: его критическая температура довольно низка (-147,1С), а критическое давление высоко 3,39 Мн/м2 (34,6 кгс/см2);плотность жидкого азота 808 кг/м3. В воде азот менее растворим, чем кислород: при 0С в 1 м3 H2O растворяется 23,3 г азота. Лучше, чем в воде, азот растворим в некоторых углеводородах.
Слайд 5Только с такими активными металлами, как литий, кальций, магний, азот взаимодействует
при нагревании до сравнительно невысоких температур. С большинством других элементов азот реагирует при высокой температуре и в присутствии катализаторов. Хорошо изучены соединения азота с кислородом N2O, NO, N2O3, NO2 и N2O5. Из них при непосредственном взаимодействии элементов образуется окись NO, которая при охлаждении легко окисляется далее до двуокиси NO2. В воздухе оксиды азота образуются при атмосферных разрядах. Их можно получить также действием на смесь азота с кислородом ионизирующих излучений.
Соединения азота
Слайд 7Оксид азота (I) N2O
Бесцветный газ со слабым приятным запахом и
сладковатым вкусом. При вдыхании небольшого количества наблюдается характерное состояние опьянения. Поэтому N2O называют "веселящим газом". tкип=-89С, tпл=-91С. При 0С и давлении 30 атм сжижается в бесцветную жидкость, легко испаряющуюся при обычном давлении, отнимая много тепла от окружающей среды. При -102,4С затвердевает в снегообразную массу. Тяжелее воздуха. Хорошо растворяется в спирте. При высокой температуре является сильным окислителем и поддерживает горение веществ, обладающих большим химическим сродством к кислороду. Применяют в медицине как анестезирующее средство.
Слайд 8Оксид азота (II) NO.
Бесцветный газ, запах и вкус которого установить
не удается, так как при обычной температуре и давлении в соприкосновении с воздухом он окисляется до оксида азота (IV). Трудно сжижающийся газ, tкип=-152С, tпл=-164С. Ядовитый газ. Плотность относительно воздуха 1,039. Растворимость в воде относительно мала. Плохо растворяется в водном растворе поваренной соли. Водный раствор нейтрален. Обладает как окислительными, так и восстановительными свойствами. Характерными являются реакции присоединения.
Слайд 9Оксид азота (III) N2O3.
Темная сине-фиолетовая жидкость при -30С. Если ее
охладить до -102С, то она застывает, образуя кристаллы голубого цвета. tпл=101С, tкип=3С. Нагревание до -10С приводит к разложению на оксид азота (II) и оксид азота (IV). Раствор в воде при 0С окрашен в синий цвет, растворение сопровождается образованием азотистой кислоты. Получают при добавлении небольшого количества воды к жидкому и твердому оксиду азота (IV).
Слайд 10Оксид азота (IV) NO2
Красновато-бурый, обладающий характерным запахом, очень ядовитый газ.
Сильно поражает слизистые оболочки дыхательных путей и вредно действует на мышцы сердца. При охлаждении до 21,3С очень легко сгущается в красновато-бурую жидкость, которая при дальнейшем охлаждении до 10С становится желтой, а при -10,2С застывает в бесцветную кристаллическую массу. При температуре выше 140С оксид азота (IV) состоит только из молекул NO2, тогда как вблизи точки замерзания -11С она состоит исключительно из молекул N2O4, а в интервале температур от 140C до -11С мы имеем дело со смесью молекул NO2 и N2O4. Сильный окислитель. Образуется как побочный продукт при получении азотной кислоты каталитически и окислением аммиака.
Слайд 11Оксид азота (V) N2O5
Азотный ангидрид. Белое твердое вещество, бесцветный газ
и жидкость. tпл=41С [1], tкип=45С [1]. При нагревании возгоняется и плавится, при комнатной температуре разлагается за 10 часов. Проявляет кислотные свойства, реагирует с водой, щелочами, гидратом аммиака. Очень сильный окислитель.
Слайд 13Другие виды использования
Так же оксид азота N2O используют в двигателях, для
временного повышения мощности
Слайд 14 Использование закиси азота (N2O) как средства для улучшения технических характеристик,
было отмечено ещё во Второй мировой войне, где она использовалась, для того, чтобы дать авиации союзников возможность улучшения ситуации при "критическом положении" самолета, как в скорости полёта, так и в высотных показателях. Однако, с появлением реактивного двигателя в конце Второй Мировой Войны, интерес правительств к поршневым самолетам уменьшился, и по большому счёту, исследования возможностей закиси азота были отложены.
Предпринимались попытки использования закиси азота в гоночных автомобилях в течение нескольких следующих десятилетий, но, поскольку это была закрытая отрасль исследований, не слишком много людей знало о ее существовании.
Наконец, в 1970-ых, исследования возможностей закиси азота "достали с полок". Это была горячая тема для разговоров. Особенно, поскольку многие предприниматели представили на рынок системы, которые в лучшем случае были крайне нестабильны. Это как раз было то время, когда несколько успешных автомобильных техников и гонщиков, таких как Mike Thermos и Dale Vaznaian заметили, что исследования закиси азота имеют право на существование.
В 1978 Mike и Dale зарегистрировали "Nitrous Oxide Systems, Inc", и тем самым остались в истории. Они не изобретали закись азота - они просто усовершенствовали ее использование и подняли его до доминирующих позиций в отрасли автомобильных технологий.
Сегодня, с более чем двадцатилетним опытом создания систем закиси азота для гонок и для обычного уличного использования, NOS остаются лидирующим производителем в данной отрасли. Большой успех компании является результатом постоянного стремления к дальнейшему совершенствованию. Другой ключевой фактор - отношения, которые NOS поддерживает с ведущими гонщиками и профессиональными авто производителями. Их вклад служит тому, что компания играет лидирующую роль в развитии технологии закиси азота.
В 2002 году NOS представили системы NOSzle для автомобилей EFI. Этот проект произвел революцию в производстве систем закиси азота. стоит добавить, что системы бывают двух типов «мокрая» и «сухая», разница заключается в том, что в «мокрой» системе закись азота во впускном коллекторе перед подачей в цилиндры перемешивается с топливом.
Предпринимались попытки использования закиси азота в гоночных автомобилях в течение нескольких следующих десятилетий, но, поскольку это была закрытая отрасль исследований, не слишком много людей знало о ее существовании.
Наконец, в 1970-ых, исследования возможностей закиси азота "достали с полок". Это была горячая тема для разговоров. Особенно, поскольку многие предприниматели представили на рынок системы, которые в лучшем случае были крайне нестабильны. Это как раз было то время, когда несколько успешных автомобильных техников и гонщиков, таких как Mike Thermos и Dale Vaznaian заметили, что исследования закиси азота имеют право на существование.
В 1978 Mike и Dale зарегистрировали "Nitrous Oxide Systems, Inc", и тем самым остались в истории. Они не изобретали закись азота - они просто усовершенствовали ее использование и подняли его до доминирующих позиций в отрасли автомобильных технологий.
Сегодня, с более чем двадцатилетним опытом создания систем закиси азота для гонок и для обычного уличного использования, NOS остаются лидирующим производителем в данной отрасли. Большой успех компании является результатом постоянного стремления к дальнейшему совершенствованию. Другой ключевой фактор - отношения, которые NOS поддерживает с ведущими гонщиками и профессиональными авто производителями. Их вклад служит тому, что компания играет лидирующую роль в развитии технологии закиси азота.
В 2002 году NOS представили системы NOSzle для автомобилей EFI. Этот проект произвел революцию в производстве систем закиси азота. стоит добавить, что системы бывают двух типов «мокрая» и «сухая», разница заключается в том, что в «мокрой» системе закись азота во впускном коллекторе перед подачей в цилиндры перемешивается с топливом.
Слайд 15Использование в спорте
Еще оксиды азота используются в спорте, в качестве пищевых
добавок. Они входят в состав энергетических напитков, протеиновых батончиков и анаболиков.










![Соединения азота. Оксиды азота. Оксид азота (V) N2O5 Азотный ангидрид. Белое твердое вещество, бесцветный газ Оксид азота (V) N2O5 Азотный ангидрид. Белое твердое вещество, бесцветный газ и жидкость. tпл=41С [1], tкип=45С [1].](/img/thumbs/84d24121f9a90388cd30891230c730e3-800x.jpg)