- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Разработка урока и презентация по химии на тему: серная кислота
Содержание
- 1. Разработка урока и презентация по химии на тему: серная кислота
- 2. «Химии никоим образом научиться невозможно, не видав
- 3. Тема урока: Серная кислота и ее
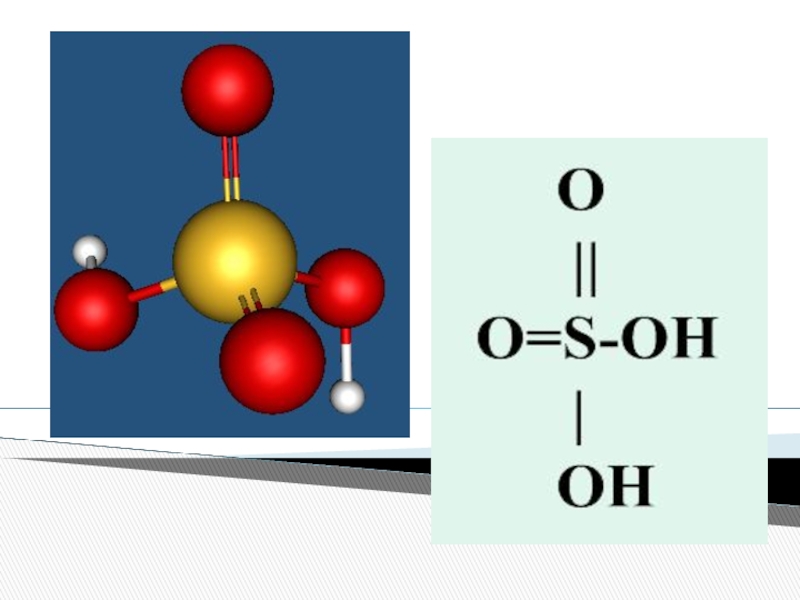
- 4. Серная кислота
- 5. Слайд 5
- 6. Правило разбавления кислотСначала вода, потом кислота – иначе случится большая беда!
- 7. Диссоциация:
- 8. Улица Индикаторная
- 9. Улица ОксиднаяОксид меди (II)Оксид кремния
- 10. Взаимодействие с оксидамиCuO + H2SO4 →CuSO4 + H2OSiO2 + H2SO4 →
- 11. 2NaOH + H2SO4 → Na2SO4 +2 H2OZnCL2
- 12. Слайд 12
- 13. Улица металлическая
- 14. Взаимодействие с металлами Cu + H2SO4 → Mg + H2SO4 →MgSO4 + H2↑
- 15. Улица солей
- 16. H2SO4+BaCI2 =2H+ + SO42- +Ba2+ + 2CI-
- 17. Серная кислота – мать всех кислот
- 18. Действие серной концентрированной кислоты на органические вещества( C6H10O5)n + H2SO4 = 6nC + 5nH2SO4 * H2O
- 19. Ювелирный магазин
- 20. Взаимодействие серной кислоты с медьюCu + H2SO4
- 21. Окислительные свойства концентрированной H2SO4
- 22. Взаимодействие серной кислоты с золотомAu + H2SO4 →
- 23. Металлы, пассивирующие серную кислоту: Fe, Cr, Au, Pt, Al
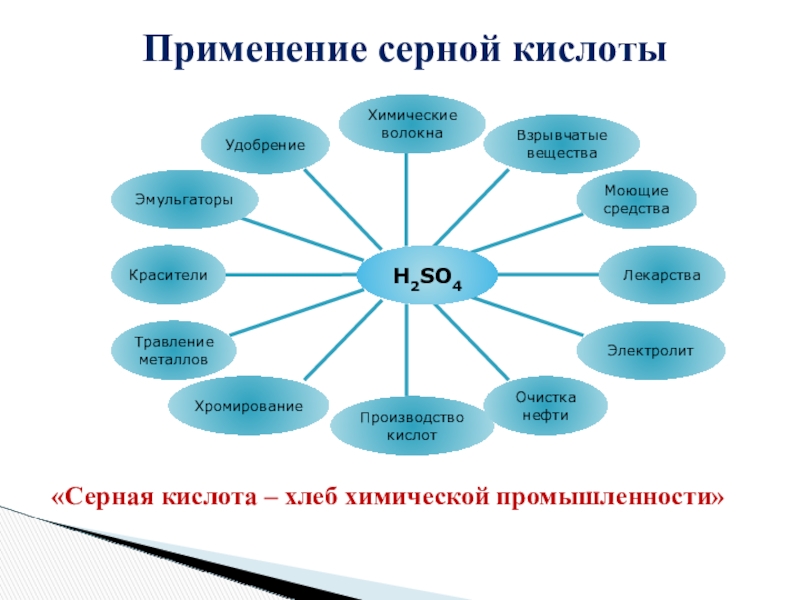
- 24. Применение серной кислоты«Серная кислота – хлеб химической промышленности»
- 25. Ответы 1 вариант
- 26. Домашнее задание 1) Прочитать § 13, конспект
- 27. «Неусыпный труд все препятствия преодолевает» М. В. Ломоносов
Слайд 1Гурская Ольга Кирилловна, учитель химиии МБОУ «КПоспелихинская
Слайд 2«Химии никоим образом научиться невозможно, не видав самой практики и не
Слайд 3Тема урока:
Серная кислота и ее свойства
Я растворю любой металл.
Меня
Слайд 112NaOH + H2SO4 → Na2SO4 +2 H2O
ZnCL2 + 2NaOH → Zn(OH)2
Zn(OH)2 + H2SO4 → ZnSO4 +2H2O
Дворец оснований
Ca(OH)2
NaOH
Zn(OH)2
Слайд 16
H2SO4+BaCI2 =
2H+ + SO42- +Ba2+ + 2CI- = BaSO4 + 2H+
Ba2++SO42- = BaSO4
Качественная реакция
Na2CO3 + H2SO4 =
2Na++CO32- +2H++SO42-→2Na++SO42- +CO2↑+ H2O
2H++ CO32- = CO2 ↑ + H2O
Взаимодействие с солями
CO2↑
H2O
BaSO4 + 2HCI
Na2SO4 + H2CO3
Слайд 18Действие серной концентрированной кислоты на органические вещества
( C6H10O5)n + H2SO4 =
Слайд 20Взаимодействие серной кислоты с медью
Cu + H2SO4 → SO2 + CuSO4
Cu0 + H+2S+6O4 → S+4O-22 + Cu+2S+6O-24 + H+2О-2
Cu0 - 2е → Cu+2 2 1 окисление
S+6 + 2е→ S+4 2 1 восстановление
Cu0 + 2H2S+6O4 → S+4O2 + Cu+2SO4 + 2H2О
Вывод: окислитель H2SO4 (S+6)
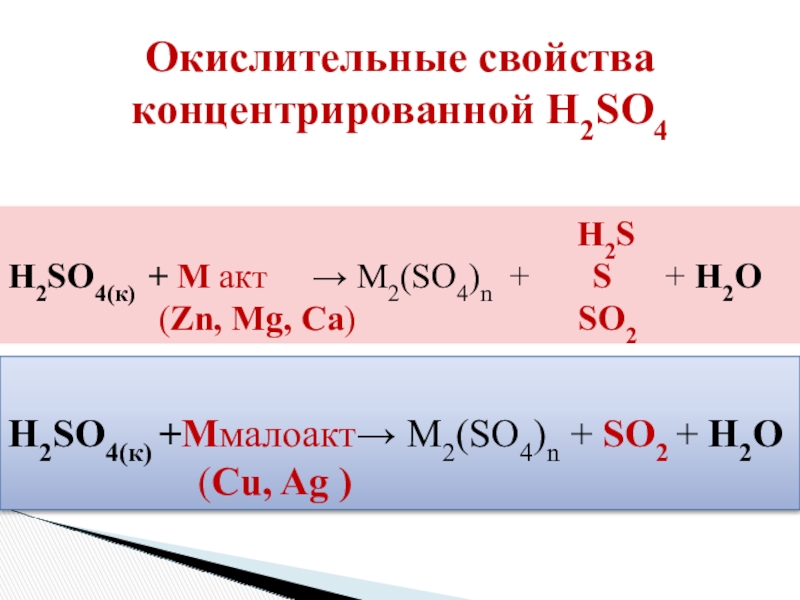
Слайд 21Окислительные свойства концентрированной H2SO4
H2SO4(к) + M акт → M2(SO4)n + S + H2O
(Zn, Mg, Ca) SO2
H2SO4(к) +Mмалоакт→ M2(SO4)n + SO2 + H2O
(Cu, Ag )