- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад урока-путешествия по химии для 8 класса на тему Типы химических реакций
Содержание
- 1. Презентация урока-путешествия по химии для 8 класса на тему Типы химических реакций
- 2. Цель и задачи Повторить, обобщить и оценить
- 3. «Собери рюкзак» (фронтальный опрос) Какие
- 4. «Немые» схемы. 1. +
- 5. Остановка «Гора реакций» Задание: Разделите уравнения химических
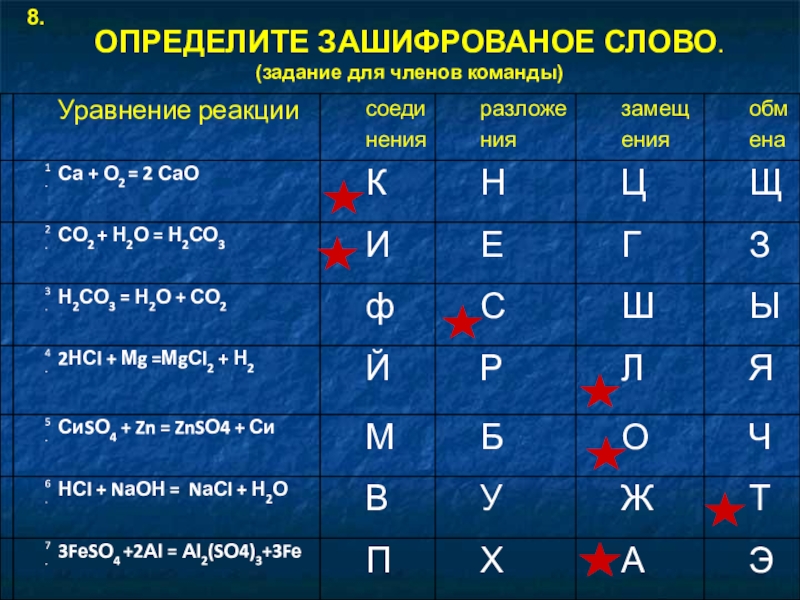
- 6. ОПРЕДЕЛИТЕ ЗАШИФРОВАНОЕ СЛОВО. (задание для членов команды)8.
- 7. Остановка «Гора реакций» Задание: Разделите уравнения химических
- 8. Остановка «Река реакций» Задание: Дописать уравнения химических
- 9. Остановка «Река реакций» Задание: Дописать уравнения химических
- 10. Остановка «Остров удачи»Задание для капитанов.(Задача)Составить алгоритм решения и уравнение реакции к данной задачи.
- 11. Задание для команд.«Массу измеряют в миллиграммах,…, килограммах,
- 12. Задание для команд. (проверка)«Массу измеряют в миллиграммах,
- 13. Остановка «Остров удачи»Задание для капитанов.
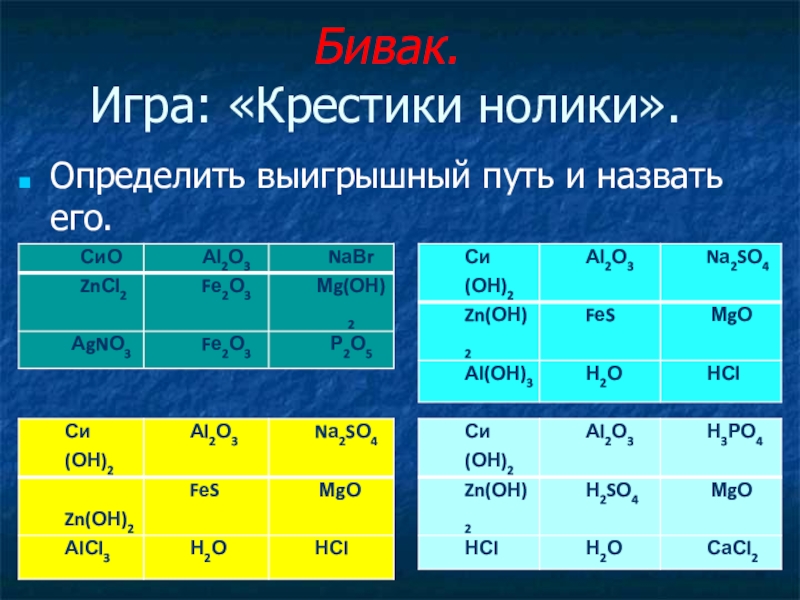
- 14. Бивак.
- 15. Игра: «Крестики нолики». (проверка)
- 16. Игра «Найди свою пару» Начало реакции: (исходные
- 17. Игра «Найди свою пару» (проверка)Начало реакции: (исходные
- 18. УСПЕХОВ.« Дорога домой» Проверочное тестирование.
- 19. Путевые заметки.Уважаемые туристы наше путешествие подошло к
- 20. Список используемой литературы:1. Личностно – ориентированный подход
Слайд 1Тема урока:
«Типы химических реакций».
(урок - путешествие)
Учитель химии: Толстихина Надежда Михайловна
МОУ «Школа
город Н. Новгород
2015 год.
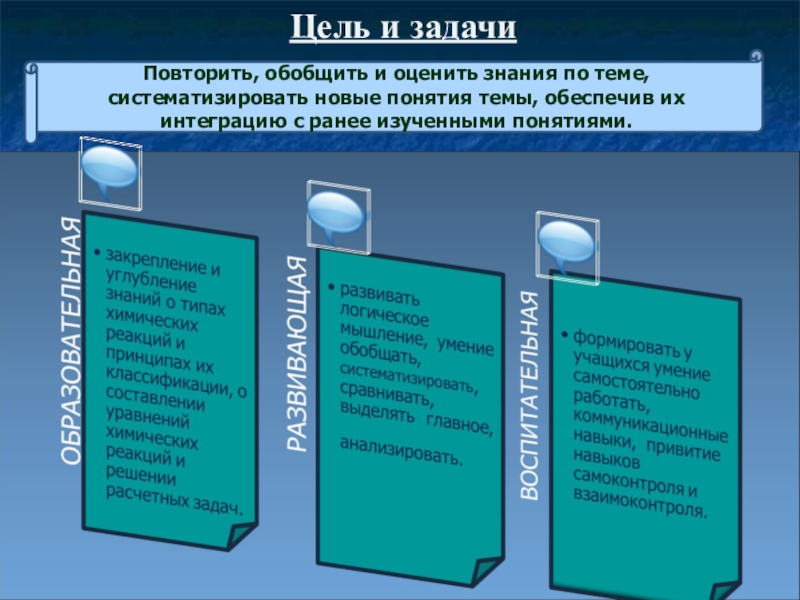
Слайд 2Цель и задачи
Повторить, обобщить и оценить знания по теме, систематизировать
Слайд 3«Собери рюкзак»
(фронтальный опрос)
Какие бывают явления?
Дайте определение физическим явлениям.
Перечислите признаки химических реакций.
По каким признакам классифицируют химические реакции?
Какие реакции называются экзотермическими?
Какие реакции называются эндотермическими?
Дайте определение реакциям соединения.
Дайте определение реакциям разложения.
Дайте определение реакциям замещения.
Дайте определение реакциям обмена.
Дайте определение реакциям горения.
О чем гласит закон сохранения массы веществ?
Что такое коэффициент?
Слайд 4«Немые» схемы.
1. +
р. соединения
2. = +
р. разложения
3. + = +
р. замещения
4. + = +
р. обмена
Определи маршрут
Слайд 5Остановка «Гора реакций» Задание: Разделите уравнения химических реакций на две группы. (2 ученика
С + О2 = СО2 + Q
2 H2О = 2 Н2 + О2 – Q
CаО + Н2О = Са(ОН)2 + Q
2 НgО = 2 Нg + О2 – Q
СО2 + С = 2 СО – Q
2HCl + Zn = ZnCl2 + H2 +Q
Слайд 7Остановка «Гора реакций»
Задание: Разделите уравнения химических реакций на две группы.
(проверка)
С +
2 H2О = 2 Н2 + О2 – Q
CаО + Н2О = Са(ОН)2 + Q
2 НgО = 2 Нg + О2 – Q
СО2 + С = 2 СО – Q
2HCl + Zn = ZnCl2 + H2 +Q
Экзотермическая
Эндотермическая
Экзотермическая
Эндотермическая
Эндотермическая
Экзотермическая
Слайд 8Остановка «Река реакций»
Задание: Дописать уравнения химических реакций, определить тип.
МgСl2 +
Мg + Н2SО4 =
Са(ОН)2 + НCl =
Аl + О2 =
Аl(ОН)3 =
Fе + S =
Слайд 9Остановка «Река реакций»
Задание: Дописать уравнения химических реакций, определить тип.
(проверка)
МgСl2+2 NаОН=2
Мg + Н2SО4 = МgSО4 + Н2 (замещения)
Са(ОН)2 + 2 НCl = СаСl2 + Н2О (обмена)
4 Аl + 3 О2 = 2 Аl2О3 (соединения)
Аl(ОН)3 = Аl2О3 + Н2О (разложения)
Fе + S = FеS (соединения)
Слайд 10Остановка «Остров удачи»
Задание для капитанов.
(Задача)
Составить алгоритм решения
и уравнение реакции к
Слайд 11Задание для команд.
«Массу измеряют в миллиграммах,…, килограммах, объем в …, …,метрах
Слайд 12Задание для команд.
(проверка)
«Массу измеряют в миллиграммах, граммах, килограммах, объем в миллилитрах,
Слайд 13Остановка «Остров удачи»
Задание для капитанов.
Задача.
Какой объем углекислого газа выделится при взаимодействии 15г карбоната натрия, содержащего 10% примесей, с избытком соляной кислоты.
Схема
m(см) × w(в-ва):100% n = m : М метод. рассужд. V = n × Vm
m(см)------------------------> m(в-ва) ----------> n(в-ва) ---------------> n (прод.) -------------> V(прод.)
Nа2СО3 + 2 НСl = 2 NаСl + СО2 + Н2О
Слайд 15Игра: «Крестики нолики».
(проверка)
Определить выигрышный
оксиды основания
соли кислоты
Слайд 16Игра «Найди свою пару»
Начало реакции: (исходные вещества)
К + Н2О =
SО2
ZnО + НСl =
Сu(ОН)2 + Н2SО4 =
Zn + НСl =
К2О + Н2О =
Окончание реакции:
(продукты реакции)
КОН
ZnСl2 + Н2
Н2SО4
ZnСl2 + Н2О
Н2SО3
CuSО4 + Н2О
КОН + Н2
:
Слайд 17Игра «Найди свою пару»
(проверка)
Начало реакции: (исходные вещества)
К + Н2О =
SО2 +
ZnО + НСl =
Сu(ОН)2 + Н2SО4 =
Zn + НСl =
К2О + Н2О =
Окончание реакции:
(продукты реакции)
КОН + Н2
Н2SО3
ZnСl2 + Н2О
CuSО4 + Н2О
ZnСl2 + Н2
КОН
Слайд 19Путевые заметки.
Уважаемые туристы наше путешествие подошло к концу. Спасибо вам за
Повторить § 29-32; упр.3, 4 с. 173.
Слайд 20Список используемой литературы:
1. Личностно – ориентированный подход в работе педагога под
2.Настольная книга учителя химии 8 класс.
Под ред. О.С. Габриелян и др., издательство «Дрофа», Москва – 2003.
3. Программа Курса химии для 8 – 11 классов общеобразовательных учреждений. Издательство «Дрофа», 2009. Составитель О.С.Габриелян.
4. Учебник: О.С. Габриелян, Химия 8 класс, изд. «Дрофа»- 2009
5.
Особенности обучения и психического развития школьников 11-17 лет М.: 1988 г. /под ред. Дубровиной. Автор: Логинова Г.П.
6.Мастер-класс учителя химии. Издательство «Дрофа» Серия «Современная школа»