Ш.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад урока по химии Комплексные соединения
Содержание
- 1. Презентация урока по химии Комплексные соединения
- 2. Цель урока: Формирование представлении о строении комплексных
- 3. План урокаСтроение комплексных соединений Классификация Номенклатура Химические свойстваСпособы полученияРоль комплексных соединенийЗакрепление Домашнее задание
- 4. .
- 5. Комплексные соединения
- 6. Координационная теория А.ВернераВ 1893 г. швейцарским химиком-неоргаником
- 7. Строение комплексных соединений Na3[Al(OH)6][Cu(NH3)4]SO4Внешняя сфераВнутренняя сфераВнутренняя сфераВнешняя сфера
- 8. Строение комплексных соединенийK3[Fe(CN)6]комплексообразовательКоординационное числолиганда
- 9. Строение коплексных соединений
- 10. Строение комплексных соединений Определите комплексооброзователь, лиганду и координациооное число в следующих соединениях:[Cu(NH3)4](OH)2Na[AL(OH) 4] K4[Fe2+(CN)6][Ag(NH3)2]CL H[AuCl4]
- 11. Классификация и номенклатура комплексных соединенийПо составу:
- 12. Классификация и номенклатура комплексных соединений
- 13. Решите следующие заданияОпределить степень окисления иона-комплексообразователя:
- 14. Ответ: 1. Степень окисления иона-комплексообразователя
- 15. Химические свойстваВ воде они диссоциируют на внешнюю
- 16. Химические свойства1. Действие сильными кислотами:Na[Al(OH)4] + 4HCl =
- 17. Химические свойства4. Действием солей образованных сильными
- 18. Способы полученияДействием щелочей на амфотерные гидроксиды:KOH +
- 19. Способы полученияВзаимодействие металлов побочных подгрупп с аммиаком,
- 20. Роль комплексных соединенийКомплексные соединения важнейшими органическими соединениями
- 21. Закрепление Закончите уравнения реакций: K2[Zn(OH)4] + HBr
Цель урока: Формирование представлении о строении комплексных соединений; Рассмотреть классифификацию комплксных соединений и основы номенклатуры;Рассмотреть химические свойства и способы получения комплексных солей.
Слайд 2Цель урока:
Формирование представлении о строении комплексных соединений;
Рассмотреть классифификацию
комплксных соединений и основы номенклатуры;
Рассмотреть химические свойства и способы получения комплексных солей.
Рассмотреть химические свойства и способы получения комплексных солей.
Слайд 3План урока
Строение комплексных соединений
Классификация
Номенклатура
Химические свойства
Способы получения
Роль комплексных соединений
Закрепление
Домашнее задание
Слайд 6Координационная теория А.Вернера
В 1893 г. швейцарским химиком-неоргаником Альфредом Вернером (1866–1919) была
сформулирована теория, позволившая понять строение и некоторые свойства комплексных соединений и названная координационной теорией.
Слайд 7Строение комплексных соединений
Na3[Al(OH)6]
[Cu(NH3)4]SO4
Внешняя сфера
Внутренняя сфера
Внутренняя сфера
Внешняя сфера
Слайд 10Строение комплексных соединений
Определите комплексооброзователь, лиганду и координациооное число в следующих
соединениях:
[Cu(NH3)4](OH)2
Na[AL(OH) 4]
K4[Fe2+(CN)6]
[Ag(NH3)2]CL
H[AuCl4]
[Cu(NH3)4](OH)2
Na[AL(OH) 4]
K4[Fe2+(CN)6]
[Ag(NH3)2]CL
H[AuCl4]
Слайд 11Классификация и номенклатура комплексных соединений
По составу:
По заряду внутренней сферы:
Соли - K3[Fe(CN)6] а) катионные - [Cu(NH3)4]SO4
Основания - [Ag(NH3)2]OH б) Анионые – K2[Zn(OH)4].
Кислоты - H[AuCl4
По типу координируемых лиганд:
Аквакомплексы – [Al(H2O)6]Cl3
б) Гидроксокомплексы – Na[Al(OH)4]
в) Аммиакаты – [Cu(NH3)4]SO4
г) Ацидокомплексы – K4[Fe(CN)6]
Соли - K3[Fe(CN)6] а) катионные - [Cu(NH3)4]SO4
Основания - [Ag(NH3)2]OH б) Анионые – K2[Zn(OH)4].
Кислоты - H[AuCl4
По типу координируемых лиганд:
Аквакомплексы – [Al(H2O)6]Cl3
б) Гидроксокомплексы – Na[Al(OH)4]
в) Аммиакаты – [Cu(NH3)4]SO4
г) Ацидокомплексы – K4[Fe(CN)6]
Слайд 13Решите следующие задания
Определить степень окисления иона-комплексообразователя:
[Ag(NH3)2]OH
Дайте название
следующим комплексам:
а) [Cu(H2O)4](NO3)2; б) К3 [Со(NО3)6].
3. Составьте формулы комплексных солей на основании их следующих названий:
а) сульфат гексааквамарганца(II)
б) гидроксид диамминсеребра(I)
в) дицианоаргентат (I) натрия
а) [Cu(H2O)4](NO3)2; б) К3 [Со(NО3)6].
3. Составьте формулы комплексных солей на основании их следующих названий:
а) сульфат гексааквамарганца(II)
б) гидроксид диамминсеребра(I)
в) дицианоаргентат (I) натрия
Слайд 14 Ответ:
1. Степень окисления иона-комплексообразователя в комплексном ионе [Ag(NH3)2]OH
– комплексообразователь Ag+ степень окисления - +1.
2. Попытайтесь дать название следующим комплексам: [Cu(H2O)4](NO3)2 –нитрат тетраамминмеди (II)
К3 [Со(NО3)6] - гексанитрокобальтат (III) калия.
3. Составьте формулы комплексных солей на основании их следующих названий:
а) [Mn(H2O)6] SO4 - сульфат гексааквамарганца(II)
б) [Ag(NH3)2]OH - гидроксид диамминсеребра(I)
в) Na[Ag(CN)2] - дицианоаргентат(I) натрия.
2. Попытайтесь дать название следующим комплексам: [Cu(H2O)4](NO3)2 –нитрат тетраамминмеди (II)
К3 [Со(NО3)6] - гексанитрокобальтат (III) калия.
3. Составьте формулы комплексных солей на основании их следующих названий:
а) [Mn(H2O)6] SO4 - сульфат гексааквамарганца(II)
б) [Ag(NH3)2]OH - гидроксид диамминсеребра(I)
в) Na[Ag(CN)2] - дицианоаргентат(I) натрия.
Слайд 15Химические свойства
В воде они диссоциируют на внешнюю сферу и комплексный ион:
K3[Fe(CN)6] = 3K+ + [Fe(CN)6]-3.
Важнейшим свойством комплексов в растворах является их устойчивость. Количественно она характеризуется константой устойчивости. Внутренняя сфера комплекса в незначительной степени подвергается электролитической диссоциации, распадаясь на комплексообразователь и лиганды, например:
[Fe(CN)6]3- = Fe3+ + 6CN-.
Отношение концентрации недиссоциированного комплекса к произведению концентраций комплексообразователя и лигандов называется константой устойчивости, а обратная ей величина – константой нестойкости:
Чем больше константа устойчивости и чем меньше константа нестойкости, тем прочнее комплекс.
Важнейшим свойством комплексов в растворах является их устойчивость. Количественно она характеризуется константой устойчивости. Внутренняя сфера комплекса в незначительной степени подвергается электролитической диссоциации, распадаясь на комплексообразователь и лиганды, например:
[Fe(CN)6]3- = Fe3+ + 6CN-.
Отношение концентрации недиссоциированного комплекса к произведению концентраций комплексообразователя и лигандов называется константой устойчивости, а обратная ей величина – константой нестойкости:
Чем больше константа устойчивости и чем меньше константа нестойкости, тем прочнее комплекс.
Слайд 16Химические свойства
1. Действие сильными кислотами:
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 +
4H2O
( избыток)
Na[Al(OH)4] + HCl = NaCl + Al(OH)3 + 4H2O
(недостаток)
2. Действие слабыми кислотами:
Na[Al(OH)4] + H2S = NaHS + Al(OH)3 + 4H2O
3. Действием углекислого и сернистого газа с образованием кислых солей.
Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3
( избыток)
Na[Al(OH)4] + HCl = NaCl + Al(OH)3 + 4H2O
(недостаток)
2. Действие слабыми кислотами:
Na[Al(OH)4] + H2S = NaHS + Al(OH)3 + 4H2O
3. Действием углекислого и сернистого газа с образованием кислых солей.
Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3
Слайд 17Химические свойства
4. Действием солей образованных сильными кислотами с амфотерными катионами
протекают с усилением гидролиза:
Na[Al(OH)4] + FeCl3 = Al(OH)3 + Fe(OH)3 + 3NaCl
5. Разложение гидросокомплексов щелочных металлов путем нагревания:
Na[Al(OH)4] = NaAlO2 + 2H2O
Na[Al(OH)4] + FeCl3 = Al(OH)3 + Fe(OH)3 + 3NaCl
5. Разложение гидросокомплексов щелочных металлов путем нагревания:
Na[Al(OH)4] = NaAlO2 + 2H2O
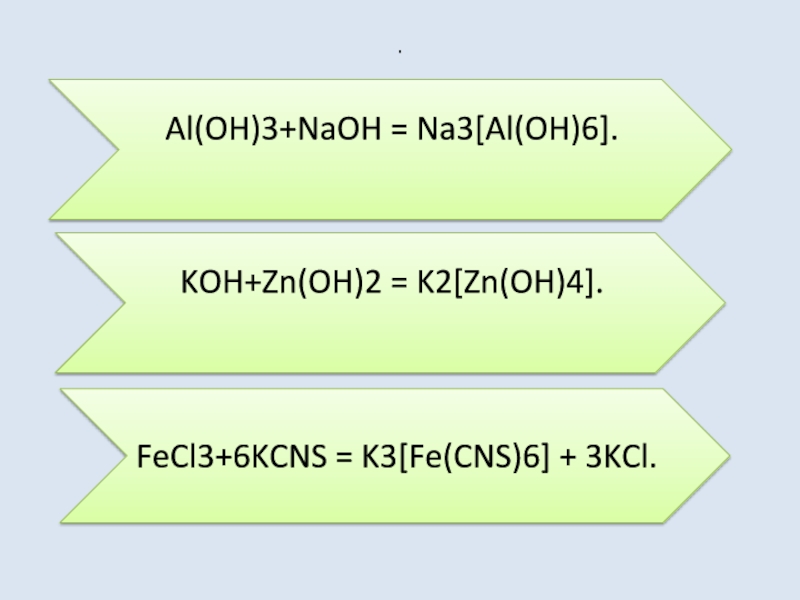
Слайд 18Способы получения
Действием щелочей на амфотерные гидроксиды:
KOH + Zn(OH)2 = K2[Zn(OH)4].
Амфотерные гидроксиды
с щелочами образуют комплексы, но и сами амфотерные металлы, их оксиды, а также их соли:
Zn + 2 NaOH +2H2O = Na2[Zn(OH)4] + H2↑
ZnO + 2KOH + H2O = K2[Zn(OH)4]
ZnCl2 + 4NaOH = Na2[Zn(OH)4] + 2NaCl
FeCl2 + 6KCN = K4[Fe(CN)4] + 2KCl
Zn + 2 NaOH +2H2O = Na2[Zn(OH)4] + H2↑
ZnO + 2KOH + H2O = K2[Zn(OH)4]
ZnCl2 + 4NaOH = Na2[Zn(OH)4] + 2NaCl
FeCl2 + 6KCN = K4[Fe(CN)4] + 2KCl
Слайд 19Способы получения
Взаимодействие металлов побочных подгрупп с аммиаком, цианидами и родонидами, является
еще одним способом получения комплексных солей.
CuSO4 + 4NH3 = [Cu(NH3)4]SO4
Cu + 6KCN + 2H2O = 2K[Cu(CN)2] + H2↑ + 2KOH
FeCl3 + 6KCNS = K3[Fe(CNS)6] + 3KCl.
CuSO4 + 4NH3 = [Cu(NH3)4]SO4
Cu + 6KCN + 2H2O = 2K[Cu(CN)2] + H2↑ + 2KOH
FeCl3 + 6KCNS = K3[Fe(CNS)6] + 3KCl.
Слайд 20Роль комплексных соединений
Комплексные соединения важнейшими органическими соединениями как гемоглобин и хлорофилл
жизненно необходим для живых существ, также входят в состав витаминов и лекарственных средств.
Немаловажное значение комплексы играют и в промышленности так как с их помощью высвобождают из руд металлы путем образования комплексов.
Комплексы обладают высокой каталитической активностью в связи с чем, из них получают лаки, краски, фотоматериаллы.
И конечно же нельзя не сказать о роли комплексных солей в аналитической химии как индикаторов.
Немаловажное значение комплексы играют и в промышленности так как с их помощью высвобождают из руд металлы путем образования комплексов.
Комплексы обладают высокой каталитической активностью в связи с чем, из них получают лаки, краски, фотоматериаллы.
И конечно же нельзя не сказать о роли комплексных солей в аналитической химии как индикаторов.
Слайд 21Закрепление
Закончите уравнения реакций:
K2[Zn(OH)4] + HBr =
(избыток)
K2[Zn(OH)4] + HBr =
(недостаток)
t
3. K3[Cr(OH)6] =
K2[Zn(OH)4] + HBr =
(недостаток)
t
3. K3[Cr(OH)6] =





![Презентация урока по химии Комплексные соединения Строение комплексных соединений Na3[Al(OH)6][Cu(NH3)4]SO4Внешняя сфераВнутренняя сфераВнутренняя сфераВнешняя сфера Строение комплексных соединений Na3[Al(OH)6][Cu(NH3)4]SO4Внешняя сфераВнутренняя сфераВнутренняя сфераВнешняя сфера](/img/thumbs/4cb50bcc788c9cff5c179d8854038a5c-800x.jpg)
![Презентация урока по химии Комплексные соединения Строение комплексных соединенийK3[Fe(CN)6]комплексообразовательКоординационное числолиганда Строение комплексных соединенийK3[Fe(CN)6]комплексообразовательКоординационное числолиганда](/img/thumbs/f253b2447ed34515d6844a22e47424b5-800x.jpg)

2Na[AL(OH) 4] K4[Fe2+(CN)6][Ag(NH3)2]CL H[AuCl4] Строение комплексных соединений Определите комплексооброзователь, лиганду и координациооное число в следующих соединениях:[Cu(NH3)4](OH)2Na[AL(OH) 4] K4[Fe2+(CN)6][Ag(NH3)2]CL H[AuCl4]](/img/thumbs/686a74d2b45e6fa9cee90c3b8bf29f66-800x.jpg)


![Презентация урока по химии Комплексные соединения Решите следующие заданияОпределить степень окисления иона-комплексообразователя: [Ag(NH3)2]OHДайте название следующим комплексам: Решите следующие заданияОпределить степень окисления иона-комплексообразователя: [Ag(NH3)2]OHДайте название следующим комплексам: а) [Cu(H2O)4](NO3)2;](/img/thumbs/ba8c5808575b6eff0ccef8b3bb1df350-800x.jpg)
![Презентация урока по химии Комплексные соединения Ответ: 1. Степень окисления иона-комплексообразователя в комплексном ионе [Ag(NH3)2]OH – Ответ: 1. Степень окисления иона-комплексообразователя в комплексном ионе [Ag(NH3)2]OH – комплексообразователь Ag+ степень окисления -](/img/thumbs/f04adafd8f600abfe748b79530a72db4-800x.jpg)
![Презентация урока по химии Комплексные соединения Химические свойстваВ воде они диссоциируют на внешнюю сферу и комплексный ион: Химические свойстваВ воде они диссоциируют на внешнюю сферу и комплексный ион: K3[Fe(CN)6] = 3K+ +](/img/thumbs/c8386e50f873e754706568ce770349a3-800x.jpg)
![Презентация урока по химии Комплексные соединения Химические свойства1. Действие сильными кислотами:Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + Химические свойства1. Действие сильными кислотами:Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + 4H2O](/img/thumbs/d4ec0a65a5c7043ef534f4bd80595708-800x.jpg)
![Презентация урока по химии Комплексные соединения Химические свойства4. Действием солей образованных сильными кислотами с амфотерными катионами протекают Химические свойства4. Действием солей образованных сильными кислотами с амфотерными катионами протекают с усилением гидролиза:Na[Al(OH)4] + FeCl3](/img/tmb/4/348051/39d29c14f2dcbaa688de60f8d2df5da7-800x.jpg)
![Презентация урока по химии Комплексные соединения Способы полученияДействием щелочей на амфотерные гидроксиды:KOH + Zn(OH)2 = K2[Zn(OH)4].Амфотерные гидроксиды Способы полученияДействием щелочей на амфотерные гидроксиды:KOH + Zn(OH)2 = K2[Zn(OH)4].Амфотерные гидроксиды с щелочами образуют комплексы, но и](/img/thumbs/5f198921a741dbb0cb80ae11baf6a40d-800x.jpg)


![Презентация урока по химии Комплексные соединения Закрепление Закончите уравнения реакций: K2[Zn(OH)4] + HBr = Закрепление Закончите уравнения реакций: K2[Zn(OH)4] + HBr =](/img/thumbs/024804df6bdc583ba07a5111a2960d34-800x.jpg)





