кислорода»
Класс: 9
Тип урока: изучение нового материала.
Учитель: С. Ю. Фирсова
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад урока по химии Кислород. Свойства кислорода (9 класс)
Содержание
- 1. Презентация урока по химии Кислород. Свойства кислорода (9 класс)
- 2. Повторение пройденного материала1. Что такое оксиды?2. Составьте
- 3. Кислород. Свойства кислорода.«Кислород – это та ось, вокруг которой вращается химия»А.Берцелиус
- 4. Цель урока: Изучить свойства и способы получения
- 5. План урока 1. Нахождение кислорода
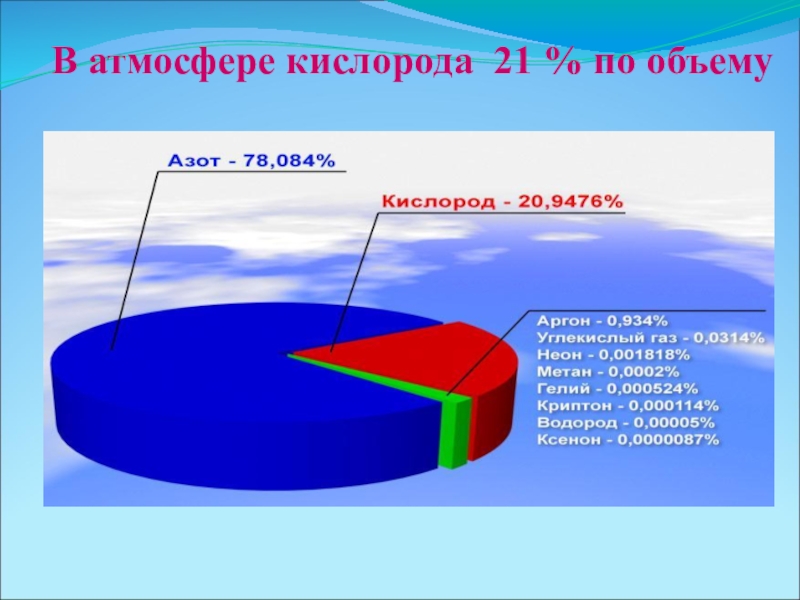
- 6. В атмосфере кислорода 21 % по объему
- 7. 1774 годДжозеф Пристли(английский ученый) в 1774
- 8. 1775 годАнтуан Лоран Лавуазье Обнаружил газ, которому дал названия:«огненный воздух»«жизненный воздух»«окси генес» - образующий кислоты
- 9. ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТА «КИСЛОРОД»1. Химический знак
- 10. Способы получения кислорода
- 11. Способы получения кислорода1) разложение перманганата калия2KMnO4
- 12. 2) разложение пероксида водорода2H2O2 =
- 13. План урока 1. Нахождение кислорода
- 14. Химические свойства кислорода1) Взаимодействие кислорода с простыми
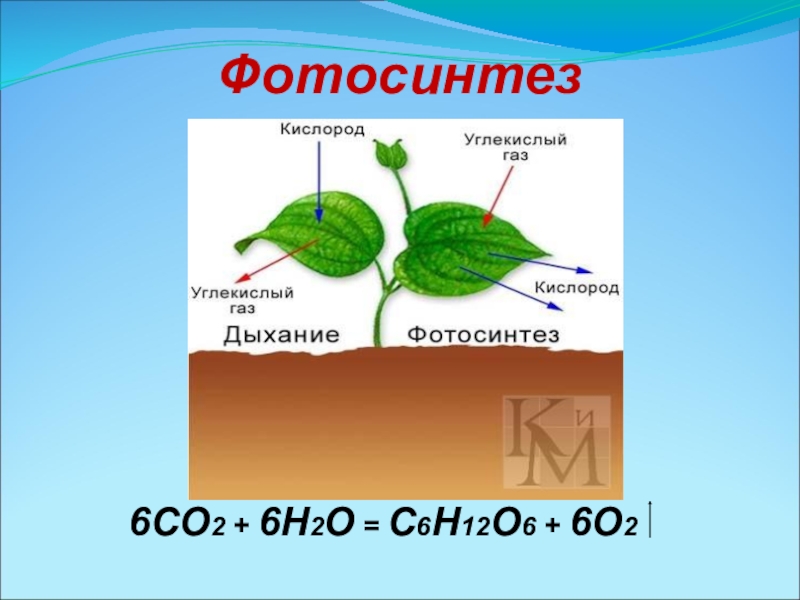
- 15. Фотосинтез 6CO2 + 6H2O = C6H12O6 + 6O2
- 16. Способность атомов одного химического элемента образовывать несколько
- 17. Аллотропия кислорода. Кислород и озон
- 18. Задание: Напишите уравнения взаимодействия кислорода с серой, натрием, углеродом.
- 19. Задание: Рассчитайте массу кислорода, которую
- 20. Задание: Какую массу перманганата калия нужно взять, чтобы получить 128г кислорода.
- 21. Задание:Какой объем воздуха потребуется для сжигания 150 тонн угля?
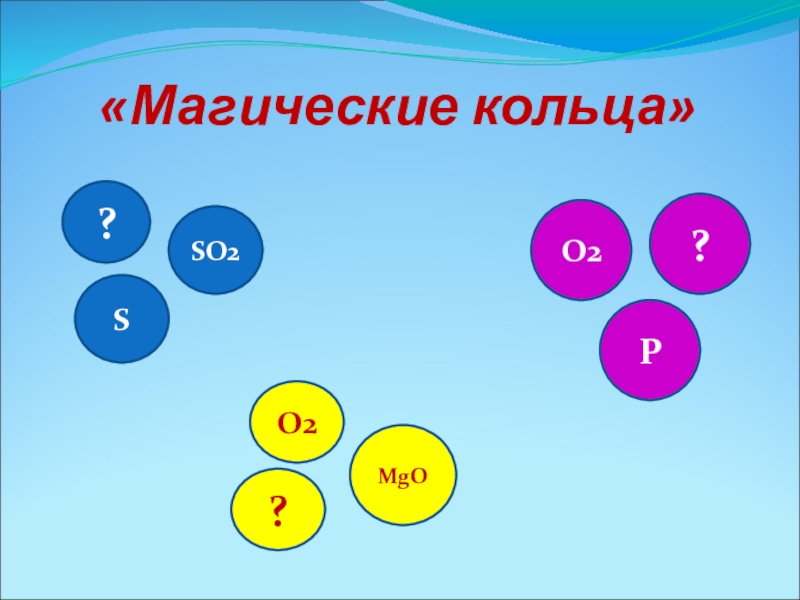
- 22. «Магические кольца»?SO2SO2?PO2MgO?
- 23. «Океан химических вопросов»12345
- 24. Домашнее задание: ξ 18, задачи 4,5.
Повторение пройденного материала1. Что такое оксиды?2. Составьте химические формулы оксидов азота (I), (II), (III), (IV), (V).3. Вычислите, какой из оксидов азота богаче кислородом.
Слайд 2Повторение пройденного материала
1. Что такое оксиды?
2. Составьте химические формулы оксидов азота
(I), (II), (III), (IV), (V).
3. Вычислите, какой из оксидов азота богаче кислородом.
3. Вычислите, какой из оксидов азота богаче кислородом.
Слайд 3Кислород.
Свойства кислорода.
«Кислород – это та ось, вокруг которой вращается химия»
А.Берцелиус
Слайд 4Цель урока: Изучить свойства и способы получения кислорода в лаборатории.
Задачи
урока:
1) изучить общую характеристику химического элемента кислорода;
2) расширить знания о распространенности кислорода на Земле, его значении для живых существ;
3) познакомиться с историей открытия кислорода и именами учёных, связанных с этим открытием;
4) изучить способы получения кислорода в лаборатории.
1) изучить общую характеристику химического элемента кислорода;
2) расширить знания о распространенности кислорода на Земле, его значении для живых существ;
3) познакомиться с историей открытия кислорода и именами учёных, связанных с этим открытием;
4) изучить способы получения кислорода в лаборатории.
Слайд 5План урока
1. Нахождение кислорода в природе.
2. История открытия кислорода.
3. Получение кислорода в лаборатории. Лабораторная работа.
4. Свойства кислорода.
5. Круговорот кислорода в природе и его применение.
6. Аллотропные модификации кислорода.
3. Получение кислорода в лаборатории. Лабораторная работа.
4. Свойства кислорода.
5. Круговорот кислорода в природе и его применение.
6. Аллотропные модификации кислорода.
Слайд 71774 год
Джозеф Пристли
(английский ученый)
в 1774 году разложением оксида
ртути (II) открыл кислород и изучил его свойства.
Слайд 81775 год
Антуан Лоран Лавуазье
Обнаружил газ, которому дал названия:
«огненный воздух»
«жизненный
воздух»
«окси генес» - образующий кислоты
«окси генес» - образующий кислоты
Слайд 9ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТА «КИСЛОРОД»
1. Химический знак
2. Относительная атомная
масса
3. Химическая формула вещества
4. Относительная молекулярная масса
5. Степень окисления
3. Химическая формула вещества
4. Относительная молекулярная масса
5. Степень окисления
О
Аr(O)=16
О2
Mr(O2)=32
-2
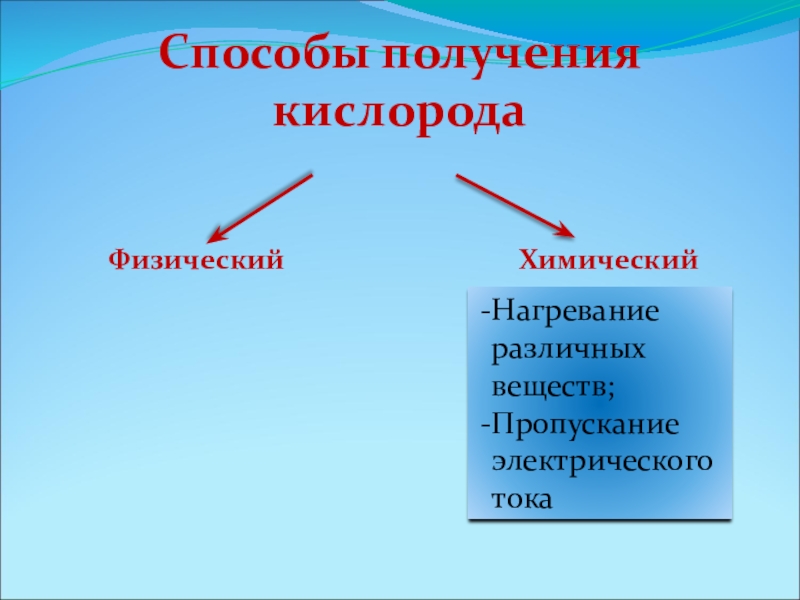
Слайд 10Способы получения кислорода
Физический
Химический
Нагревание различных веществ;
Пропускание электрического тока
Слайд 122) разложение пероксида водорода
2H2O2 = 2H2O +
O2↑
3) разложение хлората калия
2KClO3 = 2KCl + 3O2↑
4) разложение оксида ртути (II)
2HgO = 2Hg + O2↑
5)электролиз воды
2H2O = 2H2↑ + O2↑
3) разложение хлората калия
2KClO3 = 2KCl + 3O2↑
4) разложение оксида ртути (II)
2HgO = 2Hg + O2↑
5)электролиз воды
2H2O = 2H2↑ + O2↑
Слайд 13План урока
1. Нахождение кислорода в природе.
2. История открытия кислорода.
3. Получение кислорода в лаборатории. Лабораторная работа.
4. Свойства кислорода.
5. Круговорот кислорода в природе и его применение.
6. Аллотропные модификации.
3. Получение кислорода в лаборатории. Лабораторная работа.
4. Свойства кислорода.
5. Круговорот кислорода в природе и его применение.
6. Аллотропные модификации.
Слайд 14Химические свойства кислорода
1) Взаимодействие кислорода с простыми веществами.
2) Взаимодействие кислорода со
сложными веществами.
(напишите реакцию взаимодействия природного газа СН4 с кислородом)
(напишите реакцию взаимодействия природного газа СН4 с кислородом)
Слайд 16Способность атомов одного химического элемента образовывать несколько простых веществ называют аллотропией,
а эти простые вещества – аллотропными видоизменениями или модификациями.
Слайд 19
Задание:
Рассчитайте массу кислорода, которую мог бы получить Д.Пристли,
если бы разложил 564,2 г оксида ртути (II).