- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
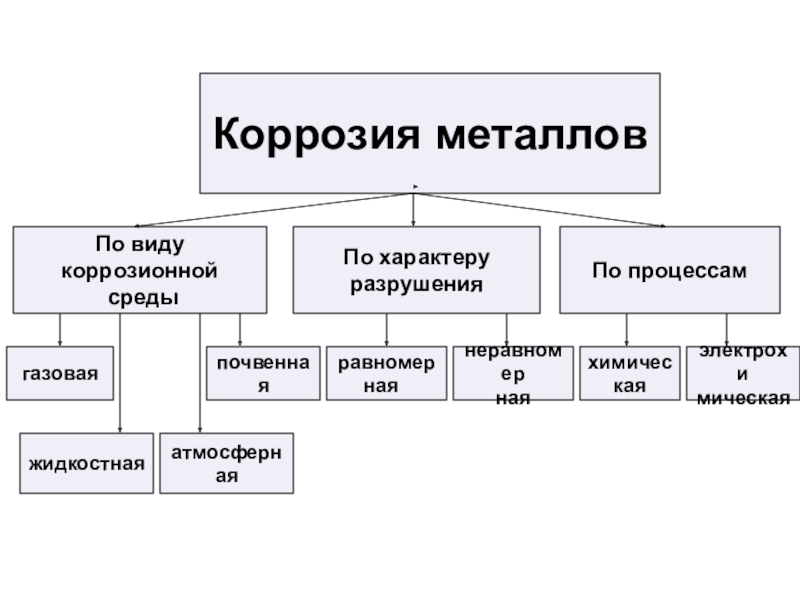
Презентация, доклад урока Коррозия металлов
Содержание
- 1. Презентация урока Коррозия металлов
- 2. Коррозия – рыжая крыса,Грызет металлический лом.
- 3. В народном хозяйстве используется огромное количество металлических
- 4. Слайд 4
- 5. Ежегодно из-за коррозии безвозвратно теряются огромные количества
- 6. Коррозия вызывает серьезные экологические последствия. Утечка газа,
- 7. Механизм окислительно-восстановительных реакций зависит от того, в
- 8. Восстановители -Металлы Окислители –Различные неметаллы(напр О2 )ВодаКислотыСоли в раствореОрганические вещества
- 9. Химическая Коррозия
- 10. Компоненты окружающей среды окисляют непосредственно металл.Протекающие при
- 11. Химическая ( или газовая ) коррозия -
- 12. Химическая коррозия часто наблюдается в процессе обработки
- 13. Слайд 13
- 14. 1 группа – щелочные металлы – наименьшая
- 15. Электрохимическая коррозия – это разрушение металлов
- 16. 3 группа – Алюминий – образуется прочная
- 17. 5,6,7,8группы. – металлы побочных подгрупп обладают высокой
- 18. Для изготовления аппаратуры, подвергающейся газовой коррозии, применяют
- 19. Коррозия протекающая в токопроводящей среде.Помимо химической реакции,
- 20. Как правило, металлы и сплавы неоднородны, содержат
- 21. Электрохимическая коррозия протекает в присутствии влаги. Ей
- 22. Процессы, протекающие на катоде
- 23. Коррозионные процессы весьма разнообразны, рассмотрим их протекание
- 24. Слайд 24
- 25. В щелочной или нейтральной среде идет восстановление
- 26. Слайд 26
- 27. Способы защиты от коррозии Шлифование поверхностей изделия
- 28. Нанесение защитных покрытий.Неметаллические – неокисляющиеся масла, специальные
- 29. .Полимерные покрытия изготавливают из полиэтилена, полихлорвинила, полиамидных
- 30. В качестве металлов для покрытия обычно применяют
- 31. Коррозия металлов
Слайд 3В народном хозяйстве используется огромное количество металлических материалов в виде различных
Слайд 4
Зачем нам нужно изучать этот процесс?
Назовите последствия коррозии.
коррозией
Слайд 5Ежегодно из-за коррозии безвозвратно теряются огромные количества металла, более 20 миллионов
Слайд 6Коррозия вызывает серьезные экологические последствия. Утечка газа, нефти и других опасных
Слайд 7Механизм окислительно-восстановительных реакций зависит от того, в какой среде они происходят,
Слайд 8
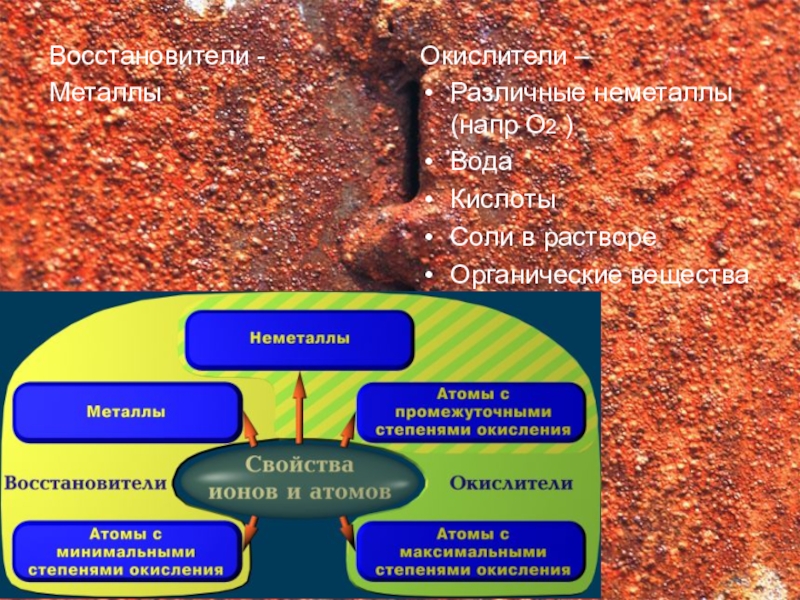
Восстановители -
Металлы
Окислители –
Различные неметаллы(напр О2 )
Вода
Кислоты
Соли в растворе
Органические вещества
Слайд 10
Компоненты окружающей среды окисляют непосредственно металл.
Протекающие при химической коррозии окислительно -
химическая коррозия
Слайд 11Химическая ( или газовая ) коррозия - это разрушение металлов в
4 Fe0 + 3 O2 t= 2 Fe+32 O3
2 Fe0 + 3 SO2 + 3 O2 t= Fe+32(SO4)3
2 Zn0 + O2 t= 2 Zn+2O
Слайд 12Химическая коррозия часто наблюдается в процессе обработки металлов при высоких температурах.
Слайд 14
1 группа – щелочные металлы –
наименьшая коррозийная
стойкость.(побочная подгруппа
–
2 группа – главная подгруппа – малоустойчивы, побочная – более устойчивы( в присутствии кислорода образуют прочные пленки оксидов, предохраняющие от дальнейшего разрушения)
коррозионные свойства металлов
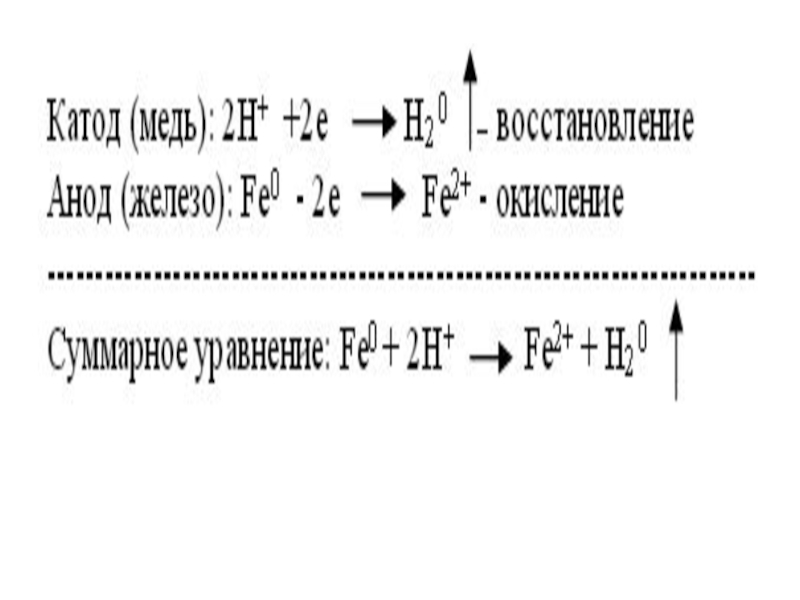
Слайд 15 Электрохимическая коррозия – это разрушение металлов в среде электролита с возникновением
Анод: Fe0 – 2e = Fe2+ - окисление
Катод: 2H+ + 2e = H20 - восстановление
Слайд 163 группа – Алюминий – образуется прочная оксидная пленка ( но
4 группа – Олово и свинец – стойкие к коррозии металлы, благодаря прочным оксидным пленкам.
Слайд 175,6,7,8группы. – металлы побочных подгрупп обладают высокой способностью к пассивации, а
Осмий, Иридий, Платина – самые стойкие к коррозии
Железо пассивируется концентрированной
серной и азотной
Слайд 18Для изготовления аппаратуры, подвергающейся газовой коррозии, применяют жаростойкие сплавы из чугуна
Слайд 19
Коррозия протекающая в токопроводящей среде.
Помимо химической реакции, в системе возникает электрический
Процесс электрохимической коррозии происходит при контакте двух металлов
Разрушается металл с более сильными восстановительными свойствами (выполняет роль анода)
электрохимическая коррозия
Слайд 20Как правило, металлы и сплавы неоднородны, содержат различные примеси. При их
Слайд 21Электрохимическая коррозия протекает в присутствии влаги. Ей подвергаются подводные части судов
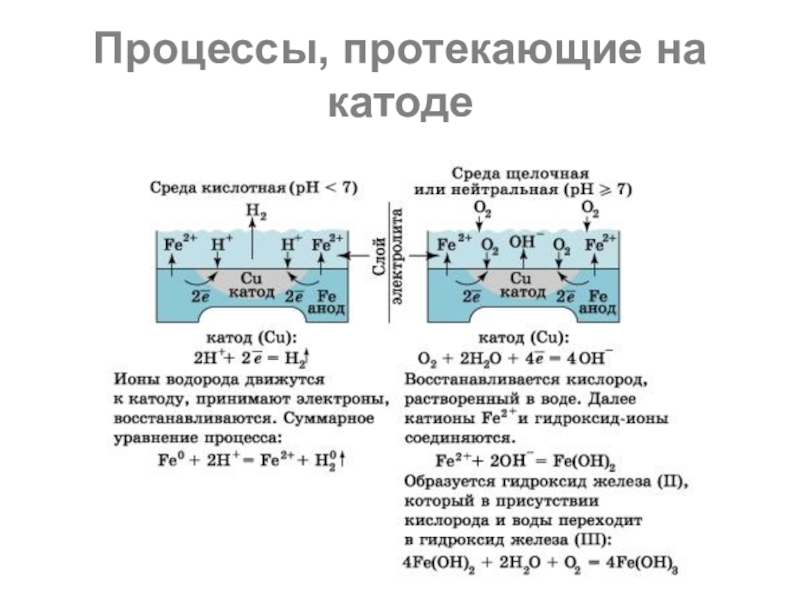
Слайд 23Коррозионные процессы весьма разнообразны, рассмотрим их протекание в различных средах электролита
В кислотной среде атомы железа отдают электроны, которые переходят к меди и на ее поверхности соединяются с ионами водорода, выделившимися из компонентов среды. На катоде идет процесс восстановления ионов водорода с образованием газообразного водорода.
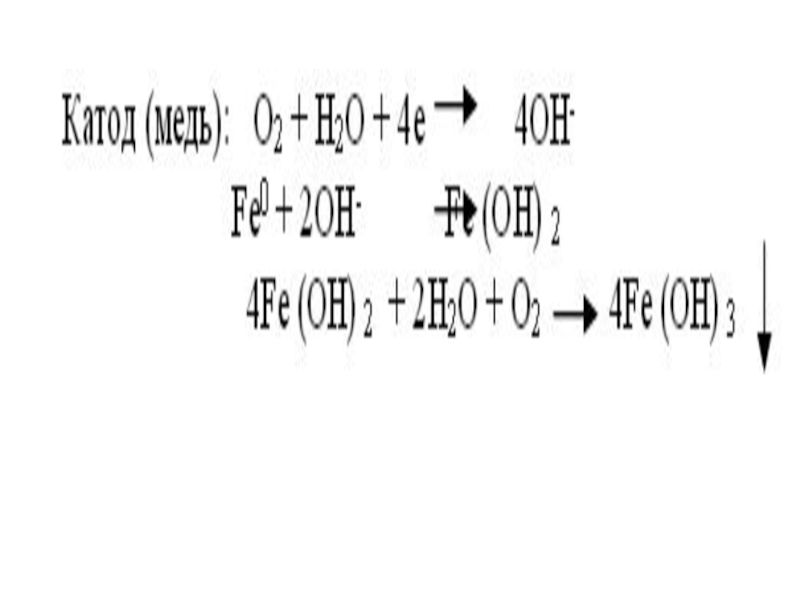
Слайд 25В щелочной или нейтральной среде идет восстановление кислорода, растворенного в воде
Слайд 27
Способы защиты от коррозии
Шлифование поверхностей изделия – чтобы на них
Приготовление химически стойких сплавов (сплавы, содержащие хром, никель, которые при высокой температуре на поверхности металла образуют оксидный слой), нержавеющие стали, из которых изготавливают детали машин, инструменты, посуду (ножи, вилки…).
Слайд 28Нанесение защитных покрытий.
Неметаллические – неокисляющиеся масла, специальные лаки, краски, эмали.
Химические –
Слайд 29.
Полимерные покрытия изготавливают из полиэтилена, полихлорвинила, полиамидных смол. Наносят их двумя
Металлические.
Слайд 30В качестве металлов для покрытия обычно применяют металлы, образующие на своей
Никелевые покрытия нарядны, стойки, прочны. Поэтому никелирование – самый распространенный в гальванотехнике процесс.