№4 г. Воронежа Свердлиной Т.В.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад урока химии по теме Водород
Содержание
- 1. Презентация урока химии по теме Водород
- 2. Учитель Свердлина Т.В.Предмет
- 3. Формы организации учебно-познавательной деятельности:фронтальная, индивидуальная, групповаяТехнологии, методики:1)
- 4. Оборудование и наглядный материал.1. Персональный компьютер, 2.
- 5. Цели урока:Рассмотреть водород как химический элемент и
- 6. Планируемые результаты обучения.Личностные: развитие желания узнавать новое,
- 7. Водород - первый химический
- 8. Слайд 8
- 9. Атом и молекула водорода.
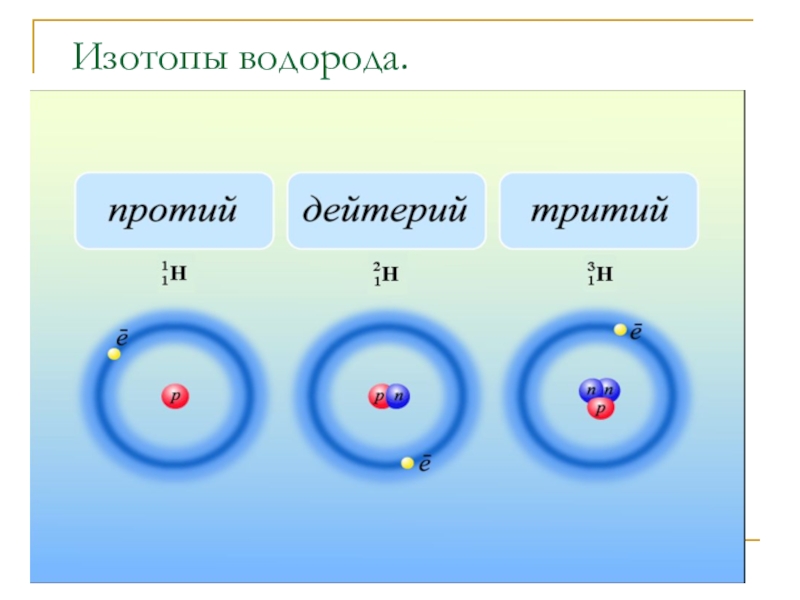
- 10. Изотопы водорода.
- 11. Водород – элемент №1 во Вселенной
- 12. Звезды и другие космические объекты состоят в основном из водорода.
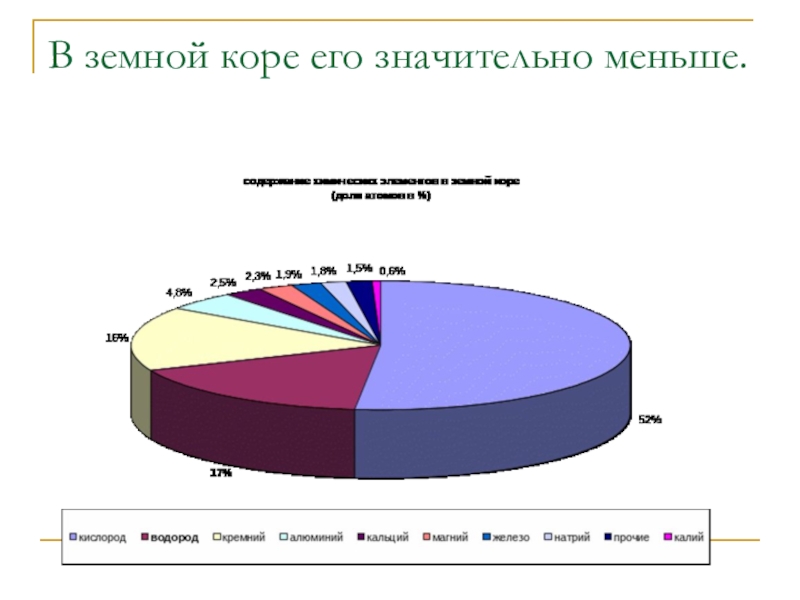
- 13. В земной коре его значительно меньше.
- 14. Водород входит в состав основного вещества Земли - воды.
- 15. Получение водорода.В лаборатории.1. Действием на металлы (обычно
- 16. В промышленности.1. Конверсией метана парами воды:CH4 +
- 17. Физические свойства водорода.Водород – газ, без цвета
- 18. Химические свойства водорода.1. Взаимодействие с металлами2Na +
- 19. Применение водорода.Водород используется для наполнения метеорологических зондов
- 20. Применение водорода.
- 21. Слайд 21
- 22. Спасибо за внимание!
Учитель Свердлина Т.В.Предмет ХимияКласс 9Автор УМК Габриелян О. С.Тема урока ВодородТип урока Урок открытия нового знания
Слайд 2Учитель Свердлина Т.В.
Предмет Химия
Класс
9
Автор УМК Габриелян О. С.
Тема урока Водород
Тип урока Урок открытия нового знания
Автор УМК Габриелян О. С.
Тема урока Водород
Тип урока Урок открытия нового знания
Слайд 3Формы организации учебно-познавательной деятельности:
фронтальная, индивидуальная, групповая
Технологии, методики:
1) проблемное обучение;
2) моделирующая
и поисковая деятельность;
3) информационно-коммуникационные технологии;
4) здоровьесберегающие технологии.
3) информационно-коммуникационные технологии;
4) здоровьесберегающие технологии.
Слайд 4Оборудование и наглядный материал.
1. Персональный компьютер,
2. Мультимедийный проектор,
3. Цифровые
образовательные ресурсы Интернет
получение и собирание водорода (видеофрагмент);
водород самый лёгкий газ (видеофрагмент);
горение водорода (видеофрагмент);
сжигание водорода (видеофрагмент);
водород с оксидом меди (II) (видеофрагмент);
применение водорода (видеофрагмент);
водород (презентация Microsoft Office PowerPoint).
получение и собирание водорода (видеофрагмент);
водород самый лёгкий газ (видеофрагмент);
горение водорода (видеофрагмент);
сжигание водорода (видеофрагмент);
водород с оксидом меди (II) (видеофрагмент);
применение водорода (видеофрагмент);
водород (презентация Microsoft Office PowerPoint).
Слайд 5Цели урока:
Рассмотреть водород как химический элемент и простое вещество, изучить строение
его атома, способы его получения и собирания, физические и химические свойства водорода, а так же его применение.
Задачи урока:
Личностные: создать условия для проведения исследования, совершенствования умений работать в команде, участвовать в обсуждении содержания материала, учиться формулировать собственное мнение и позицию.
Предметные: усвоить правила техники безопасности при работе в кабинете химии; использовать знания в повседневной жизни.
Метапредметные: способствовать овладению приёмами анализа, синтеза; умению аргументированно доказывать свою точку зрения; проводить коллективное исследование.
Задачи урока:
Личностные: создать условия для проведения исследования, совершенствования умений работать в команде, участвовать в обсуждении содержания материала, учиться формулировать собственное мнение и позицию.
Предметные: усвоить правила техники безопасности при работе в кабинете химии; использовать знания в повседневной жизни.
Метапредметные: способствовать овладению приёмами анализа, синтеза; умению аргументированно доказывать свою точку зрения; проводить коллективное исследование.
Слайд 6Планируемые результаты обучения.
Личностные: развитие желания узнавать новое, навыков коллективной работы, формирование
успешности и результативности деятельности; формируется научное мировоззрение на основе экспериментальной деятельности.
Предметные: учащиеся безошибочно выполняют задания в группе и индивидуально, дают безошибочные устные ответы, находят и исправляют ошибки, оказывают взаимопомощь.
Метапредметные: развивается умение анализировать, обрабатывать информацию на основе законов естественнонаучных дисциплин развитие наблюдательности, логического и абстрактного мышления, навыков анализа и синтеза, структурирования информации; формирование основных приемов самоопределения, планирования и реализации учебных действий, а также навыков устной речи, способности выступать перед аудиторией.
Предметные: учащиеся безошибочно выполняют задания в группе и индивидуально, дают безошибочные устные ответы, находят и исправляют ошибки, оказывают взаимопомощь.
Метапредметные: развивается умение анализировать, обрабатывать информацию на основе законов естественнонаучных дисциплин развитие наблюдательности, логического и абстрактного мышления, навыков анализа и синтеза, структурирования информации; формирование основных приемов самоопределения, планирования и реализации учебных действий, а также навыков устной речи, способности выступать перед аудиторией.
Слайд 7 Водород - первый химический элемент периодической системы химических
элементов Д. И. Менделеева. Атомный номер водорода 1, относительная атомная масса 1,0079.
Слайд 15Получение водорода.
В лаборатории.
1. Действием на металлы (обычно цинк) соляной или разбавленной
серной кислотой:
Zn + H2SO4 → ZnSO4 + H2↑
2. Взаимодействием паров воды с раскаленными железными стружками:
4H2O + 3Fe → Fe3O4 + 4H2↑
Водород собирают методом вытеснения воды в сосудах перевёрнутых вверх дном.
Zn + H2SO4 → ZnSO4 + H2↑
2. Взаимодействием паров воды с раскаленными железными стружками:
4H2O + 3Fe → Fe3O4 + 4H2↑
Водород собирают методом вытеснения воды в сосудах перевёрнутых вверх дном.
Слайд 16В промышленности.
1. Конверсией метана парами воды:
CH4 + 2H2O → 4H2 +
CO2↑
2. Конверсией оксида углерода:
СО + H2O → CO2 + H2↑
3. Термическим разложением метана:
СН4 → С + 2Н2↑
4. Электролизом воды. Получаемый водород чистый, но очень дорогой.
2H2О → 2H2 + О2
2. Конверсией оксида углерода:
СО + H2O → CO2 + H2↑
3. Термическим разложением метана:
СН4 → С + 2Н2↑
4. Электролизом воды. Получаемый водород чистый, но очень дорогой.
2H2О → 2H2 + О2
Слайд 17Физические свойства водорода.
Водород – газ, без цвета и запаха, малорастворим в
воде. Водород сжижается при низких температурах, известен твёрдый металлический водород. Водород легче воздуха в 14,5 раз.
Слайд 18Химические свойства водорода.
1. Взаимодействие с металлами
2Na + H2 → 2NaH
Ca +
H2 → CaH2
2. Взаимодействие с неметаллами
а) с кислородом
2H2 + О2 → 2H2О
б) с серой
H2 + S → H2S
в) с азотом
3H2 + N2 → 2NH3
3. Взаимодействие с основными оксидами
а) с оксидом меди (II)
H2 + CuO → Cu + H2O
б) с оксидами железа (II, III)
4H2 + Fe3O4 → 3Fe + 4H2O
2. Взаимодействие с неметаллами
а) с кислородом
2H2 + О2 → 2H2О
б) с серой
H2 + S → H2S
в) с азотом
3H2 + N2 → 2NH3
3. Взаимодействие с основными оксидами
а) с оксидом меди (II)
H2 + CuO → Cu + H2O
б) с оксидами железа (II, III)
4H2 + Fe3O4 → 3Fe + 4H2O
Слайд 19Применение водорода.
Водород используется для наполнения метеорологических зондов (ранее воздушных шаров и
дирижаблей), как топливо в ракетной технике, в кислородно-водородных горелках для сварки и резки металлов. Области применения водорода весьма разнообразны, но все связаны с его восстановительными свойствами. Это производство аммиака и соляной кислоты, получение особо чистых металлов, органический синтез (получение синтетического моторного топлива, гидрогенизация жиров, синтез анилина из нитробензола). Дейтерий и тритий используют в процессах термоядерного синтеза.