- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Скорость химических реакций. Факторы, влияющие на скорость химических реакций (11 класс)
Содержание
- 1. Презентация Скорость химических реакций. Факторы, влияющие на скорость химических реакций (11 класс)
- 2. ВопросыКак вычисляется скорость механического движения? В каких единицах измерения выражается?Что понимают под скоростью химической реакции?
- 3. Скорость химической реакции- это изменение молярной концентрации
- 4. Скорость гомогенной реакции определяется как изменение количества
- 5. Слайд 5
- 6. Факторы, влияющие на скорость химической реакцииприрода
- 7. Факторы, влияющие на скорость химической реакцииприрода
- 8. 1. Природа реагирующих веществ2H2 + O2 =
- 9. 2. Концентрация реагирующих веществС увеличением концентрации
- 10. 2. Концентрация реагирующих веществЗакон действующих масс:
- 11. Выражение скорости реакцииH2 + Сl2 = 2HСl
- 12. Слайд 12
- 13. Если концентрацию водорода увеличить
- 14. Как изменится скорость химической реакции
- 15. При повышении давления системы в 3 раза скорость химической реакции N2+3H2=2NH3 увеличится …V1=k·CN2·CH23V2=k·3CN2·(3CH2)3=81·kCN2CH23V2/V1=81·kCN2CH23/kCN2CH23=81V2=81V1
- 16. При увеличении давления в 5 раз в
- 17. 3. ТемператураПравило Вант-Гоффа: при повышении температуры
- 18. Слайд 18
- 19. V2/V1=2 40о /10V2/V1=24V2=16 V1V2/V1=2 40о /10V2/V1=24V2=16 V1
- 20. V2/V1=3 (50о-10о) /10V2/V1=34V2=81 V1V2/V1=3 (50о-10о) /10V2/V1=34V2=81 V1
- 21. Для увеличения скорости реакции в 64 раза
- 22. 4. Действие некоторых веществКатализаторыБиологические катализаторы – ферментыИнгибиторы
- 23. 5. Поверхность соприкосновения реагирующих веществЧем больше
- 24. Факторы, влияющие на скорость химической реакцииприрода
- 25. Спасибо за внимание! Успешной сдачи ЕНТ!
Слайд 1Скорость химических реакций. Факторы, влияющие на скорость химических реакций
Учитель химии
школы КГУ
Куприянова Ирина Васильевна
Слайд 2Вопросы
Как вычисляется скорость механического движения?
В каких единицах измерения выражается?
Что понимают
Слайд 3Скорость химической реакции
- это изменение молярной концентрации одного из веществ, участвующих
Δ С – изменение концентрации вещества, моль/л
Δ t – промежуток времени, с
Слайд 4Скорость гомогенной реакции
определяется как изменение количества вещества в единицу времени
если объем системы не меняется.
Скорость гетерогенной реакции
определяется как изменение количества вещества в единицу времени на единице поверхности:
где S — площадь поверхности соприкосновения веществ (м2,см2).
Слайд 6Факторы, влияющие
на скорость химической реакции
природа реагирующих веществ;
концентрация реагирующих веществ;
температура;
действие некоторых
поверхность соприкосновения реагирующих веществ (в гетерогенных реакциях).
Слайд 7Факторы, влияющие
на скорость химической реакции
природа реагирующих веществ;
концентрация реагирующих веществ;
температура;
действие некоторых
поверхность соприкосновения реагирующих веществ (в гетерогенных реакциях).
Слайд 81. Природа реагирующих веществ
2H2 + O2 = 2H2O
CaO +H2O = Ca(OH)2
CuO + H2O
Zn +HCl =
Zn +CH3COOH =
Слайд 92. Концентрация
реагирующих веществ
С увеличением концентрации скорость реакции возрастает.
Например,
Слайд 102. Концентрация
реагирующих веществ
Закон действующих масс:
Скорость химической реакции
для реакции aA + bB = ...
v = k СA СB v = k[A] [B]
СA, СB – концентрации веществ, моль/л
k – константа скорости, k = v при С=1 моль/л
Для гетерогенных реакций концентрация твердой фазы не учитывается.
Слайд 13Если концентрацию водорода увеличить
H2 + Cl2= 2HCl
V1 = kCH2·CCl2
V2 = k·4CH2 ·1/2CCl2
V2 = 2kCH2·CCl2
V2/V1= 2k·CH2·CCl2 /kCH2·CCl2
V2/V1=2
V2 =2 V1
Слайд 14 Как изменится скорость химической реакции 2Fe + 3Сl2 = 2FeСl3 ,
Слайд 15При повышении давления системы в 3 раза скорость химической реакции N2+3H2=2NH3
V1=k·CN2·CH23
V2=k·3CN2·(3CH2)3=81·kCN2CH23
V2/V1=81·kCN2CH23/kCN2CH23=81
V2=81V1
Слайд 16При увеличении давления в 5 раз в равновесной системе N2+3H2=2NH3 скорость
А) 125 раз Vп1=k·CN2·CH23
В) 15 раз
С) 5 раз Vобр1=k·CNН32
Д) 625 раз
Е) 25 раз
Vп2=k·5CN2·(5CH2)3 = 54 k·CN2·CH23
Vобр2=k·(5CNН3 )2 =52 k·CNН32
Vп2 становится больше Vобр2 в 25 раз
Слайд 173. Температура
Правило Вант-Гоффа:
при повышении температуры
Слайд 21Для увеличения скорости реакции в 64 раза (температурный коэффициент равен 4)
А) 10о
В) 20о
С) 50о
Д) 30о
Е) 40о
V2/V1=4 (Δ t о) /10=64
64= 4 3= 4 (30 о) /10
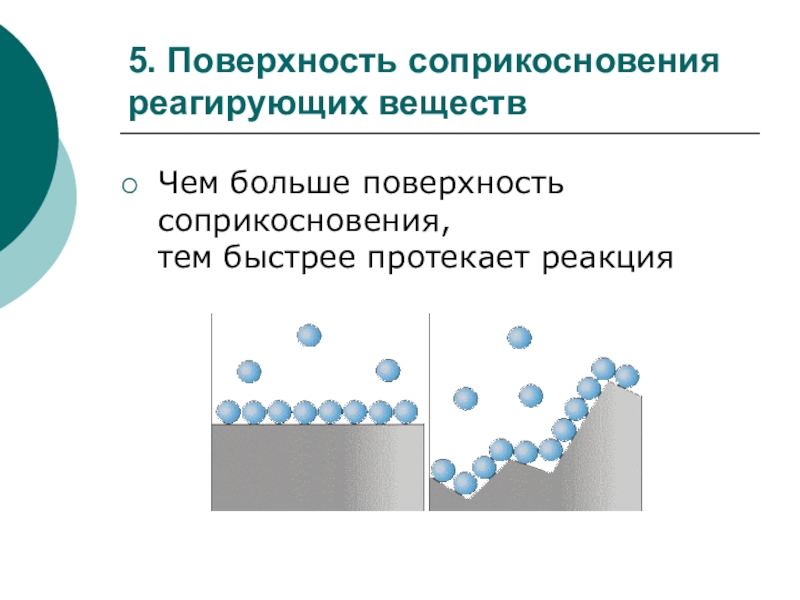
Слайд 235. Поверхность соприкосновения
реагирующих веществ
Чем больше поверхность соприкосновения,
Слайд 24Факторы, влияющие
на скорость химической реакции
природа реагирующих веществ;
концентрация реагирующих веществ;
температура;
действие некоторых
поверхность соприкосновения реагирующих веществ (в гетерогенных реакциях).