- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад сборник уроков по органической химии 2 часть
Содержание
- 1. Презентация сборник уроков по органической химии 2 часть
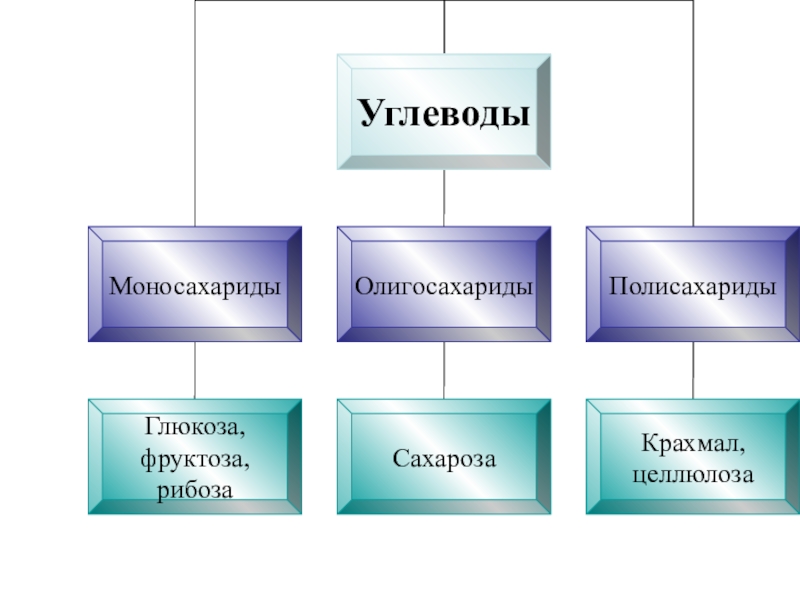
- 2. эфирыЖирыЖиры ГлюкозаСахарозаКрахмалЦеллюлозаАминыАминокислотыБелки
- 3. Презентация по химии «Альдегиды» 10 класс.
- 4. Альдегиды – это органические вещества, молекулы, которых
- 5. Альдегиды Кетоны C R O H C
- 6. Метаналь (формальдегид) Этаналь (ацетальдегид) ПропанальБутанальПентанальАльдегиды
- 7. 3-метилбутанальАльдегиды. Номенклутура.
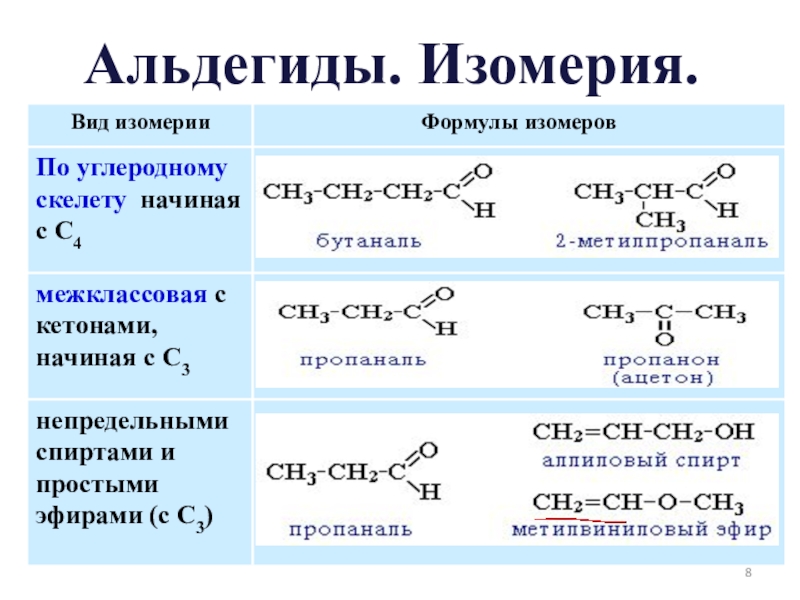
- 8. Альдегиды. Изомерия.
- 9. Физические свойства альдегидов определяются строением карбонильной группы
- 10. Слайд 10
- 11. Слайд 11
- 12. Слайд 12
- 13. Альдегиды. Получение.
- 14. Реакции окисления3. Каталитическое окисление. а) 2СН2 = СН2
- 15. 4. Гидратация (реакция Кучерова)
- 16. Слайд 16
- 17. Слайд 17
- 18. Реакция окисления аммиачным раствором оксида серебра -
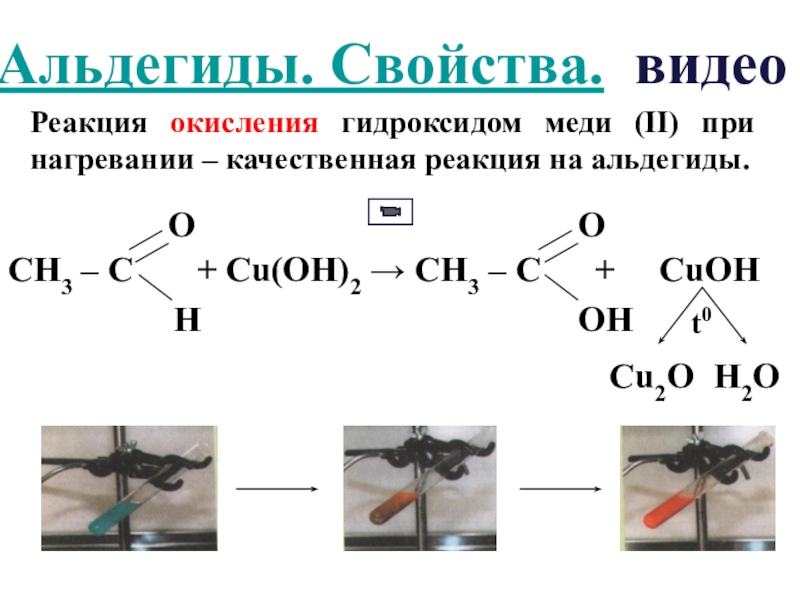
- 19. Реакция окисления гидроксидом меди (II) при нагревании – качественная реакция на альдегиды.Альдегиды. Свойства. видео
- 20. Реакция восстановления водородом в соответствующие спирты - гидрирование.Альдегиды. Свойства.
- 21. Реакция восстановления водой в соответствующие спирты двухатомныеАльдегиды. Свойства.
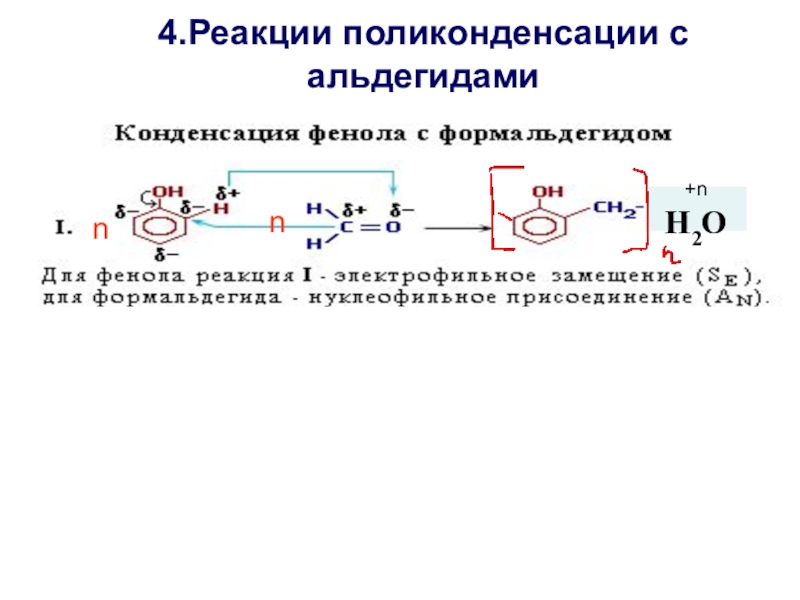
- 22. 4.Реакции поликонденсации с альдегидамиnn+n H2O
- 23. Отличительной чертой многих альдегидов является их запах.
- 24. Тема урока: «Предельные одноосновные карбоновые кислоты»Цель урока:•Знать
- 25. Карбоновые кислотыДавайте вспомним, какие классы кислородсодержащих органических
- 26. Карбоновые кислоты-органические соединения,содержащие одну или несколько карбоксильных групп- СООНсвязанных с углеводородным радикалом
- 27. Классификация карбоновых кислотПо числу карбоксильныхгруппнепредельныеароматическиеодноосновныедвухосновныемногоосновныепредельныеПо типу углеводородногорадикала
- 28. Общая формула одноосновных кислот предельного рядаСnH2n+1COOНгде n может быть равно нулю.
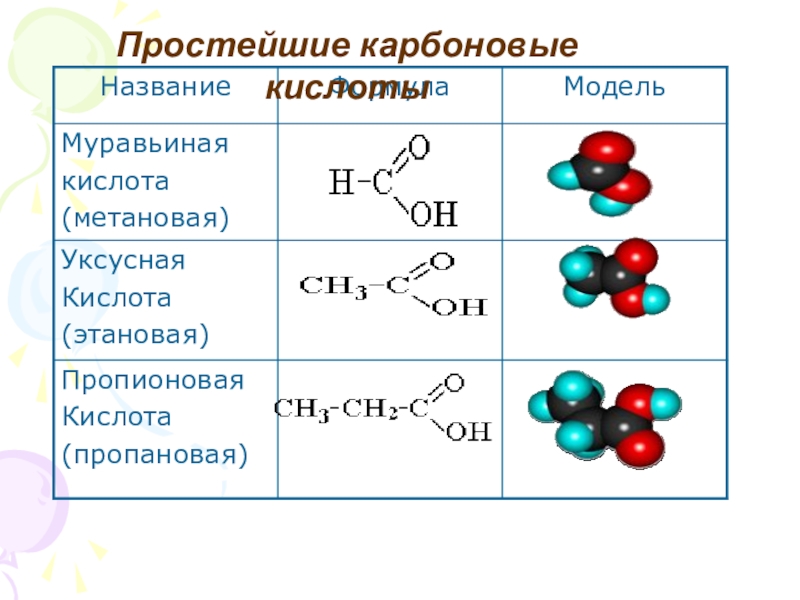
- 29. Простейшие карбоновые кислоты
- 30. Все карбоновые кислоты имеют функциональную группу. Что
- 31. 2) В зависимости от природы радикала● предельные
- 32. Многие кислоты имеют исторически
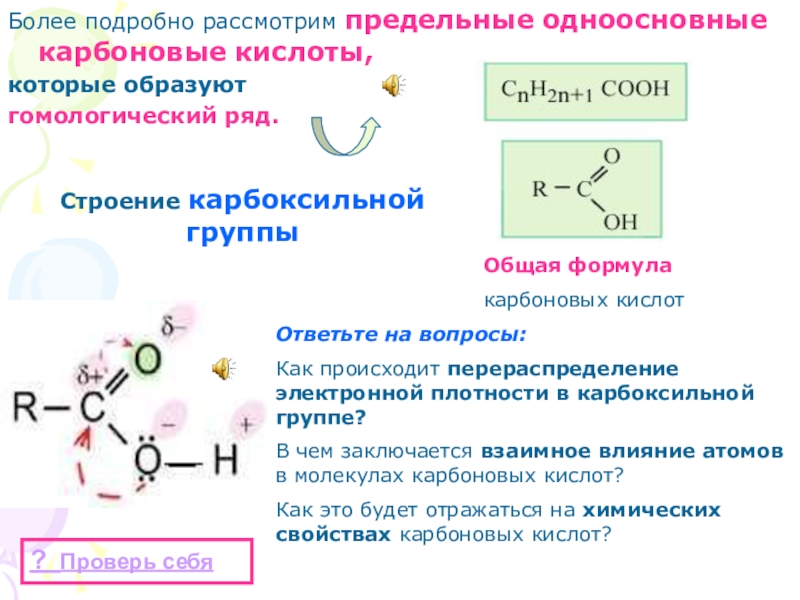
- 33. Более подробно рассмотрим предельные одноосновные карбоновые кислоты,
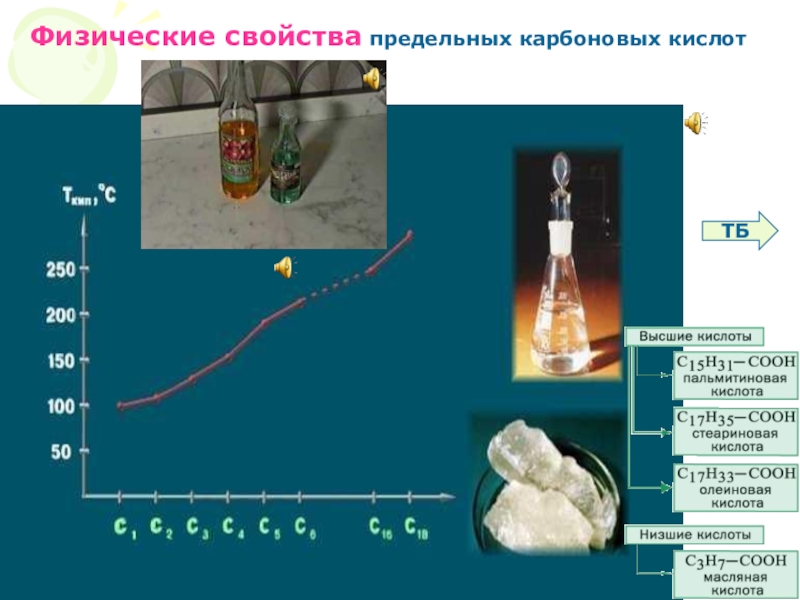
- 34. Физические свойства карбоновых кислотФизические свойства предельных карбоновых кислотТБ
- 35. Слайд 35
- 36. Слайд 36
- 37. Слайд 37
- 38. Особенности муравьиной кислоты
- 39. Почему среди кислот
- 40. 3. Карбоновые кислоты реагируют с основными оксидами
- 41. 6. Реакция этерификации – образование сложных эфиров
- 42. Получение карбоновых кислотПредельные карбоновые кислоты получают:1. Окислением
- 43. Слайд 43
- 44. Получение муравьиной кислоты
- 45. Генетическая связь карбоновых кислот с другими классами
- 46. Тема урока: «Предельные одноосновные карбоновые кислоты»Цель урока:●
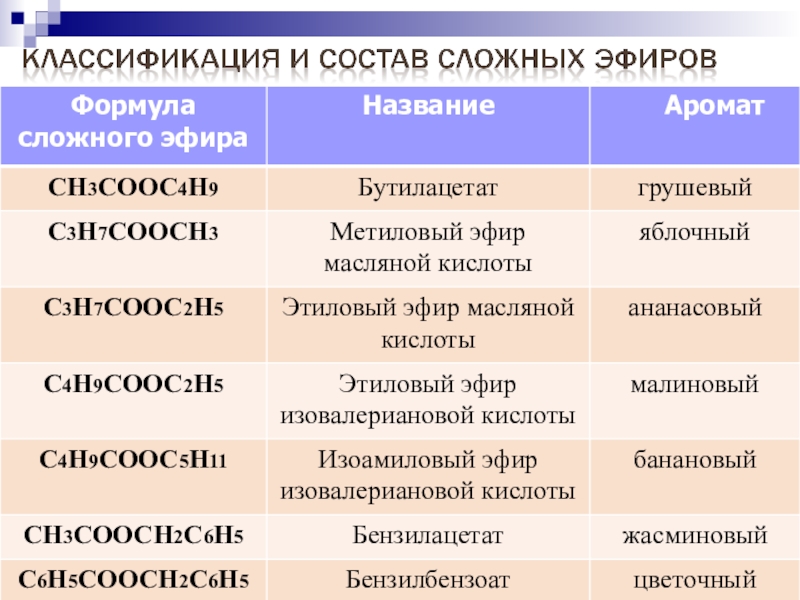
- 47. Номенклатура сложных эфировСложные эфиры в природеНазовите данныеприродные эфирыВ случае затруднения воспользуйтесь шпаргалкой1.2.3.
- 48. 1.Изобутилацетат или изобутиловый эфир уксусной кислоты2.Изопентилацетат или изопентиловый эфир уксусной кислоты3.Этилпропионат или этиловый эфир пропионовой кислоты.
- 49. Назовите карбоновые кислотыСН2-СН2-СН2-СН-СН-СООН
- 50. Проверь себя: 3,4 – диметилгексановая кислота 2,2,3 – триметилбутановая кислота
- 51. В случае затруднений воспользуйтесь формулами для осуществления цепочки превращений и выполните это задание дома
- 52. Слайд 52
- 53. Для определения названия кислоты в соответствии с
- 54. Ответы на вопросы● Электронная плотность в карбонильной
- 55. Какая из кислот сильнее? Хлоруксусная кислота сильнее
- 56. Решение задачи 1.По данному образцу реши дома задачу 2.
- 57. Сложные эфиры.В 1759г.- Лаурагвайс перегонял уксусную кислоту
- 58. СтроениеПри взаимодействии карбоновых кислот со спиртами (реакция этерификации) образуются сложные эфиры:
- 59. Строение(продолжение)Эта реакция обратима. Продукты реакции могут взаимодействовать
- 60. Сложные эфиры в природе и технике
- 61. Сложные эфиры.В зависимости от молекулярной массы сложные
- 62. Слайд 62
- 63. Слайд 63
- 64. Получение эфиров
- 65. Слайд 65
- 66. ЖирыЦели урока: Изучить жиры: состав, классификация,физические и химические свойства, переработка, применение, биологические функции, превращение в организме
- 67. План:История открытия липидовСостав КлассификацияФизические свойстваХимические свойстваИсточники Получение
- 68. История открытия жировЭлементный анализ жиров был проведен
- 69. присоединяя воду, распадается на глицерин
- 70. В состав жира входит 5-8 остатков различных
- 71. Кислоты входящие в состав жиров:
- 72. Липиды Простые (ацильные остатки одинаковы)Сложные Жиры(триглицериды)Воски (высшие
- 73. ЖивотныеРастительныеЖиры ТвёрдыеЖидкиеТвёрдыеЖидкиеЖиры (по применению)ПищевыеМедицинскиеТехнические(по происхождению)(по агрегатному состоянию)
- 74. Физические СвойстваЖивотные жиры плавятся при высокой t0CРастительные
- 75. Химические Свойствагидролизгидрированиепрогорканиеомыление
- 76. Жир(триглицерид)глицеринКарбоновые к-тыГидролиз Водяным паром под давлением или
- 77. +3C17H35 COOH+3 C17H35COONaЖир(триглицерид)глицеринМыло (стеарат натрия)Гидролиз Щелочной (омыление) образуются мылаСтеариновая кислота
- 78. 3H2Триолеат (жидкость)Тристеарат (твердое в-во)Гидрирование непредельных жиров
- 79. Получение маргарина
- 80. Прогоркание Вызывает появление специфического запаха и неприятного
- 81. Животный жир:ИзмельчениеВытапливаниеОчисткаРастительные масла:Растворение врастворителяхНагревание(испарение растворителей)Технология получения жиров
- 82. Химия Гамзина О. В.
- 83. Строение глюкозы.
- 84. Ход урокаЗаполнение первой колонки «Знаю»Выдвижение гипотезы и
- 85. Заполнение таблицы
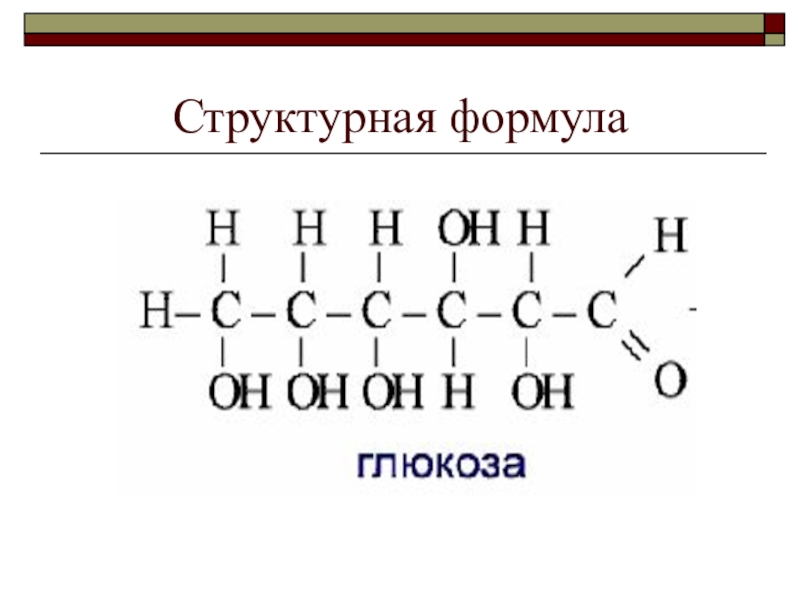
- 86. Структурная формула
- 87. β- циклическая формаα -циклическая форма
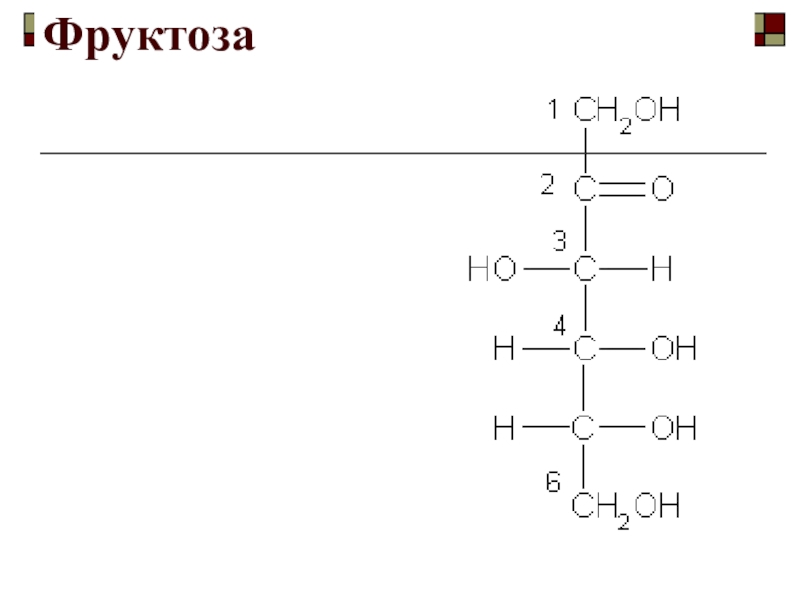
- 88. Фруктоза
- 89. ПОЛУЧЕНИЕ ГЛЮКОЗЫ1) Реакция фотосинтеза6СО2 + 6H2O →
- 90. Гидролиз дисахаридов: C12H22O11 + H2O t,H+→ 2
- 91. ХИМИЧЕСКИЕ СВОЙСТВАРеакция Реакция “Реакция “серебряного зеркалаРеакция “серебряного
- 92. Слайд 92
- 93. Качественная реакция, доказывающая, что глюкоза является многоатомным
- 94. ХИМИЧЕСКИЕ СВОЙСТВА3) Гидрирование глюкозыСН2ОН – (СНОН)4 –
- 95. Слайд 95
- 96. Слайд 96
- 97. СПЕЦИФИЧЕСКИЕ СВОЙСТВАа) Спиртовое брожение (под действием дрожжей)
- 98. СПЕЦИФИЧЕСКИЕ СВОЙСТВАв) Маслянокислое брожениеС6 Н12 О6 →
- 99. Слайд 99
- 100. Глюкоза - необходимый компонент пищи;Является одним из
- 101. ГлюкозаГлюкоза – самый важный из всех моносахаридов;Является
- 102. ГлюкозаПолисахариды в процессе движения по ЖКТ расщепляются
- 103. ДИСАХАРИДЫ
- 104. ДисахаридыДисахариды - это сложные сахара, каждая молекула
- 105. СахарозаСостоит из остатков глюкозы и фруктозы.
- 106. Структурная формула
- 107. Гидролиз
- 108. Для дисахаридов характерна реакция гидролиза (в кислой среде или под действием ферментов), в результате которой образуются моносахариды:
- 109. При гидролизе различные дисахариды расщепляются на составляющие
- 110. Гидролиз
- 111. Схема получения сахарозы видео
- 112. Полисахариды.КрахмалЦеллюлоза
- 113. Слайд 113
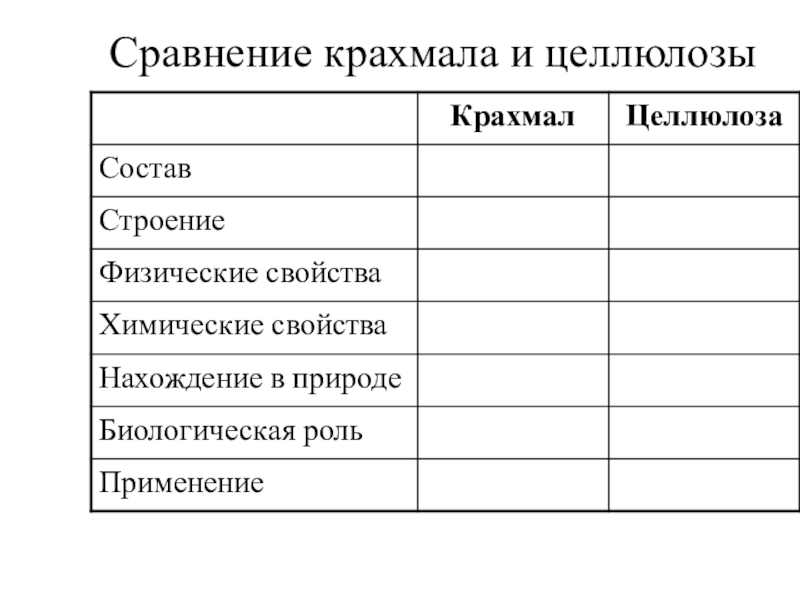
- 114. Сравнение крахмала и целлюлозы
- 115. Структурная формула крахмалаОстатки α - глюкозы
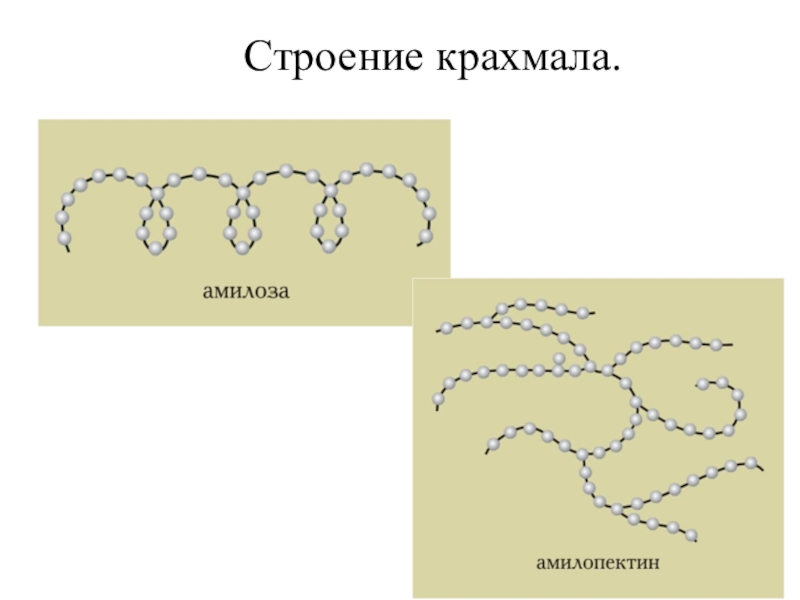
- 116. Строение крахмала.
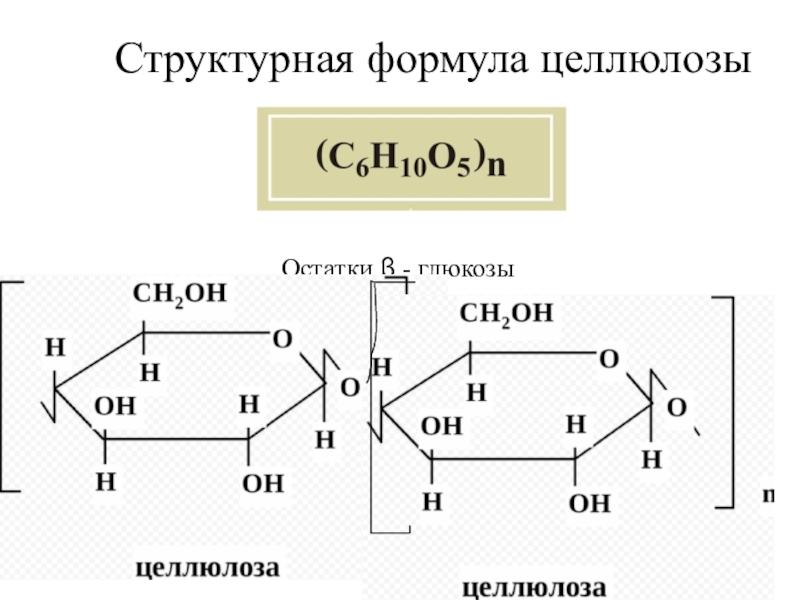
- 117. Структурная формула целлюлозыОстатки β - глюкозы
- 118. Физические свойствабелый аморфный порошокне растворяется в холодной
- 119. Химические свойства крахмалаКачественная реакция(С6Н10О5)n + I2 →
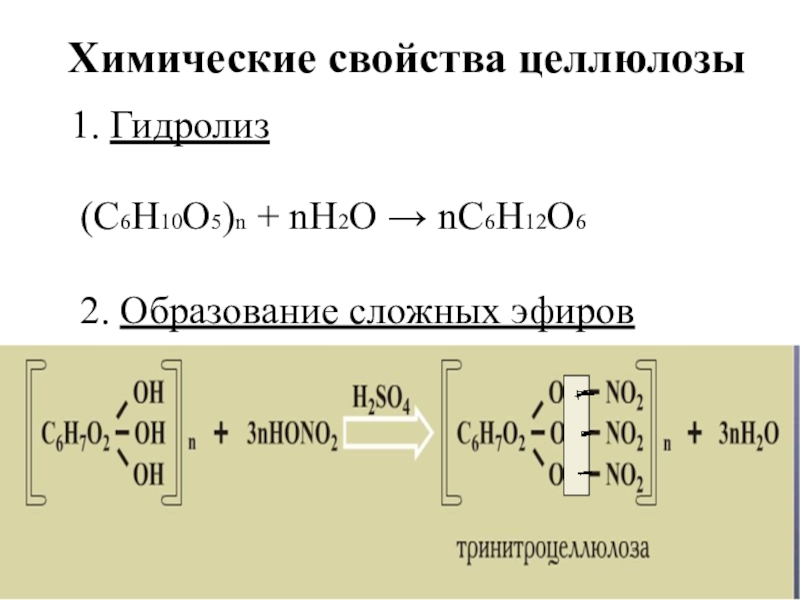
- 120. Химические свойства целлюлозыГидролиз(С6Н10О5)n + nH2O → nC6H12O62. Образование сложных эфиров
- 121. Получение ацетатного волокна
- 122. Исследование растворимости целлюлозы в органических и неорганических растворителях
- 123. Почему при долгом пережевывании хлеб приобретает сладковатый вкус?
- 124. Определение крахмала в продуктах питания
- 125. Амины – продукты замещения одного, двух или
- 126. Различают амины -
- 127. 4. Изомерия аминов.Задание 3-ей группе.Изучите предложенные структурные
- 128. Метиламин, диметиламин и триметиламин – газы; средние
- 129. Химические свойства аминов.
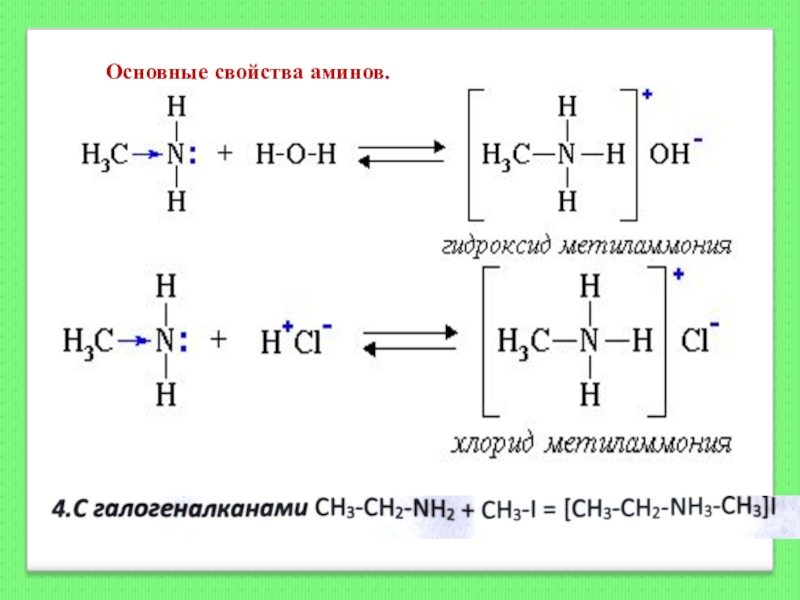
- 130. Основные свойства аминов.
- 131. Р. нитрирования (с НО – NО) проходит
- 132. Вопрос: Аммиак или амины обладают более сильно
- 133. 4СH3NH2 + 9O2 = 4CO2 + 10H2O
- 134. Реакции замещения( бромирование)NH2+ 3 Br2NH2BrBrBr+ 3 HBr2462, 4, 6 - трибромроанилинанилин
- 135. Слайд 135
- 136. Назвать вещества:CH3 – CH2 – CН2 –
- 137. 1. АНИЛИН – ПРЕДСТАВИТЕЛЬ Вопросы и ответы
- 138. ВОПРОСЫ1. Какие из приведенных веществ относятся к
- 139. Определите формулу вторичного амина, массовые доли атомов
- 140. аминокислоты Презентацию выполнила:Пелипенко Ирина ВладимировнаУчитель химии «Красноярской
- 141. Ответ .«Аминокислоты »
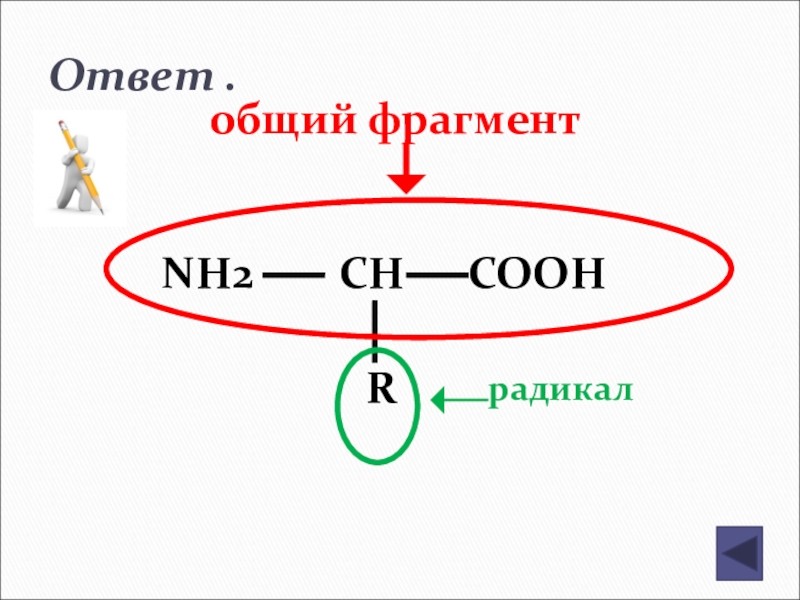
- 142. Ответ .NH2 CH
- 143. NH2 – CH - COOH
- 144. Аминокислоты –гетерофункцио-нальные соединения , которые обязательно содержат
- 145. Международная номенклатура АК.CH2 COOHNH2
- 146. Номенклатура аминокислот с использованием букв греческого алфавита.
- 147. Исторически сложившиеся названия аминокислот. CH3
- 148. Изомерия углеродного скелета аминокислот. 4
- 149. Изомерия положения аминогруппы. 4
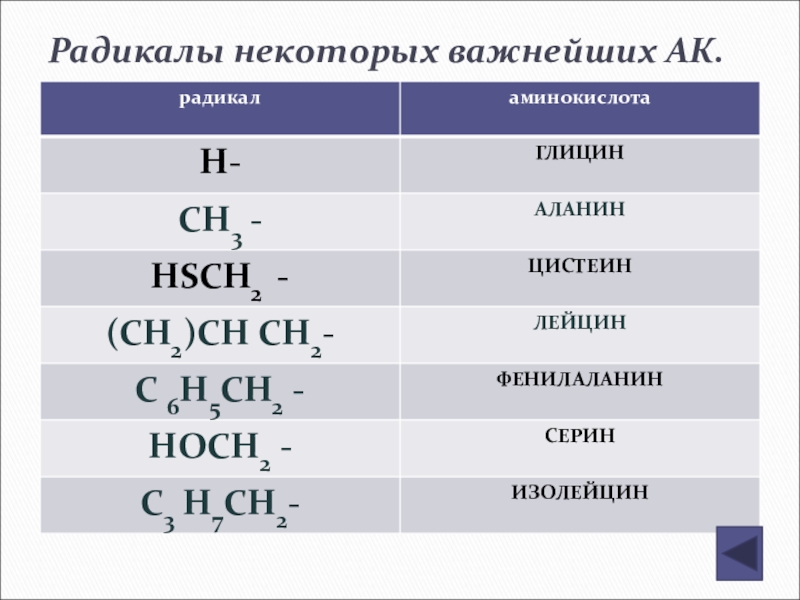
- 150. Радикалы некоторых важнейших АК.
- 151. Получение аминокислот.
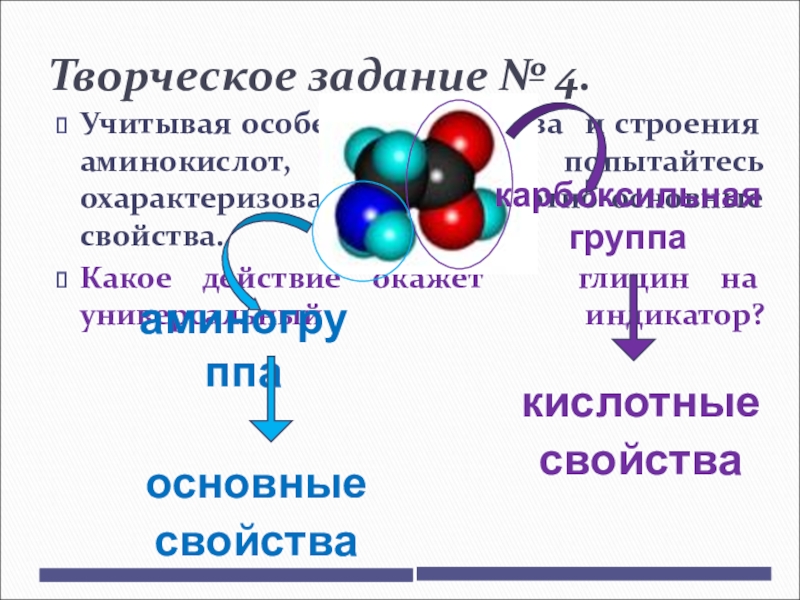
- 152. Творческое задание № 4. Учитывая особенности состава
- 153. Нейтральная реакция раствора глицинаУниверсальный индикатор
- 154. Творческое задание № 5.
- 155. Б/ц кристаллические вещества, температура плавления > 2000,
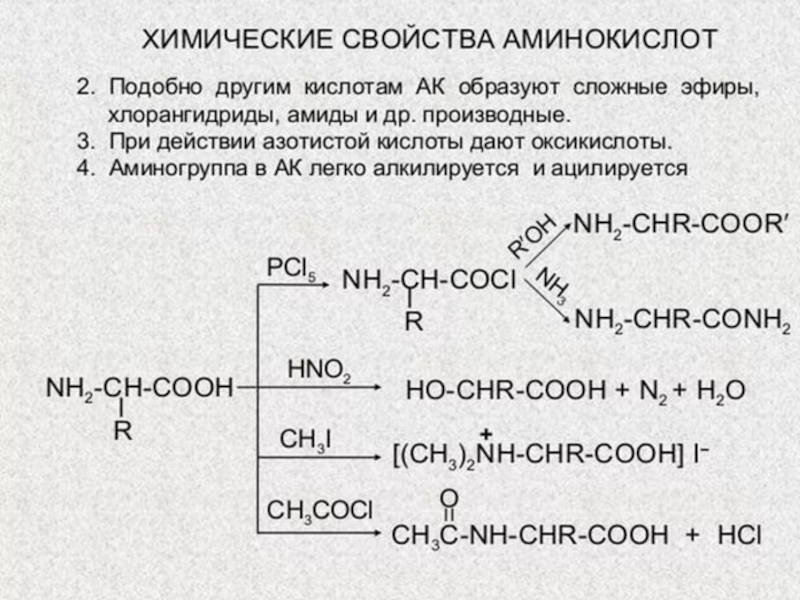
- 156. б) со спиртамиNH2-CH-COOH+С2Н5ОН NH2-CH-COOС2Н5 + H2O
- 157. Химические свойства
- 158. Слайд 158
- 159. Реакция поликонденсации
- 160. Схема образования пептидовH2NCHRCOHOH +
- 161. Горение аминокислот. 4NH2CH2COOH + 13O2 8CO2
- 162. Этерификация NH2CH2COOH + C2H5OH NH2CH2COOC2H5 + H2O H2SO4 (к)
- 163. O H
- 164. 1806г. Луи Воклен и Пьер РобикеСок спаржи
- 165. 1909г. К. Икеда Сушеные водоросли – усиливают
- 166. Белки Белки́ (полипептиды) - природные высокомолекулярные органические
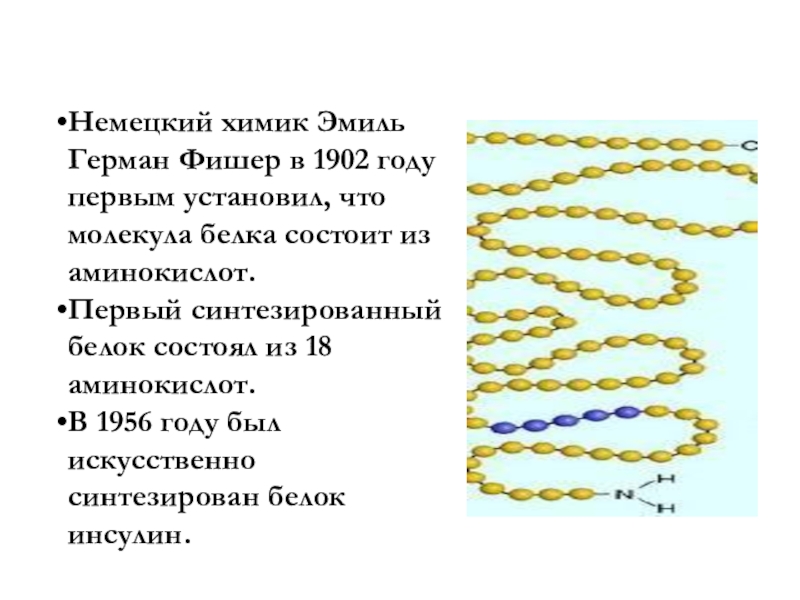
- 167. Это интересноНемецкий химик Эмиль Герман Фишер
- 168. Функции белковФункции белков в природе:каталитические (ферменты); регуляторные
- 169. Химический составПептидная связь. Остатки аминокислот в белках
- 170. Физико – химические свойстваВысокая вязкость растворов, незначительная
- 171. Элементный состав белков: - углерод (50-55%) -
- 172. Уровни структурной организацииПервичная структура – последовательность соединения
- 173. Слайд 173
- 174. Вторичная структура –спиралевидная структура, полипептидная цепь которой
- 175. Третичная структура - форма закрученной спирали в
- 176. Четвертичная структура - белковые комплексы, образованные за счет взаимодействия разных полипептидных цепей
- 177. Гидролиз белковГидролиз протекает в кислой или щелочной
- 178. Слайд 178
- 179. Денатурация белкаОсторожно нагреем раствор белка до кипения,
- 180. Денатурация белка Это нарушение структурной
- 181. Денатурация белка
- 182. Слайд 182
- 183. Цветные реакции на белок Ксантопротеиновая реакция (на
- 184. Цветные реакции на белокЦистеиновая реакция Фоля (на
- 185. Цветные реакции на белокБиуретовая реакция (на пептидные
- 186. Роль белков для человекаБелки, распадаясь в организме,
- 187. Слайд 187
- 188. Слайд 188
- 189. Слайд 189
- 190. Слайд 190
- 191. Слайд 191
- 192. Слайд 192
- 193. Слайд 193
- 194. Слайд 194
- 195. Слайд 195
- 196. Слайд 196
Слайд 3Презентация по химии «Альдегиды»
10 класс. УМК Габриеляна О.С.
Муниципальное общеобразовательное учреждение
средняя
г. Владикавказ
Автор Сикорская О.Э.,
учитель химии
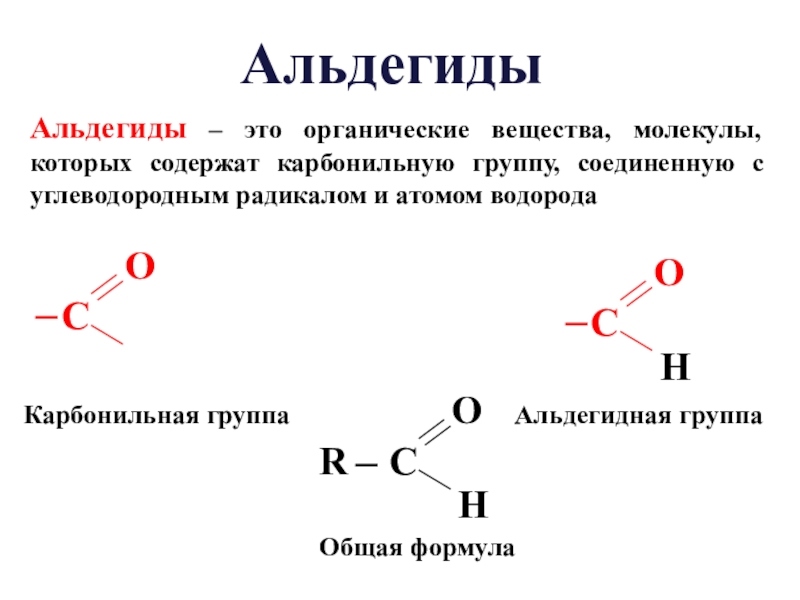
Слайд 4Альдегиды – это органические вещества, молекулы, которых содержат карбонильную группу, соединенную
Общая формула
Альдегидная группа
Карбонильная группа
Альдегиды
Слайд 5Альдегиды
Кетоны
C
R
O
H
C
O
R
R
-
- он
СН3 – С – СН3
||
O
Пропаналь
Пропанон
CnH2nO
Альдегиды и кетоны
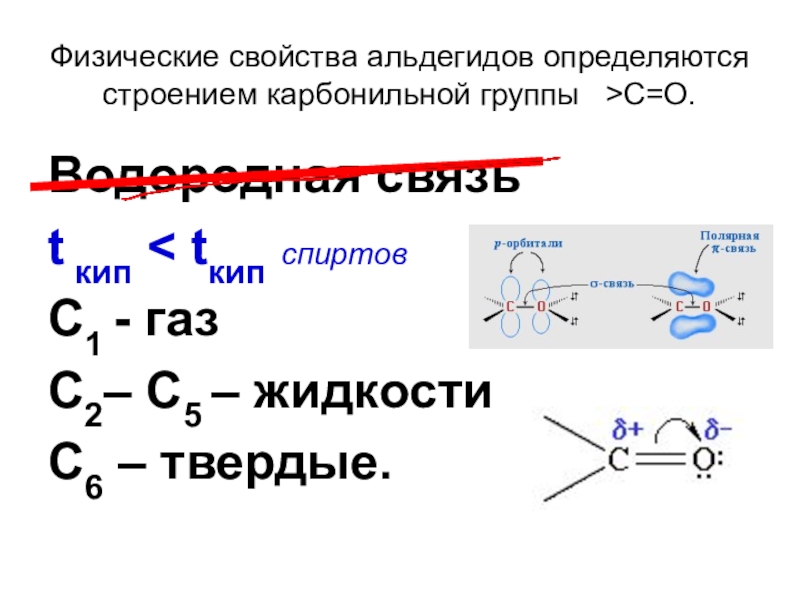
Слайд 9Физические свойства альдегидов определяются строением карбонильной группы >C=O.
Водородная связь
t кип
С1 - газ
С2– С5 – жидкости
С6 – твердые.
Слайд 14Реакции окисления
3. Каталитическое окисление.
а) 2СН2 = СН2 + О2
этен уксусный альдегид
Условия реакции: катализатор – влажная смесь двух солей PdCl2 и CuCl2.
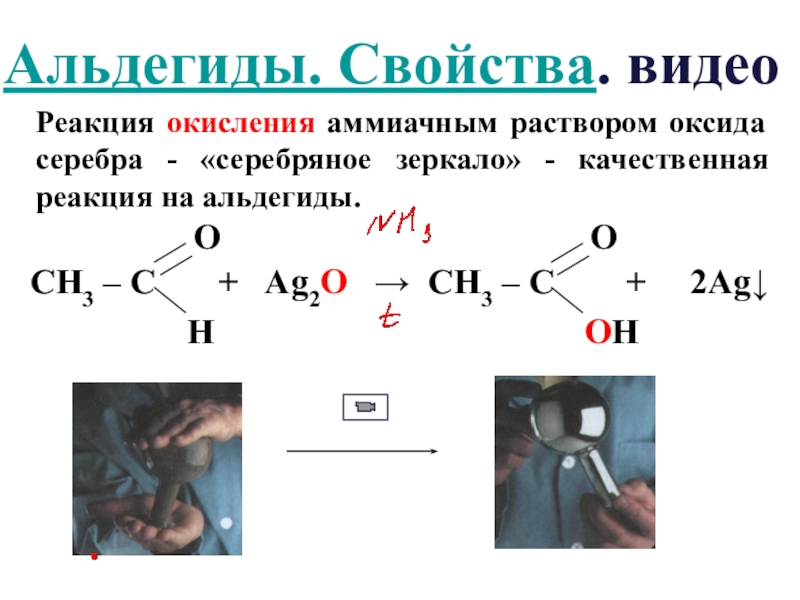
Слайд 18Реакция окисления аммиачным раствором оксида серебра - «серебряное зеркало» - качественная
Альдегиды. Свойства. видео
Слайд 19Реакция окисления гидроксидом меди (II) при нагревании – качественная реакция на
Альдегиды. Свойства. видео
Слайд 20Реакция восстановления водородом в соответствующие спирты - гидрирование.
Альдегиды. Свойства.
Слайд 23Отличительной чертой многих альдегидов является их запах. Высшие альдегиды, особенно непредельные
Их используют в пищевой промышленности и парфюмерии.
Альдегиды в природе
Слайд 24Тема урока: «Предельные одноосновные карбоновые кислоты»
Цель урока:
•Знать строение одноосновных карбоновых кислот,
•Уметь объяснять причины и следствия взаимного влияния атомов в молекулах карбоновых кислот.
•На примере муравьиной и уксусной кислот уметь составлять уравнения реакций, характеризующих химические свойства карбоновых кислот.
Слайд 25Карбоновые кислоты
Давайте вспомним, какие классы кислородсодержащих органических веществ мы уже знаем.
Каким
Слайд 26
Карбоновые кислоты-
органические соединения,
содержащие одну или
несколько карбоксильных
групп- СООН
связанных с
углеводородным
Слайд 27Классификация карбоновых кислот
По числу карбоксильных
групп
непредельные
ароматические
одноосновные
двухосновные
многоосновные
предельные
По типу углеводородного
радикала
Слайд 30Все карбоновые кислоты имеют функциональную группу.
Что называется карбоновыми кислотами?
Классификация карбоновых
В зависимости от числа карбоксильных групп
● одноосновные – уксусная
● двухосновные – щавелевая
● многоосновные - лимонная
Слайд 312) В зависимости от природы радикала
● предельные – пропионовая
● непредельные –
● ароматические – бензойная
? Задание для самоконтроля
Изомерия карбоновых кислот
СН3-СН2-СН2-СООН
СН3-СН-СООН
l
СН3
Какой вид изомерии присущ карбоновым кислотам?
Номенклатура карбоновых кислот
? Задание для самоконтроля
Слайд 32 Многие кислоты имеют исторически сложившиеся или
тривиальные названия,
источником их получения.
Карбоновые кислоты в природе
Слайд 33Более подробно рассмотрим предельные одноосновные карбоновые кислоты,
которые образуют
гомологический ряд.
Общая формула
карбоновых кислот
Строение карбоксильной группы
Ответьте на вопросы:
Как происходит перераспределение электронной плотности в карбоксильной группе?
В чем заключается взаимное влияние атомов в молекулах карбоновых кислот?
Как это будет отражаться на химических свойствах карбоновых кислот?
? Проверь себя
Слайд 39 Почему среди кислот отсутствуют газообразные вещества?
Это
Образованием водородных связей можно объяснить и растворимость карбоновых кислот в воде.
Химические свойства карбоновых кислот
Общие свойства карбоновых кислот аналогичны соответствующим свойствам неорганических кислот:
1. Диссоциация в водных растворах (среда кислая, индикаторы меняют окраску).
2. Карбоновые кислоты вступают в реакцию замещения с металлами, стоящими в ряду напряжений до водорода.
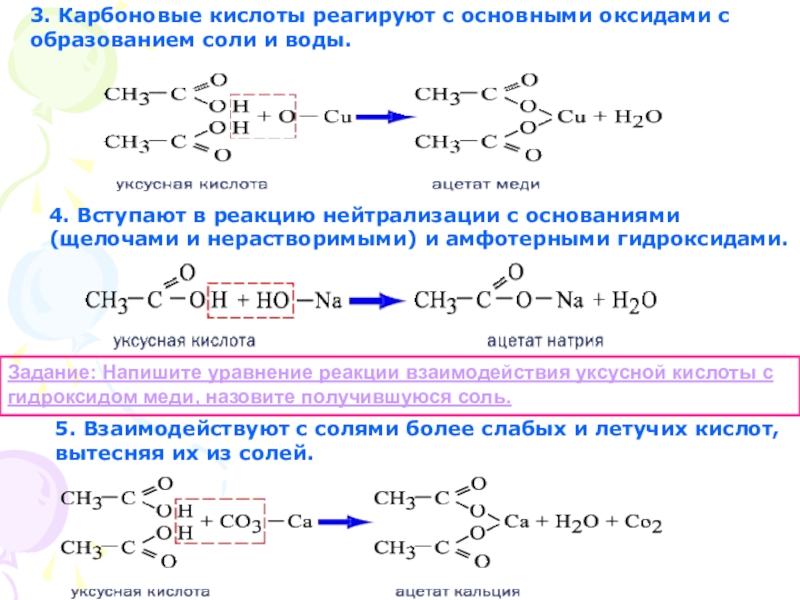
Слайд 403. Карбоновые кислоты реагируют с основными оксидами с образованием соли и
4. Вступают в реакцию нейтрализации с основаниями (щелочами и нерастворимыми) и амфотерными гидроксидами.
Задание: Напишите уравнение реакции взаимодействия уксусной кислоты с гидроксидом меди, назовите получившуюся соль.
5. Взаимодействуют с солями более слабых и летучих кислот, вытесняя их из солей.
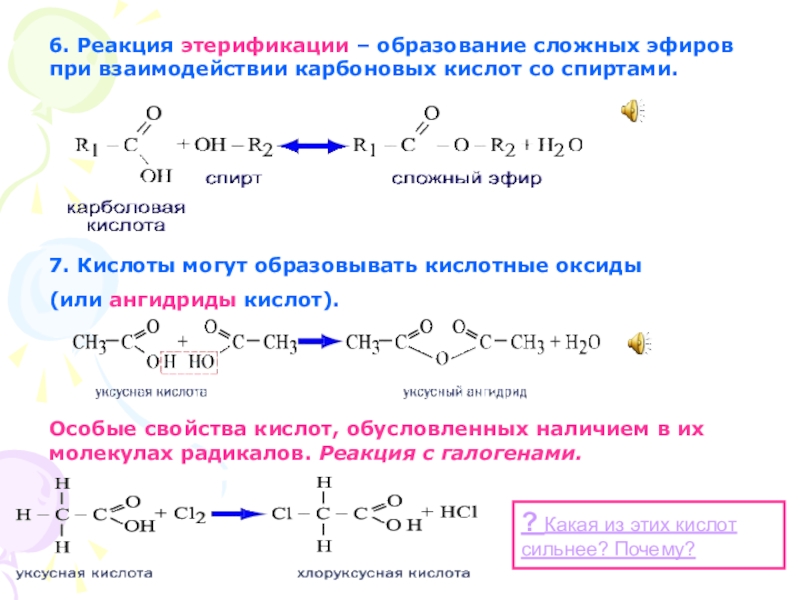
Слайд 416. Реакция этерификации – образование сложных эфиров при взаимодействии карбоновых кислот
7. Кислоты могут образовывать кислотные оксиды
(или ангидриды кислот).
Особые свойства кислот, обусловленных наличием в их молекулах радикалов. Реакция с галогенами.
? Какая из этих кислот сильнее? Почему?
Слайд 42Получение карбоновых кислот
Предельные карбоновые кислоты получают:
1. Окислением спиртов
2. Окислением альдегидов
3. Окислением
Существуют и другие способы получения карбоновых кислот
Слайд 45Генетическая связь карбоновых кислот с другими классами органических соединений отражена в
? Попробуйте подтвердить данную цепочку превращений уравнениями химических реакций, взяв за основу этан
С отдельными представителями карбоновых кислот (муравьиной, уксусной, стеариновой, пальмитиновой, олеиновой), а также с особенностями их свойств, применением и получением, мы познакомимся на последующих уроках.
Для тех, кто не справился с цепочкой в классе, выполните ее дома
Слайд 46Тема урока: «Предельные одноосновные карбоновые кислоты»
Цель урока:
● Знать строение одноосновных карбоновых
●Уметь объяснять причину и следствия взаимного влияния атомов в молекулах карбоновых кислот.
● Уметь составлять уравнения химических реакций, характеризующих химические свойства кислот
Слайд 47Номенклатура сложных эфиров
Сложные эфиры в природе
Назовите данные
природные эфиры
В случае затруднения воспользуйтесь
1.
2.
3.
Слайд 481.
Изобутилацетат или изобутиловый эфир уксусной кислоты
2.
Изопентилацетат или изопентиловый эфир уксусной кислоты
3.
Этилпропионат
Слайд 49Назовите карбоновые кислоты
СН2-СН2-СН2-СН-СН-СООН
СН3 СН3
СН3 СН3
l l
2. СН3-СН-С-СООН
l
СН3
В случае затруднения воспользуйтесь шпаргалкой
Проверь себя
Слайд 51В случае затруднений воспользуйтесь формулами для осуществления цепочки превращений и выполните
Слайд 53Для определения названия кислоты в соответствии с номенклатурой IUPAC нужно придерживаться
Главную цепь выбирают таким образом, чтобы атом углерода карбоксильной группы оказался в ней.
Нумерация атомов углерода главной цепи начинается с атома углерода карбоксильной группы.
Полное название данной кислоты образуется от названия алкана с тем же числом атомов углерода в молекуле с добавлением «-овая кислота».
Если углеводородный радикал разветвлен, то сначала называют номер атома углерода, при котором находится радикал, затем через дефис называют сам радикал. Обратите внимание, что отсутствие дефиса в данном случае считается за ошибку. Если с основной цепью соединены два различных радикала, то первым из них указывается наиболее простой. Если с основной цепью соединены два или более одинаковых радикалов, то их количество указывается с использованием соответствующих префиксов: -ди, -три, -тетра и т. д.
Слайд 54Ответы на вопросы
● Электронная плотность в карбонильной группе (особенно σ-связи) смещена
● Влияние радикала на карбоксильную группу объясняется сдвигом электронной плотности к центральному атому углерода. В результате его частичный положительный заряд уменьшается и его действие на электронную плотность атома кислорода –ОН- группы ослабляется, а, значит, отщепление ионов водорода затрудняется. Как следствие – самая сильная-муравьиная кислота.
● Карбоксильная группа влияет на радикал таким образом, что наиболее легко замещаемым становится водород при α-углеродном атоме.
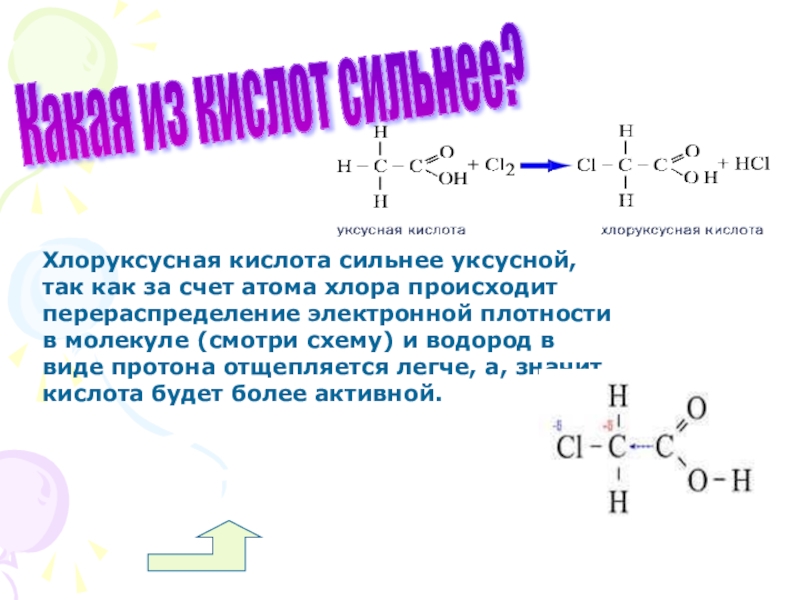
Слайд 55Какая из кислот сильнее?
Хлоруксусная кислота сильнее уксусной, так как за
Слайд 57Сложные эфиры.
В 1759г.- Лаурагвайс перегонял уксусную кислоту с винным спиртом -получил
этиловый эфир
уксусной кислоты
1781г.-Карл Шелле ввёл название-эфир
Слайд 58Строение
При взаимодействии карбоновых кислот со спиртами (реакция этерификации) образуются сложные эфиры:
Слайд 59Строение(продолжение)
Эта реакция обратима. Продукты реакции могут взаимодействовать друг с другом с
Слайд 61Сложные эфиры.
В зависимости от молекулярной массы сложные эфиры могут быть жидкими
Сложные эфиры плохо растворяются в воде. В органических растворителях сложные эфиры растворяются хорошо.
Температура кипения сложных эфиров органических кислот ниже чем соответствующих спиртов и кислот.
Слайд 66Жиры
Цели урока: Изучить жиры:
состав,
классификация,физические и химические свойства,
переработка,
биологические функции,
превращение в организме
Слайд 67План:
История открытия липидов
Состав
Классификация
Физические свойства
Химические свойства
Источники
Получение жиров
Применение
Роль жиров в
Слайд 68История открытия жиров
Элементный анализ жиров был проведен в XIX в. А.
В 1779 г. К. Шееле установил, что в состав жиров входит глицерин
В 1808 г. М. Э. Шёврель установил, что мыло – натриевая соль высшей жирной кислоты. Впервые были получены стеариновая, олеиновая, капроновая кислоты. Показал, что жиры состоят из глицерина и жирных кислот, причем это не просто смесь, а соединение, которое,
Слайд 69 присоединяя воду, распадается на глицерин и кислоты.
Шёврель вместе
Синтез жиров осуществил в 1850-х годах Марселен Бертло, нагревая в запаянных стеклянных трубках смесь глицерина с жирными кислотами. Методом синтеза он установил строение жиров.
Фосфолипиды были выделены М. Гобли в 1847г., а затем получены в более чистом виде Ф.А. Хоппе-Зейлером в 1877 г.
Слайд 70В состав жира входит 5-8 остатков различных кислот (в сливочном масле
преобладают предельные кислоты,в составе растительных - непредельные
Общая формула молекулы жира
Слайд 72Липиды
Простые
(ацильные остатки одинаковы)
Сложные
Жиры
(триглицериды)
Воски
(высшие КК, высшие спирты)
Сложные эфиры
стеринов
Фосфолипиды (высшие КК, глицерин, остатки H3PO4 и азотистых оснований)
Гликолипиды (многоатомные спирты, КК,
углеводы)
Липопротеиды (белки и липиды)
Слайд 73Животные
Растительные
Жиры
Твёрдые
Жидкие
Твёрдые
Жидкие
Жиры (по применению)
Пищевые
Медицинские
Технические
(по происхождению)
(по агрегатному состоянию)
Слайд 74Физические Свойства
Животные жиры плавятся при высокой t0C
Растительные жиры при низкой t0С
Высокая
Слабо проводят тепло и электричество
Плохо растворяются в воде
Растворяются в бензине, бензоле,хлороформе
Слайд 76Жир
(триглицерид)
глицерин
Карбоновые
к-ты
Гидролиз
Водяным паром под давлением или в кислой среде при
Слайд 77+3C17H35 COOH
+3 C17H35COONa
Жир
(триглицерид)
глицерин
Мыло
(стеарат натрия)
Гидролиз
Щелочной (омыление) образуются мыла
Стеариновая кислота
Слайд 80Прогоркание
Вызывает появление специфического запаха и неприятного вкуса, т. е. снижение
Жиры и масла окисляются кислородом воздуха, превращаясь в пероксиды и гидроксиды, которые образуют продукты окисления- спирты, альдегиды, кетоны и др. Вещества, содержащие карбонильную группу, обусловливают прогорклость жиров, усиливающуюся ферментами.
Слайд 81Животный жир:
Измельчение
Вытапливание
Очистка
Растительные масла:
Растворение в
растворителях
Нагревание
(испарение растворителей)
Технология получения жиров
Слайд 84Ход урока
Заполнение первой колонки «Знаю»
Выдвижение гипотезы и заполнение второй колонки «Хочу
Лабораторная работа по проверке гипотезы и заполнение третьей колонки «Узнал»
Выдвижение новой гипотезы и заполнение колонки «Хочу знать»
Построение формулы глюкозы
Создание синквейна
Слайд 89ПОЛУЧЕНИЕ ГЛЮКОЗЫ
1) Реакция фотосинтеза
6СО2 + 6H2O → С6Н12 О6 + 6О2
2) Реакция полимеризации
О
6 Н – С → С6Н12 О6
Н
3) Гидролиз крахмала
(С6Н10 О5 )n + n H2O → n С6Н12 О6
Слайд 90Гидролиз дисахаридов:
C12H22O11 + H2O t,H+→ 2 C6H12O6
мальтоза глюкоза
C12H22O11+H2O
сахароза глюкоза фруктоза
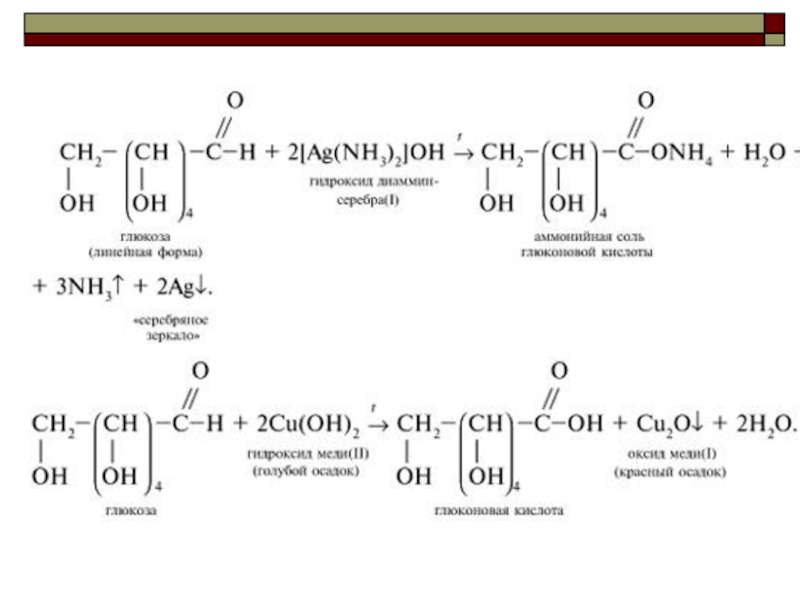
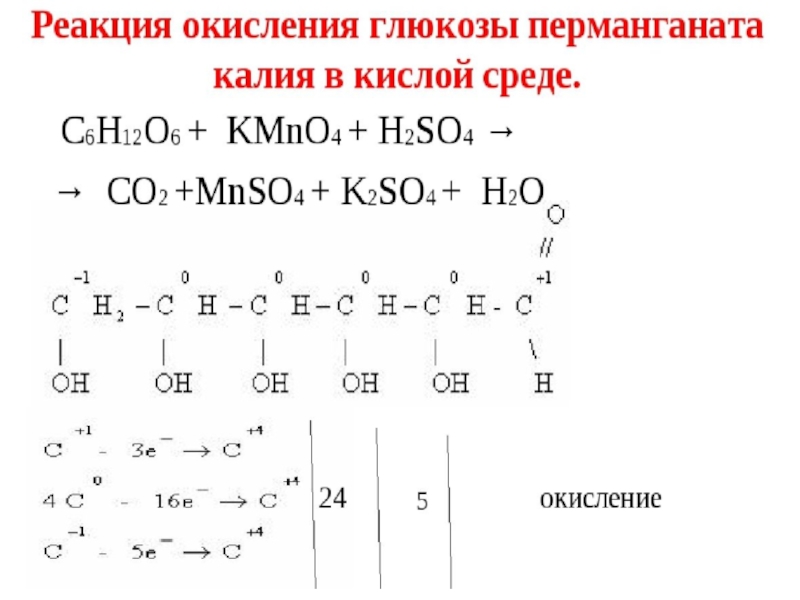
Слайд 91ХИМИЧЕСКИЕ СВОЙСТВА
Реакция Реакция “Реакция “серебряного зеркалаРеакция “серебряного зеркала” видео
СН2ОН – (СНОН)4
СН2ОН – (СНОН)4 – СООН + 2Ag↓
2) Взаимодействие с гидроксидом меди Взаимодействие с гидроксидом меди (IIВзаимодействие с гидроксидом меди (II) видео
СН2ОН – (СНОН)4 – СОН + 2Сu(ОН)2 →
СН2ОН – (СНОН)4 –СООН +Сu2О +2Н2 О
Слайд 93Качественная реакция, доказывающая, что глюкоза является многоатомным спиртом - происходит растворение
Слайд 94ХИМИЧЕСКИЕ СВОЙСТВА
3) Гидрирование глюкозы
СН2ОН – (СНОН)4 – СОН + Н2 →
СН2ОН – (СНОН)4 – СН2 ОН
сорбит
Слайд 97СПЕЦИФИЧЕСКИЕ СВОЙСТВА
а) Спиртовое брожение (под действием дрожжей)
С6Н12 О6 →
б) Молочнокислое брожение (под действием молочнокислых бактерий)
Слайд 98СПЕЦИФИЧЕСКИЕ СВОЙСТВА
в) Маслянокислое брожение
С6 Н12 О6 → С3 Н7 СООН +
масляная кислота
Слайд 100
Глюкоза - необходимый компонент пищи;
Является одним из главных участников обмена веществ
Очень питательна и легко усваивается;
При её окислении выделяется больше трети используемой в организме энергии.
Глюкоза
Слайд 101Глюкоза
Глюкоза – самый важный из всех моносахаридов;
Является структурной единицей для построения
ди- и полисахаридов;
С пищей к нам поступают
моно-, ди- и полисахариды;
Моносахариды всасываются в кишечнике.
Слайд 102Глюкоза
Полисахариды в процессе движения по ЖКТ расщепляются на отдельные молекулы моносахаридов;
Всасываются
Поступают в печень;
Общий кровоток транспортируется в другие ткани.
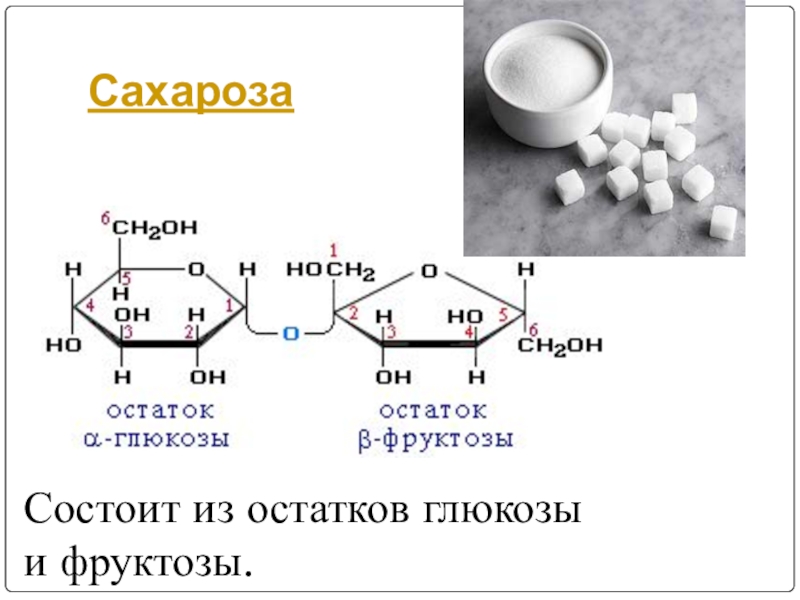
Слайд 104Дисахариды
Дисахариды - это сложные сахара, каждая молекула которых при гидролизе распадается
Дисахариды имеют формулу С12Н22О11
К дисахаридам относятся:
-сахароза (глюкоза + фруктоза) ,
-лактоза (глюкоза + галактоза) ,
-мальтоза (глюкоза + глюкоза), ,
-целобиоза
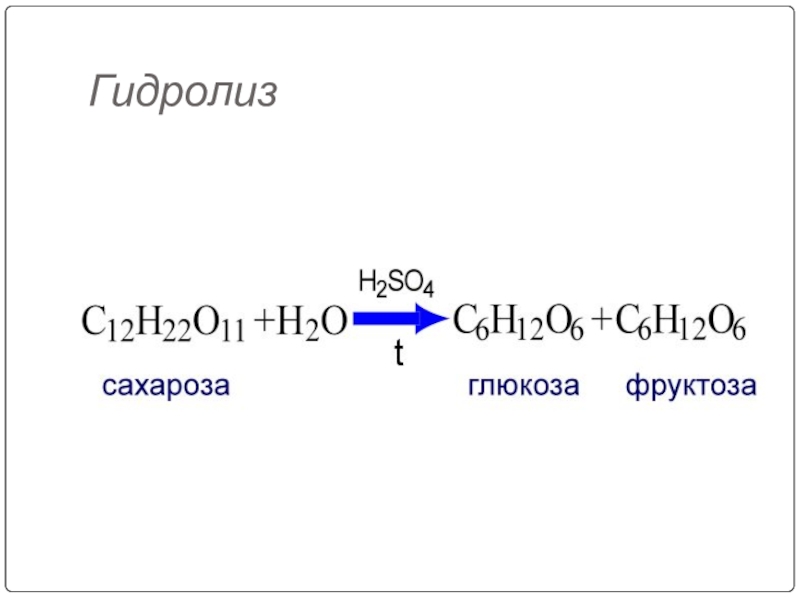
Слайд 108Для дисахаридов характерна реакция гидролиза (в кислой среде или под действием ферментов), в
Слайд 109При гидролизе различные дисахариды расщепляются на составляющие их моносахариды за счёт
Таким образом, реакция гидролиза дисахаридов является обратной процессу их образования из моносахаридов.
Слайд 118Физические свойства
белый аморфный порошок
не растворяется в холодной воде
в горячей воде разбухает
не
твердое волокнистое белое вещество
не растворяется в воде
не обладает сладким вкусом
крахмала
целлюлозы
Слайд 119Химические свойства крахмала
Качественная реакция
(С6Н10О5)n + I2 → синее окрашивание
2. Гидролиз
(С6Н10О5)n +
Крахмал → декстрины → мальтоза → глюкоза
Слайд 120Химические свойства целлюлозы
Гидролиз
(С6Н10О5)n + nH2O → nC6H12O6
2. Образование сложных эфиров
Слайд 125Амины – продукты замещения одного, двух или трех атомов водорода в
функциональная группа - NH2 аминогруппа
Слайд 1274. Изомерия аминов.
Задание 3-ей группе.
Изучите предложенные структурные формулы аминов. Предположите, какие
CH3 – NH – C2H5 метилэтиламин
Слайд 128Метиламин, диметиламин и триметиламин – газы;
средние члены алифатического ряда –
высшие – твердые вещества.
Низшие амины хорошо растворимы в воде и имеют резкий запах.
С увеличением молекулярной массы увеличиваются t° кип. и t° пл.; уменьшается растворимость в воде.
Анилин – маслянистая жидкость, ограниченно растворимая в воде, кипящая при температуре 184˚С.
5. Физические свойства.
Слайд 131Р. нитрирования (с НО – NО) проходит по-разному:
а) у первичных аминов:
R-NH2+НО–NО(NaNO2+HCl)→R–OH+N2+NaCl+
б) у вторичных аминов:
R2–NH+НО–NО(NaNO2 + HCl)→ R2N –N=O+ NaCl +H2O
Слайд 132Вопрос:
Аммиак или амины обладают более сильно выраженными основными свойствами?
Вопрос. У
C6H5NH2 < NH3 < RNH2 < R2NH
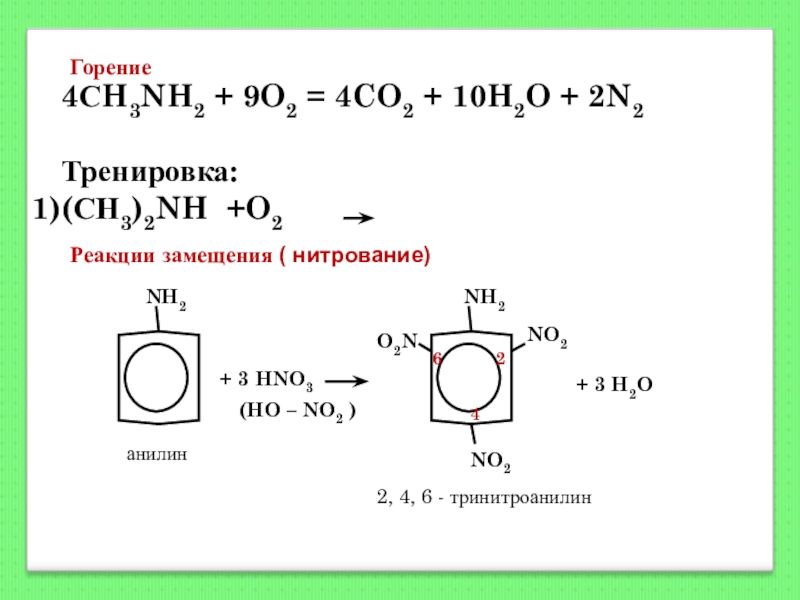
Слайд 1334СH3NH2 + 9O2 = 4CO2 + 10H2O + 2N2
Тренировка:
(СН3)2NH +O2
Горение
Реакции замещения ( нитрование)
NH2
+ 3 HNO3
(HO – NO2 )
NH2
NO2
NO2
O2N
+ 3 H2O
2
4
6
2, 4, 6 - тринитроанилин
анилин
Слайд 134Реакции замещения( бромирование)
NH2
+ 3 Br2
NH2
Br
Br
Br
+ 3 HBr
2
4
6
2, 4, 6 - трибромроанилин
анилин
Слайд 136Назвать вещества:
CH3 – CH2 – CН2 – NH2
CH3 – CН2 –
Вещества называют по тем радикалам,
которые входят в состав молекулы, с прибавлением слова “амин”.
СН3 – СН = СН2
СН3 - СН - СН = СН2
|
СН3
Слайд 1371. АНИЛИН – ПРЕДСТАВИТЕЛЬ
Вопросы и ответы по теме: АНИЛИН
ароматических аминов
2.
а) С6Н6 , б) С6Н5NO2 , в)С6Н5NН2
в)С6Н5NН2
3. Анилин … жидкость, растворяется в органических растворителях, ЯД.
маслянистая
4. Анилин бесцветный, но на воздухе из-за быстрого окисления …
желтеет
Слайд 138ВОПРОСЫ
1. Какие из приведенных веществ относятся к аминам?
2. Напишите уравнение реакций
а) с водой;
б) с бромоводородной кислотой.
Дайте названия продуктам реакций.
Слайд 139Определите формулу вторичного амина, массовые доли атомов углерода, водорода и азота,
С: Н: N =
С: Н: N = 3 : 9 : 1
СН3-NН – С2Н5
метилэтиламин - С3Н9N
Слайд 140аминокислоты
Презентацию выполнила:
Пелипенко Ирина Владимировна
Учитель химии «Красноярской средней общеобразовательной школы с
Кривошеинского района
Томской области
2009
Слайд 143
NH2 – CH - COOH
R
Органические соединения, в молекулах которых содержатся карбоксильная группа СООН и аминогруппа NH2, связанные углеводородным радикалом R
Производные карбоновых кислот, у которых атом Н в радикале замещен на аминогруппу
СН3СООН уксусная кислота
H – СН - СООН аминоуксусная кислота
|
NH2
(глицин)
Слайд 144Аминокислоты –гетерофункцио-нальные соединения , которые обязательно содержат две функци-ональные группы: аминогруппу
Слайд 145Международная номенклатура АК.
CH2 COOH
NH2
CH2
NH2
аминоуксусная
кислота
3-аминопропионовая кислота
Слайд 146Номенклатура аминокислот с использованием букв греческого алфавита.
CH2
NH2
β α
β-аминопропионовая кислота
3 2 1
Слайд 147Исторически
сложившиеся названия аминокислот.
CH3 CH 2
NH2
δ γ β α
α- аминовалериановая кислота
Слайд 148Изомерия углеродного скелета аминокислот.
4
CH3 CH2 CH COOH
NH2
CH3
3 2 1
CH3 C COOH
NH2
2-аминобутановая кислота
2-амино-2-метилпропановая
кислота
Слайд 149Изомерия положения аминогруппы.
4
CH3 CH2 CH COOH
NH2
4 3 2 1
CH3 CH CH2 COOH
NH2
2-аминобутановая кислота.
3-аминобутановая кислота.
Слайд 151Получение аминокислот.
СН3 СООН Сl2 Сl СН2 СООН Н Сl
Сl СН2 СООН 2NН3 NН2СН2 СООН NН4 Сl
Сl СН2 СООН + NН3 NН2СН2 СООН + Н Сl
Слайд 152Творческое задание № 4.
Учитывая особенности состава и строения аминокислот, попытайтесь
Какое действие окажет глицин на универсальный индикатор?
аминогруппа
карбоксильная группа
основные
свойства
кислотные
свойства
Слайд 154Творческое задание № 5.
Определите реакцию раствора глутаминовой кислоты
NH2
и лизина (NH2-(CH2)4-CH-COOH)
NH2
Щелочная среда (лизин)
Нейтральная среда (глицин)
Кислая среда (глутаминовая кислота) Кислая среда (глутаминовая кислота)
Слайд 155Б/ц кристаллические вещества, температура плавления > 2000, растворимы, сладкие, горькие, безвкусные
Аминокислоты – амфотеры
Как кислоты
а) с основаниями
NH2-CH-COOH + NaOH NH2-CH-COONa + H2O
| |
R R
натриевая соль
аминокислоты
Физические свойства
Химические свойства
Слайд 156б) со спиртами
NH2-CH-COOH+С2Н5ОН NH2-CH-COOС2Н5 + H2O
R R
этиловый эфир
аминокислоты
2) Как основания
а) с кислотами
NH2 – CH – COOH +HCl [ NH3 – CH – COOH]+Сl-
| |
СН3 СН3
хлорид аммония аминопропионовой кислоты
Слайд 159 Реакция поликонденсации
H
| ║ | ║
…H – N – CH – C – OH + …H – N – CH – C – OH
| |
R R1
H O H O
| ║ | ║
…– N – CH – C – N – CH – C – … + H2O
| |
R R1
полипептид
Слайд 163 O H
C – N – пептидная связь
Применение аминокислот
-пищевая промышленность
медицина (глицин)
микробиология
химическая промышленность
Слайд 1641806г. Луи Воклен и Пьер Робике
Сок спаржи выделили
1848г. Рафаэль Пириа
Гидролиз аспарагина аспарагиновая кислота
НО-С-СН2-СН-СООН
║ |
О NH2
Слайд 1651909г. К. Икеда
Сушеные водоросли – усиливают аромат и вкус пищи
Е 621, Е 620, Е 622-625
Назвать кислоту, записать уравнения реакций взаимодействия данной аминокислоты с кислотой, основанием, спиртом
СН3 – СН - СООН
|
NH2
NH2 – С2Н4 - СООН
(аланин)
Слайд 166Белки
Белки́ (полипептиды) - природные высокомолекулярные органические соединения, построенные из остатков
Слайд 167 Это интересно
Немецкий химик Эмиль Герман Фишер в 1902 году первым
Первый синтезированный белок состоял из 18 аминокислот.
В 1956 году был искусственно синтезирован белок инсулин.
Слайд 168Функции белков
Функции белков в природе:
каталитические (ферменты);
регуляторные (гормоны);
структурные (кератин шерсти,
двигательные (актин, миозин);
транспортные (гемоглобин);
запасные (казеин, яичный альбумин);
защитные (иммуноглобулины) и т.д.
Слайд 169Химический состав
Пептидная связь. Остатки аминокислот в белках соединены между собой амидной
Слайд 170Физико – химические свойства
Высокая вязкость растворов, незначительная диффузия, способность к набуханию
При определенном значении pH среды число «+» и «-» зарядов в молекуле белка одинаково.
Белки, как и аминокислоты, амфотерны благодаря наличию свободных NH2- и СООН-групп.
Для них характерны все свойства кислот и оснований.
Слайд 171Элементный состав белков:
- углерод (50-55%)
- кислород (21-23%)
- азот (15-17%)
- водород (6-7%)
- сера (0,3-2,5%).
В составе отдельных белков обнаружены также фосфор, йод, железо, медь и некоторые другие макро- и микроэлементы, в различных, часто очень малых количествах
Слайд 172Уровни структурной организации
Первичная структура – последовательность соединения аминокислотных остатков в полипептидной
Для белков, строение которых отличается исключительной сложностью, кроме первичной, различают более высокие уровни структурной организации: вторичную, третичную, а иногда и четвертичную структуры, но исключительная роль принадлежит первичной структуре
Слайд 174
Вторичная структура –спиралевидная структура, полипептидная цепь которой закреплена множеством водородных связей
Слайд 175
Третичная структура - форма закрученной спирали в пространстве, образованная главным образом
Слайд 176
Четвертичная структура - белковые комплексы, образованные за счет взаимодействия разных полипептидных
Слайд 177Гидролиз белков
Гидролиз протекает в кислой или щелочной среде.
При гидролизе происходит разрушение
При гидролизе белков образуются аминокислоты
Слайд 179Денатурация белка
Осторожно нагреем раствор белка до кипения, растворим в нем несколько
К нейтральному или, лучше, к подкисленному раствору белка добавим равный объем спирта (денатурата). При этом тоже осаждается белок.
К пробам раствора белка добавим немного раствора сульфата меди, хлорида железа, нитрата свинца или соли другого тяжелого металла. Образующиеся осадки свидетельствуют о том, что соли тяжелых металлов в больших количествах ядовиты для организма.
Слайд 180Денатурация белка
Это нарушение структурной организации молекулы белка.
Необратимая происходит в желудке, где сильнокислая среда.