- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме: Виды химической связи.
Содержание
- 1. Презентация по теме: Виды химической связи.
- 2. Виды химической
- 3. Валентность – количество связей.
- 4. Электроотрицательность – способность атома принимать электроны.
- 5. ЭО зависит:1. От количества
- 6. Слайд 6
- 7. Слайд 7
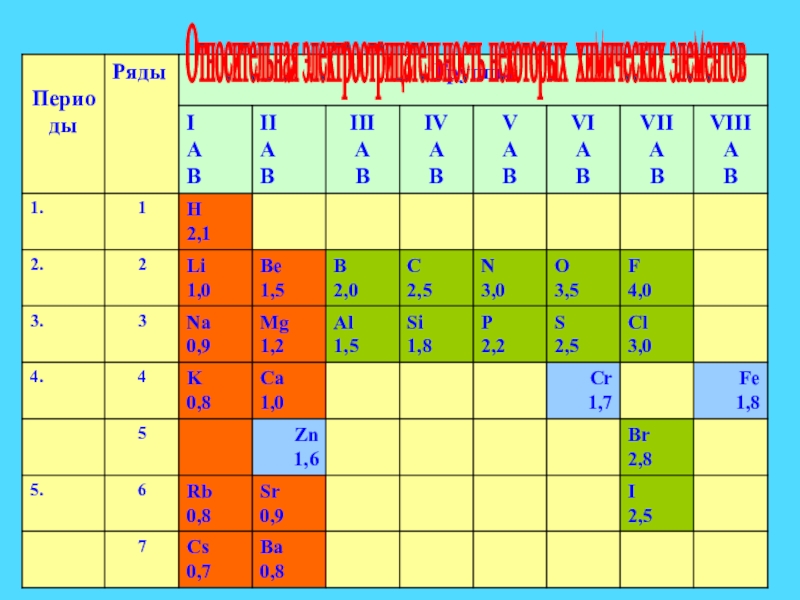
- 8. Относительная электроотрицательность некоторых химических элементов
- 9. Слайд 9
- 10. Ковалентная связь - образуется между атомами
- 11. Ионная связь -образуется между атомами металла
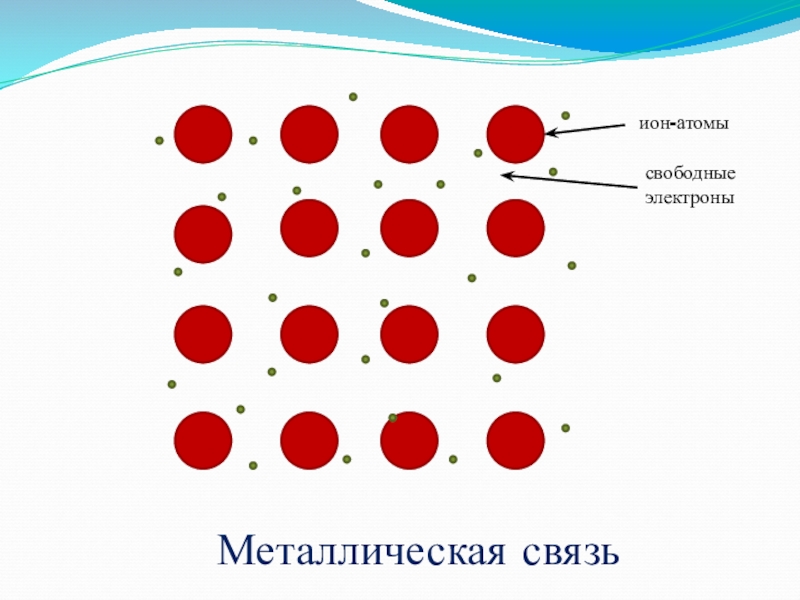
- 12. ++++++++++++++++ион-атомысвободные электроныМеталлическая связь
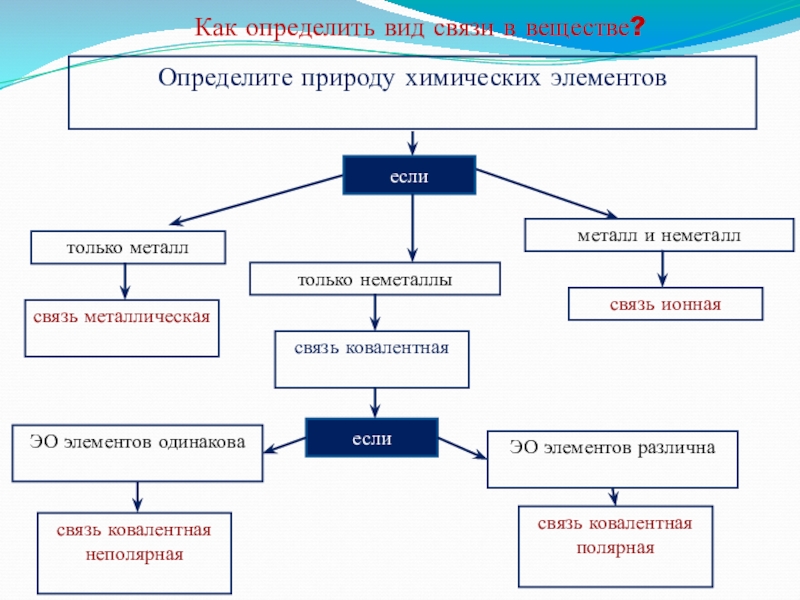
- 13. Как определить вид связи в веществе?Определите природу
- 14. Слайд 14
- 15. Слайд 15
- 16. Слайд 16
- 17. Слайд 17
- 18. Установите соответствие между названием соединения и видом
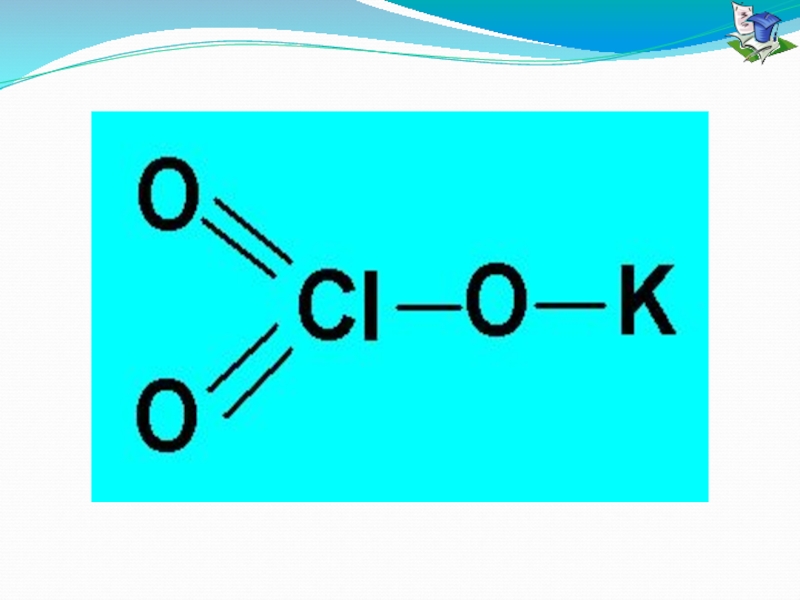
- 19. Установите соответствие между формулой вещества и видом
- 20. Прочность связи Н – галоген в ряду
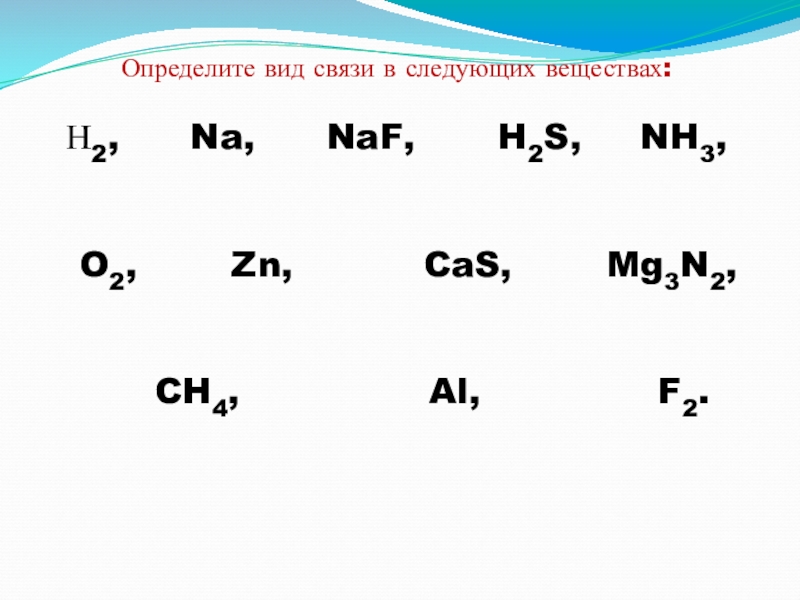
- 21. Определите вид связи в следующих веществах: Н2,
- 22. Упражнение: Определить вид химической связи.
- 23. Задание на самоподготовку:- учить конспект, -
Слайд 2 Виды химической связи.
Цель:
Знать – виды химической связи; типы
кристаллических решеток.
Уметь – определять вид химической связи;
составлять молекулярную, электронную и
структурную формулы веществ.
Слайд 5 ЭО зависит:
1. От количества
электронов
Чем > е, тем >ЭО.
2. От радиуса атома.
Чем > радиус атома, тем< ЭО.
Слайд 6
в периоде ( увеличивается)
в группе (уменьшается)
=> Самый электроотрицательный элемент - F
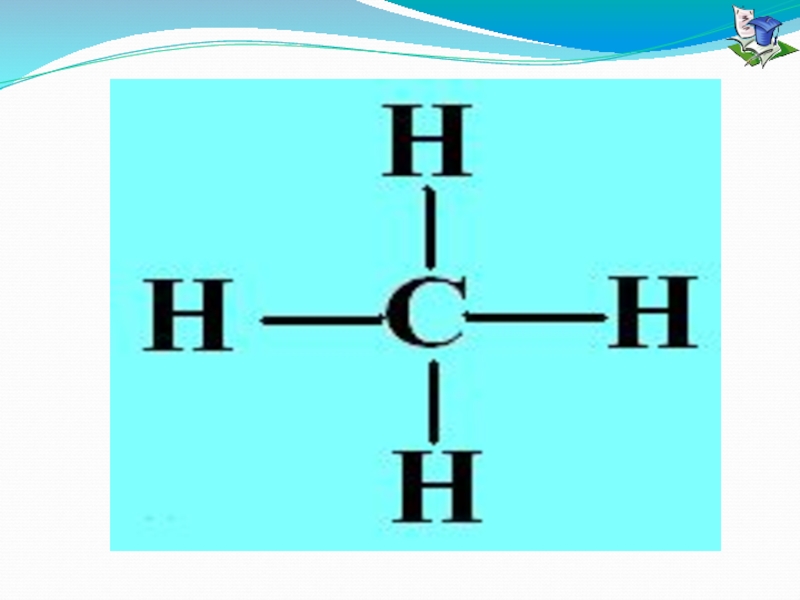
Слайд 10 Ковалентная связь - образуется между атомами неметаллов за счет образования
Ковалентная неполярная
Ковалентная полярная
образуется между атомами
неметаллов с одинаковой
электроотрицательностью.
Встречается в простых веществах:
H2 , O2 , CL2 ,
Br2 , N2 и т.д.
образуется между атомами
неметаллов с разной
электроотрицательность.
Встречается в кислотных оксидах,
кислотах, солях.
HCL , CO , CO2 , HF и т.д.
Слайд 11 Ионная связь -
образуется между атомами металла
и неметалла за счет
сил притяжения.
Встречается в солях, основных оксидах, основаниях.
NaCL , NaOH , CaO .
Слайд 13Как определить вид связи в веществе?
Определите природу химических элементов
если
только металл
только неметаллы
металл
если
связь металлическая
связь ковалентная
связь ионная
связь ковалентная полярная
связь ковалентная неполярная
ЭО элементов одинакова
ЭО элементов различна
Слайд 18Установите соответствие между названием соединения и видом связи атомов в этом
Слайд 19Установите соответствие между формулой вещества и видом химической связи
Формула вещества
А) I2 1) КПС
Б) ZnSO4 2) КНС
В) К2S 3) ИС, КПС
Г) Н2О 4) ВС
5) ИС
6) КНС, КПС
Слайд 20Прочность связи Н – галоген в ряду HI → HBr → HCL
Слайд 21Определите вид связи в следующих веществах:
Н2, Na,
O2, Zn, CaS, Mg3N2,
CH4, Al, F2.
Слайд 22Упражнение: Определить вид химической связи. Составить молекулярную, структурную
Слайд 23 Задание на самоподготовку:
- учить конспект,
- составить молекулярную, структурную
электронную формулы , определить вид
химической связи для:
- хлорида калия,
- фтора,
- оксида углерода (II).