спиртов.
Влияние спиртов на здоровье человека».
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме Спирты 10 класс.
Содержание
- 1. Презентация по теме Спирты 10 класс.
- 2. Цели урока.Изучить состав, строение, классификацию, номенклатуру, физические
- 3. План семинара.1.Спирты. Состав, строение, классификация спиртов.2.Номенклатура, изомерия
- 4. Спирты. Состав, строение спиртов.Спирты – это производные
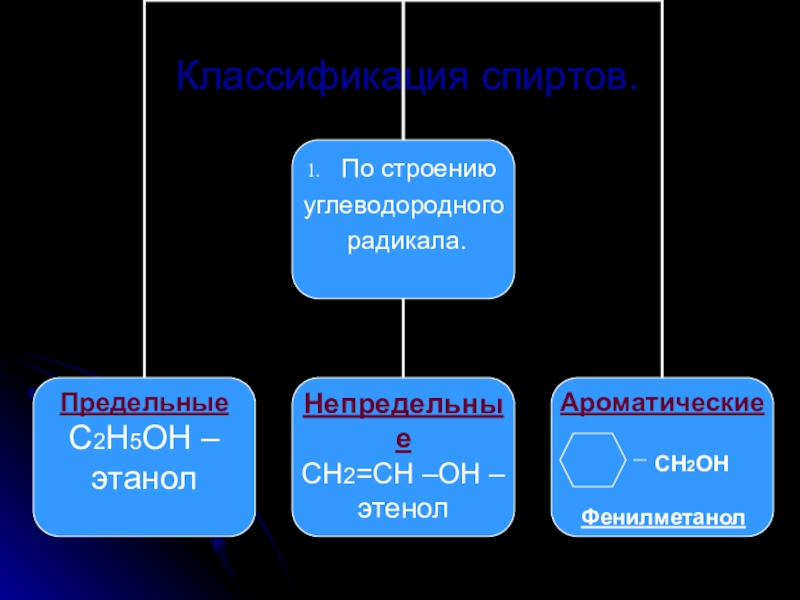
- 5. Классификация спиртов.По строению углеводородного радикала.По числу гидроксильных групп.По атомности атома углерода.
- 6. Классификация спиртов. СН2ОНФенилметанол
- 7. Классификация спиртов
- 8. Классификация спиртов.По углеродному атому, к которому присоединяется
- 9. Номенклатура.Выбирается главная цепь, в состав которой входит
- 10. Номенклатура.
- 11. Изомерия.1. Углеродного скелета. СН3-СН2- СН2 –ОН ;
- 12. Водородная связь.Причиной отличий в физических свойствах предельных УВ и соответствующих им спиртов является водородная связь.
- 13. Физические свойства спиртов.Спирты имеющие в составе с
- 14. Химические свойства спиртов.Химические реакции с участием спиртов
- 15. Уравнения реакций, протекающих по разрыву связи О-Н.1.
- 16. Реакции с разрывом связи с-о1. Взаимодействуют с
- 17. Реакции, протекающие с разрывом нескольких связей.Внутримолекулярной гидратации.
- 18. Реакции окисления и горения спиртов.
- 19. Применение этилового спиртаВ медицине этиловый спирт в
- 20. Воздействие этилового спирта на организм человекаВ больших
Цели урока.Изучить состав, строение, классификацию, номенклатуру, физические и химические свойства спиртов.Установить взаимосвязь строения спиртов с физическими и химическими свойствами.Расширить представления о многообразии спиртов, нахождении их в природе, получении их в быту и промышленности. Значении спиртов и
Слайд 1Семинар по теме: «Спирты. Строение, классификация, номенклатура, физические и химические свойства
Слайд 2Цели урока.
Изучить состав, строение, классификацию, номенклатуру, физические и химические свойства спиртов.
Установить
взаимосвязь строения спиртов с физическими и химическими свойствами.
Расширить представления о многообразии спиртов, нахождении их в природе, получении их в быту и промышленности. Значении спиртов и влиянии их на организм человека.
Закрепить умения работать с дополнительной литературой, делать выводы, подводить итоги своих выступлений.
Расширить представления о многообразии спиртов, нахождении их в природе, получении их в быту и промышленности. Значении спиртов и влиянии их на организм человека.
Закрепить умения работать с дополнительной литературой, делать выводы, подводить итоги своих выступлений.
Слайд 3План семинара.
1.Спирты. Состав, строение, классификация спиртов.
2.Номенклатура, изомерия одноатомных предельных спиртов.
3.Физические свойства
одноатомных предельных спиртов. Водородная связь.
4.Химические свойства одноатомных предельных спиртов. Лаб. Работа №6 «Свойства этилового спирта».
5.История открытия и производства метилового и этилового спиртов. Способы получения спиртов. Применение спиртов.
6.Влияние алкоголя на организм человека.
4.Химические свойства одноатомных предельных спиртов. Лаб. Работа №6 «Свойства этилового спирта».
5.История открытия и производства метилового и этилового спиртов. Способы получения спиртов. Применение спиртов.
6.Влияние алкоголя на организм человека.
Слайд 4Спирты.
Состав, строение спиртов.
Спирты – это производные углеводородов, содержащие одну или несколько
гидроксильных (ОН) групп.
Общая формула спиртов R(OH)n, где
R – углеводородный радикал, n –число гидроксильных групп.
Например: CH3 -ОН; СН2=СН–ОН;С6Н5 – ОН
С2Н4(ОН)2.
Общая формула спиртов R(OH)n, где
R – углеводородный радикал, n –число гидроксильных групп.
Например: CH3 -ОН; СН2=СН–ОН;С6Н5 – ОН
С2Н4(ОН)2.
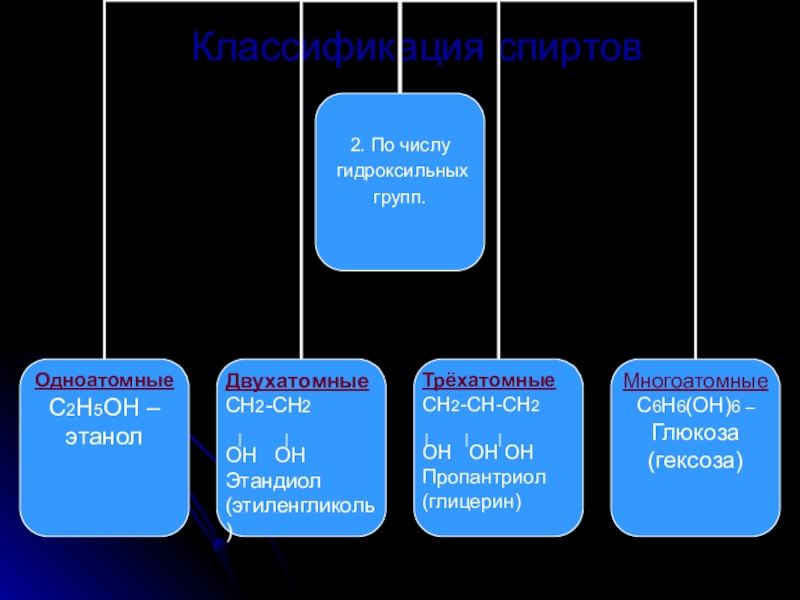
Слайд 5Классификация спиртов.
По строению углеводородного радикала.
По числу гидроксильных групп.
По атомности атома углерода.
Слайд 8Классификация спиртов.
По углеродному атому, к которому присоединяется гидроксильная группа:
Первичные спирты
СН3-СН2-ОН
Вторичные СН3-СН-СН3
ОН СН3
Третичные СН3-СН-СН3
ОН
Вторичные СН3-СН-СН3
ОН СН3
Третичные СН3-СН-СН3
ОН
Слайд 9Номенклатура.
Выбирается главная цепь, в состав которой входит гидроксильная группа.
Нумеруются углеродные атомы
с того углеродного атома, где ближе расположена гидроксильная группа.
Указывается номер и название радикала + название предельного УВ + классовый суффикс – ол.
В случае вторичных и третичных спиртов, указывается в конце номер углеродного атома, к которому присоединена группа – ОН.
Пример: сн3- СН- СН2 –ОН 2-метилпропанол - 1
СН3
Указывается номер и название радикала + название предельного УВ + классовый суффикс – ол.
В случае вторичных и третичных спиртов, указывается в конце номер углеродного атома, к которому присоединена группа – ОН.
Пример: сн3- СН- СН2 –ОН 2-метилпропанол - 1
СН3
Слайд 11Изомерия.
1. Углеродного скелета.
СН3-СН2- СН2 –ОН ; СН3-СН(СН3) –ОН
2. Положения
гидроксильной группы.
СН3-СН2- СН2 –ОН; СН3-СНОН - СН3
3. Межклассовая изомерия (с простыми эфирами).
СН3-СН2- СН2 –ОН; СН3-СН2 – О- СН3
СН3-СН2- СН2 –ОН; СН3-СНОН - СН3
3. Межклассовая изомерия (с простыми эфирами).
СН3-СН2- СН2 –ОН; СН3-СН2 – О- СН3
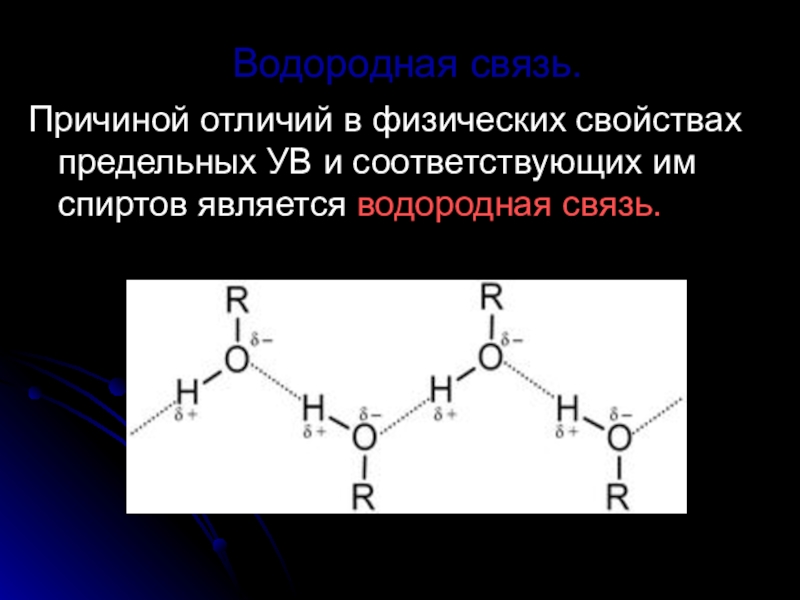
Слайд 12Водородная связь.
Причиной отличий в физических свойствах предельных УВ и соответствующих им
спиртов является водородная связь.
Слайд 13Физические свойства спиртов.
Спирты имеющие в составе с 1 по 10 углеродных
атомов – жидкости, свыше 11- твёрдые вещества.
Спирты лучше растворяются в воде, чем предельные УВ, с увеличением молекулярной массы растворимость спиртов уменьшается и возрастает температура кипения, увеличиваетяс плотность
Спирты имеют меньшую плотность чем вода.
Спирты лучше растворяются в воде, чем предельные УВ, с увеличением молекулярной массы растворимость спиртов уменьшается и возрастает температура кипения, увеличиваетяс плотность
Спирты имеют меньшую плотность чем вода.
Слайд 14Химические свойства спиртов.
Химические реакции с участием спиртов протекают по различным типам
разрыва связи.
I. По разрыву связи О – Н:
А) взаимодействуют с активными металлами,
Б)органическими кислотами.
I. По разрыву связи О – Н:
А) взаимодействуют с активными металлами,
Б)органическими кислотами.
Слайд 15Уравнения реакций, протекающих по разрыву связи О-Н.
1. Взаимодействие с металлами.
2С2 Н5ОН
+ 2Na 2C2Н5ОNa + H2
2. Взаимодействие с органическими кислотами.
С2 Н5ОН + НОСОСН3 C2Н5ОСОСН3 + H2О
2. Взаимодействие с органическими кислотами.
С2 Н5ОН + НОСОСН3 C2Н5ОСОСН3 + H2О
Слайд 16Реакции с разрывом связи с-о
1. Взаимодействуют с неорганическими кислотами.
С2 Н5ОН +
Н2SO4 C2Н5ОHSO4+ H2O
2.Спирты взаимодействуют друг с другом.
R –OH + HO – R1 R – O – R1 + H2O
2.Спирты взаимодействуют друг с другом.
R –OH + HO – R1 R – O – R1 + H2O
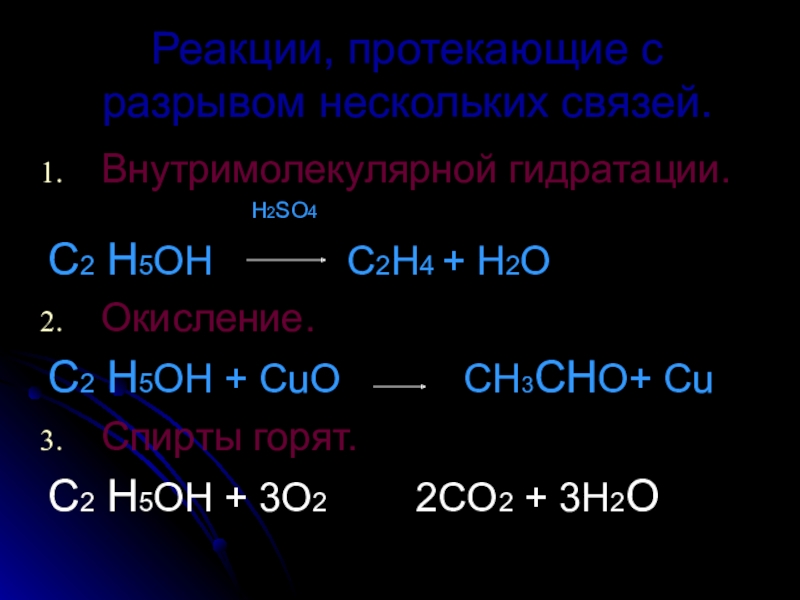
Слайд 17Реакции, протекающие с разрывом нескольких связей.
Внутримолекулярной гидратации.
Н2SO4
С2 Н5ОН C2Н4 + H2О
Окисление.
С2 Н5ОН + CuO CН3СНО+ Cu
Спирты горят.
С2 Н5ОН + 3О2 2CО2 + 3H2О
С2 Н5ОН C2Н4 + H2О
Окисление.
С2 Н5ОН + CuO CН3СНО+ Cu
Спирты горят.
С2 Н5ОН + 3О2 2CО2 + 3H2О
Слайд 19Применение этилового спирта
В медицине этиловый спирт в первую очередь используется как
антисептик. Дубящие свойства 96 % этилового спирта используются для обработки операционного поля или в некоторых методиках обработки рук хирурга. Также спирт можно использовать при ожогах. Быстро испаряясь, он охладит поверхность, уменьшит боль, а главное - предотвратит образование пузырей. Спирт - это отличное жаропонижающее средство. При растирании тела этанол быстро испарится и снизит температуру кожи и организма в целом. Этанол вызвает расширение кровеносных сосудов. Усиление потока крови приводит к покраснению кожи и ощущению теплоты. Побочные эффекты при наружном применении проявляются в виде аллергических реакций, ожога кожи, гиперемии и болезненности кожи в месте наложения компресса.
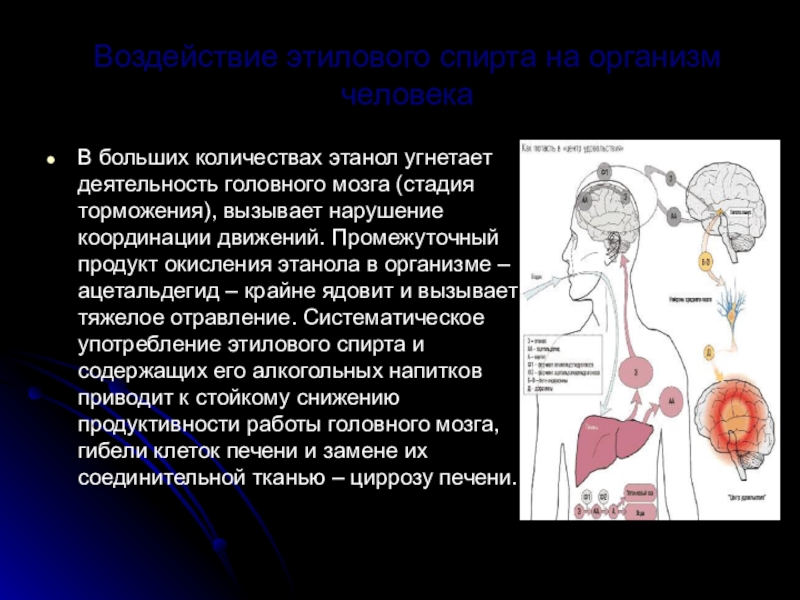
Слайд 20Воздействие этилового спирта на организм человека
В больших количествах этанол угнетает деятельность
головного мозга (стадия торможения), вызывает нарушение координации движений. Промежуточный продукт окисления этанола в организме – ацетальдегид – крайне ядовит и вызывает тяжелое отравление. Систематическое употребление этилового спирта и содержащих его алкогольных напитков приводит к стойкому снижению продуктивности работы головного мозга, гибели клеток печени и замене их соединительной тканью – циррозу печени.