- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме соли
Содержание
- 1. Презентация по теме соли
- 2. Проверка домашнего заданияКакие вещества называют кислотами?Какие кислоты
- 3. Проверка домашнего заданияКак называются соли сернистой кислоты?Как
- 4. Правила безопасностиВопрос №23 (ОГЭ). Правила безопасной работы
- 5. Проверка домашнего заданияУказать какие свойства характерны для
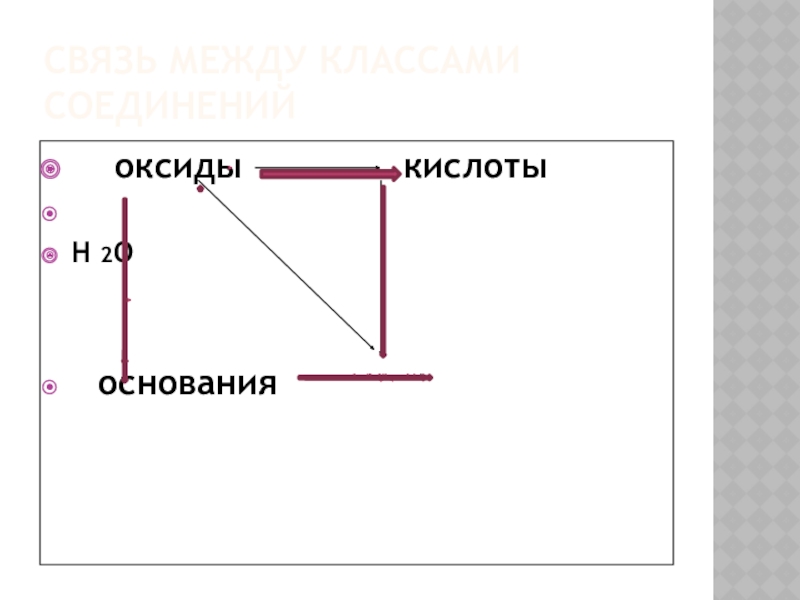
- 6. Связь между классами соединений оксиды
- 7. Тема урока: СолиДомашнее задание : п.33. упр 1-3 после параграфа.
- 8. СолиСоли- это сложные соединения, состоящие из атомов металла и кислотного остатка
- 9. СолиИмеют большое практическое значение в природе и
- 10. СОлиКMnO4 – перманганат калия используется в медицине
- 11. СолиВсе лекарственные препараты это соли органических и неорганических кислот.
- 12. СолиПримеры солейKNO3 нитрат калияFe2 (SO4 )3 сульфат железа (III)Na Cl -хлорид натрия
- 13. Алгоритм составления формулыЗаписать химические знаки металла и
- 14. Алгоритм составления формулы солиРазделитьполученное число: - На
- 15. Алгоритм составления формулы солиПроверка: произведение значения валентного
- 16. Название солейСуффикс –атДля высшей степени окисления неметалла в кислотном остатке:SO3 ----H2 SO4
- 17. Название солейСуффикс –ит для низшей степени окисления
- 18. Название солиНазвание соли образованной бескислородной кислотой, состоит
- 19. тренажерРасставьте индексы и дайте названия веществам:Mg …ClZn….PO4Ca….NO3Fe…SO4Al…NO3Mg…PO4
- 20. Из данного перечня выпишите формулы солейZn(NO3)2
- 21. Итоги урокаСоли сложные соединения в состав которых
Проверка домашнего заданияКакие вещества называют кислотами?Какие кислоты бывают по содержанию? Приведите примеры.Какие кислоты бывают по основности?
Слайд 2Проверка домашнего задания
Какие вещества называют кислотами?
Какие кислоты бывают по содержанию? Приведите
примеры.
Какие кислоты бывают по основности?
Какие кислоты бывают по основности?
Слайд 3Проверка домашнего задания
Как называются соли сернистой кислоты?
Как называются соли серной кислоты?
Какая
разница между сернистой кислотой и серной кислотой?
Слайд 4Правила безопасности
Вопрос №23 (ОГЭ). Правила безопасной работы в школьной лаборатории.
Какие правила
техники безопасности необходимо соблюдать при работе с кислотами?
Что необходимо сделать при попадании кислоты на кожу?
Как правильно разбавлять серную кислоту?
Что необходимо сделать при попадании кислоты на кожу?
Как правильно разбавлять серную кислоту?
Слайд 5Проверка домашнего задания
Указать какие свойства характерны для серной кислоты:
-хорошо растворима в
воде.
Изменяет окраску лакмуса на красный цвет.
Кислота двухосновная,
Изменяет окраску лакмуса на красный цвет.
Кислота двухосновная,
Слайд 9Соли
Имеют большое практическое значение в природе и жизни человека.
Хлорид натрия –
поваренная соль.
Карбонат кальция- мел, мрамор, известняк.
Фосфат кальция- основной компонент кости.
Карбонат кальция- мел, мрамор, известняк.
Фосфат кальция- основной компонент кости.
Слайд 10СОли
КMnO4 – перманганат калия используется в медицине дезинфицирующего средства.
MgSO4 – сульфат
магния, английская соль. Используется в качестве лекарственного средства.
Слайд 13Алгоритм составления формулы
Записать химические знаки металла и кислотного остатка, указать их
валентности.
Найти наименьшее общее кратное значений валентности
Найти наименьшее общее кратное значений валентности
II III
Са РО4
II x III=6
Слайд 14Алгоритм составления формулы соли
Разделить
полученное число:
- На валентность металла и записать
индекс справа внизу от металла:
-На валентность кислотного остатка и записать индекс кислотного остатка
-На валентность кислотного остатка и записать индекс кислотного остатка
6: II =3
6: III =2
Ca 3(PO4)2
Слайд 15Алгоритм составления формулы соли
Проверка: произведение значения валентного металла на его индекс
должно быть равно аналогичному произведению для кислотного остатка
Слайд 16Название солей
Суффикс –ат
Для высшей степени окисления неметалла в кислотном остатке:
SO3 ----H2
SO4
Слайд 17Название солей
Суффикс –ит для низшей степени окисления неметалла в кислотном остатке.
SO2
–H2 SO3
Сернистая кислота, сульфит.
Азотистая кислота- нитрит.
Сернистая кислота, сульфит.
Азотистая кислота- нитрит.
Слайд 18Название соли
Название соли образованной бескислородной кислотой, состоит из двух слов: название
кислотного остатка с окончанием -ид
HClхлорид
H2 S
сульфид
Слайд 19тренажер
Расставьте индексы и дайте названия веществам:
Mg …Cl
Zn….PO4
Ca….NO3
Fe…SO4
Al…NO3
Mg…PO4
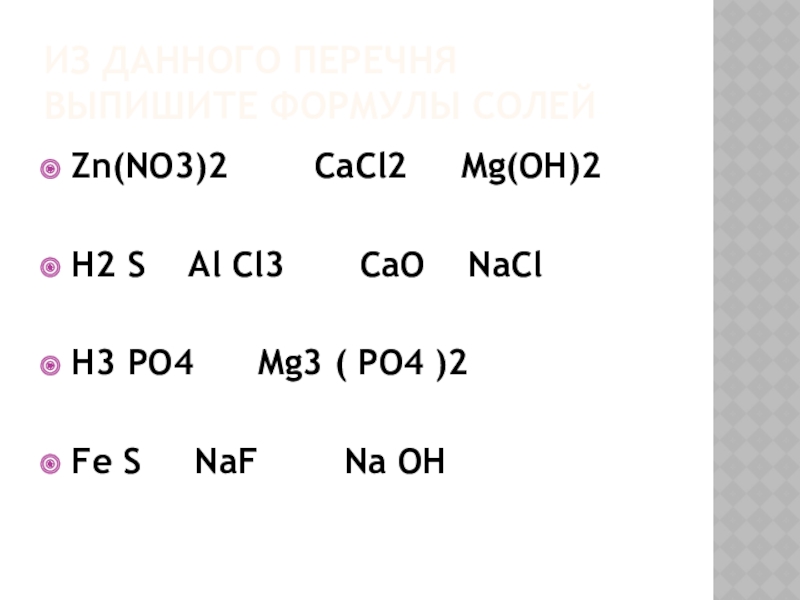
Слайд 20Из данного перечня выпишите формулы солей
Zn(NO3)2 CaCl2
Mg(OH)2
H2 S Al Cl3 CaO NaCl
H3 PO4 Mg3 ( PO4 )2
Fe S NaF Na OH
H2 S Al Cl3 CaO NaCl
H3 PO4 Mg3 ( PO4 )2
Fe S NaF Na OH
Слайд 21Итоги урока
Соли сложные соединения в состав которых входят металлы и кислотные
остатки.
По растворимости в воде соли бывают хорошо растворимыми, нерастворимыми, плохо растворимыми.
Все соли натрия и калия хорошо растворимы в воде.
Все соли азотной кислоты хорошо растворимы в воде.
Хлорид натрия и карбонат кальция имеют большое значение в жизни человека.
По растворимости в воде соли бывают хорошо растворимыми, нерастворимыми, плохо растворимыми.
Все соли натрия и калия хорошо растворимы в воде.
Все соли азотной кислоты хорошо растворимы в воде.
Хлорид натрия и карбонат кальция имеют большое значение в жизни человека.