- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме ПСХЭ Д. И.Менделеева 11 класс
Содержание
- 1. Презентация по теме ПСХЭ Д. И.Менделеева 11 класс
- 2. Допиши реакции , расставь коэффициентыКакой из законов химии ты применил, чтобы выполнить задания? Сформулируй его.
- 3. Проверь себя
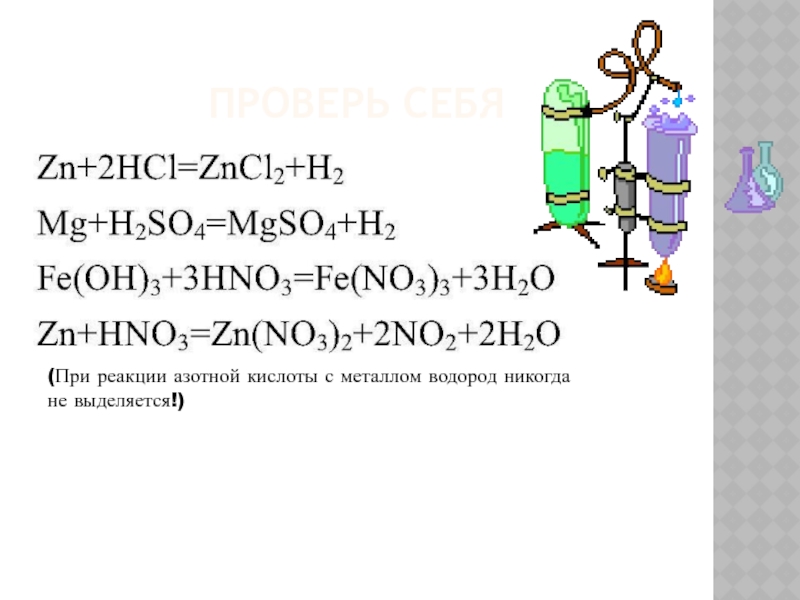
- 4. Проверь себя(При реакции азотной кислоты с металлом водород никогда не выделяется!)
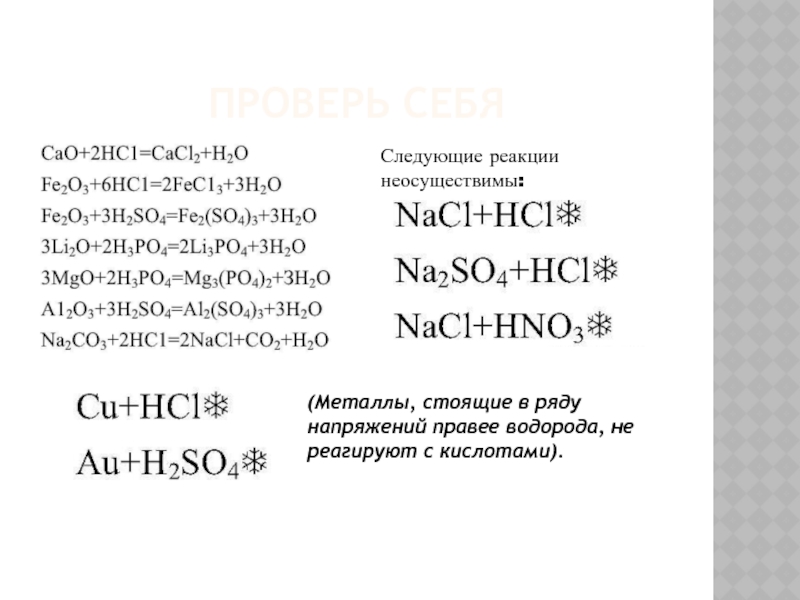
- 5. Проверь себяСледующие реакции неосуществимы:(Металлы, стоящие в ряду напряжений правее водорода, не реагируют с кислотами).
- 6. Чтоб тему урока узнать , вам нужно
- 7. оТветыВОДОРОДРадОнНикЕльСеРеброПеред нами химические элементы .И они живут в _______________________
- 8. Тема урока: "Периодическая система химических элементов Д.И.
- 9. Цели урокаПознавательные УУДПродолжить формирование умения работать с
- 10. Предпосылки открытия периодического законаВ период становления науки
- 11. Формулировка закона: свойства химических элементов, простых веществ, а
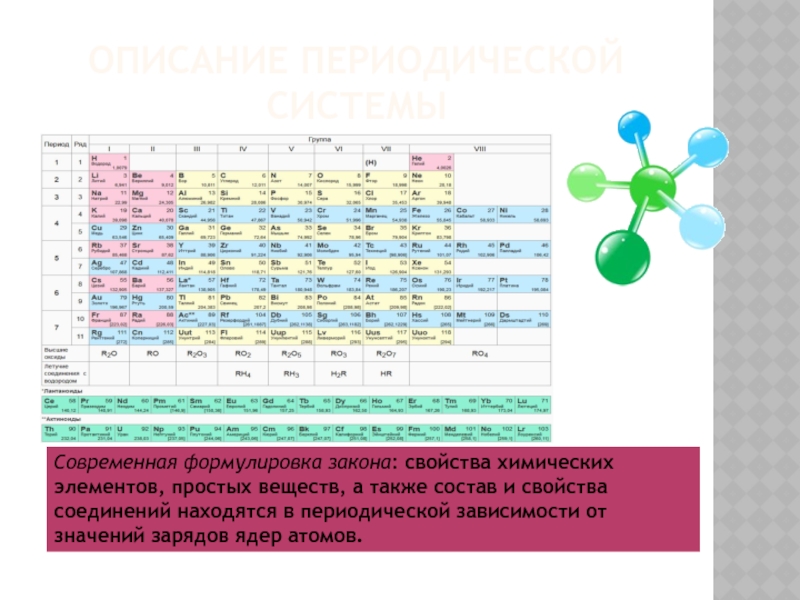
- 12. Описание периодической системыСовременная формулировка закона: свойства химических элементов,
- 13. Графическим выражением периодического закона является Периодическая система
- 14. Рассмотрим принятые в ней обозначения на примере
- 15. Понятие о группах и подруппахГруппа – столбец периодической системы,
- 16. Это основополагающий принцип построения периодической системы. Рассмотрим
- 17. Некоторые главные подруппы имеют свои особенные названия:
- 18. Строка, называемая периодом, - это последовательность элементов,
- 19. Существует два основных варианта представления периодической системы:
- 20. Периодическая повторяемость строения валентных электронов в атоме – это важнейший критерий, который объясняет и предсказывает свойства многих элементов.
- 21. У каждой группы есть формула высшего оксида, т.
- 22. Изменение атомного радиусаВ группах: для элементов главных подгрупп
- 23. ЭлектроотрицательностьЭлектроотрицательность – это способность атома перетягивать на себя электроны связи.
- 24. ЗакономерностьНаибольшей электроотрицательностью обладают элементы, находящиеся в правом
- 25. Закономерности изменения периодических свойств приведены
- 26. Слайд 26
- 27. Слайд 27
- 28. Слайд 28
- 29. Слайд 29
- 30. Элемент периодической системы Менделеева № 110-Дармштадтий Дармштадтий (лат. Darmstadtium,
- 31. Элемент периодической системы Менделеева №112- Коперниций Коперниций (лат. Copernicium, Cn;
- 32. Элемент периодической системы Менделеева №113- Унунтрий Унунтрий (лат. Ununtrium,
- 33. Элемент периодической системы Менделеева №115- Унунпентий Унунпе́нтий (лат. Ununpentium,
- 34. Элемент периодической системы Менделеева №117- Унунсептий Унунсе́птий (лат. Ununseptium,
- 35. Закрепим знания1. В каком году был открыт
- 36. Закрепление1. Химические свойства вещества определяются тремя субатомными
- 37. закрепление6. Массовое число изотопа равно:а) числу протонов
- 38. ответы1 электрон, протон и нейтрон2 г3
- 39. Подведение итогов урокаНа уроке я узналВыполнил ____________заданийНе понял___________Было интересно:
- 40. Домашнее заданиеПараграф 5, задания 2-4Для подготовки к
- 41. Тесты1. Сколько химических элементов было известно к
- 42. Тесты10. Что означает слово «атом» в переводе
- 43. тесты21. Какой элемент не является p-элементом? а)
- 44. ответы1. C.2. 2е-, 8е-, 4е-.3. KH, K2O,
- 45. Молодцы !Спасибо за урок!
Слайд 1Урок № 4 по теме Периодическая Система химических элементов Д.И. Менделеева
Учитель
Слайд 2Допиши реакции , расставь коэффициенты
Какой из законов химии ты применил, чтобы
Слайд 5Проверь себя
Следующие реакции неосуществимы:
(Металлы, стоящие в ряду напряжений правее водорода, не
Слайд 6Чтоб тему урока узнать , вам нужно загадки отгадать.
1. Какой элемент
2. Какой элемент всегда рад?
В состав названия, какого металла входит дерево?
Название какого металла имеет кость скелета животного или человека?
Слайд 7оТветы
ВОДОРОД
РадОн
НикЕль
СеРебро
Перед нами химические элементы .И они живут в _______________________
Слайд 8Тема урока: "Периодическая система химических элементов Д.И. Менделеева"
Задачами урока являются:
- обобщить
- систематизировать знания о важнейших закономерностях, заложенных в периодической системе;
- уметь применять знания о строении атомов, о периодичности изменения свойств элементов при решении химических задач.
Слайд 9Цели урока
Познавательные УУД
Продолжить формирование умения работать с периодической таблицей.
Продолжить формирование умения
Коммуникативные УУД
Продолжить формирование умения самостоятельно организовывать учебное взаимодействие при работе в группе (паре).
Продолжить формирование умения слушать товарища и обосновывать свое мнение.
Продолжить формирование умения выражать свои мысли и идеи.
Регулятивные УУД
Продолжить формирование умения определять цель учебной деятельности.
Продолжить формирование умения определять взаимосвязь между строением и свойствами.
Продолжить формирование умения работать по плану, сверять свои действия с целью и при необходимости исправлять ошибки самостоятельно.
Продолжить обучение основам самоконтроля, самооценки и взаимооценки.
Слайд 10Предпосылки открытия периодического закона
В период становления науки химии ученые пытались привести
Слайд 11Формулировка закона:
свойства химических элементов, простых веществ, а также состав и свойства
К моменту формулировки периодического закона еще не было известно строение атома и существования элементарных частиц. Также впоследствии было установлено, что от атомных масс свойства вещества не зависят, как это предполагал Менделеев. Хотя, не обладая этими сведениями, Д. И. Менделеев не сделал в своей таблице ни единой ошибки.
После открытия Мозли, который установил экспериментально, что заряд ядра атома совпадает с порядковым номером химического элемента, указанным Менделеевым в его таблице, в формулировку его закона внесли изменения.
Слайд 12Описание периодической системы
Современная формулировка закона: свойства химических элементов, простых веществ, а также
Слайд 13Графическим выражением периодического закона является Периодическая система химических элементов Д. И.
Рассмотрим принятые в ней обозначения на примере рубидия
В каждой ячейке, соответствующей элементу, представлены: химический символ, название, порядковый номер, соответствующий числу протонов в атоме, относительная атомная масса. Число электронов в атоме соответствует числу протонов. Количество нейтронов в атоме можно найти по разности между относительной атомной массой и количеством протонов, т. е. порядкового номера.
N(n0) = Ar - Z
Слайд 14Рассмотрим принятые в ней обозначения на примере рубидия
Количество относительная порядковый
нейтронов атомная
Например, для изотопа хлора 35Cl количество нейтронов равно: 35-17=18
Составными частями периодической системы являются группы и периоды.
Периодическая система содержит восемь групп элементов. Каждая группа состоит их двух подгрупп: главной и побочной . Главные обозначены буквой а, а побочные – буквой б. Главная подгруппа содержит больше элементов, чем побочная. В главной подгруппе содержатся s- и p-элементы, в побочной – d-элементы.
Слайд 15Понятие о группах и подруппах
Группа – столбец периодической системы, в котором объединены химические
Слайд 16Это основополагающий принцип построения периодической системы. Рассмотрим это не примере элементов
Из таблицы видно, что элементы первой группы главной подгруппы имеют один валентный электрон. Элементы второй группы главной подгруппы имеют два валентных электрона.
Слайд 18Строка, называемая периодом, - это последовательность элементов, расположенных в порядке увеличения
Номер периода равен количеству электронных уровней в атоме.
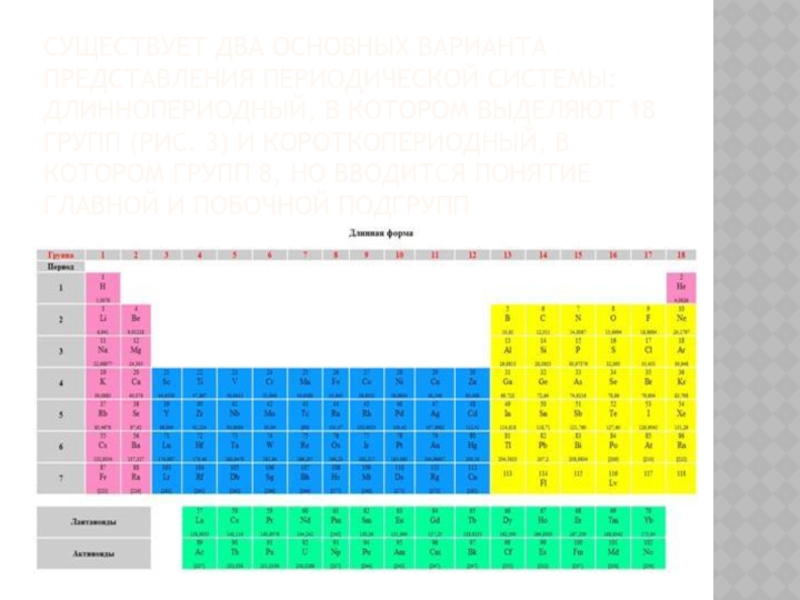
Слайд 19Существует два основных варианта представления периодической системы: длиннопериодный, в котором выделяют
Слайд 20Периодическая повторяемость строения валентных электронов в атоме – это важнейший критерий, который объясняет и предсказывает
Слайд 21У каждой группы есть формула высшего оксида, т. е. оксида с максимальной
Эта информация написана внизу таблицы. Например, для элементов V группы формула высшего оксида – R2O5. Это N2O5, P2O5, As2O5, V2O5…. По составу высшего оксида элемента можно определить его свойства. Оксиды состава R2O, RO основные. R2O3- чаще всего амфотерные. Остальные оксиды – кислотные. Чем выше степень окисления элемента R, чем ярче выраженными кислотными свойствами обладает его оксид. Таким образом, кислотность высших оксидов элементов главных подгрупп увеличивается по периоду слева направо. В таблице отражен состав летучих водородных соединений. Такие соединения образуют элементы IV-VII групп, причем только легких.
Слайд 22Изменение атомного радиуса
В группах: для элементов главных подгрупп сверху вниз увеличивается число
В периодах: по периоду номер энергетического уровня, на котором находятся валентные электроны, остается неизменным, но число валентных электронов увеличивается, а также растет и заряд ядра. Значит, электроны электростатически сильнее притягиваются к ядру. Поэтому радиус атома уменьшается.
Слайд 23
Электроотрицательность
Электроотрицательность – это способность атома перетягивать на себя электроны связи.
Слайд 24Закономерность
Наибольшей электроотрицательностью обладают элементы, находящиеся в правом верхнем углу Периодической системы.
Слайд 30Элемент периодической системы Менделеева № 110-Дармштадтий
Дармштадтий (лат. Darmstadtium, обозначение Ds; ранее Унуннилий) — искусственно синтезированный химический элемент VIII
История.
Элемент получил название по месту открытия. Впервые синтезирован
9 ноября 1994 в Центре исследованийтяжелых ионов, Дармштадт, С. Хофманном, В. Ниновым, Ф. П. Хессбергером, П. Армбрустером, Х. Фолгером, Г. Мюнценбергом, Х. Шоттом и другими. Обнаруженный изотоп имел атомную массу 269.
Получение
Изотопы дармштадтия были получены в результате ядерных реакций:
Свойства
Радиоактивен.
Слайд 31Элемент периодической системы Менделеева №112- Коперниций
Коперниций (лат. Copernicium, Cn; в качестве русского названия используется
Коперниций впервые синтезирован 9 февраля 1996 года в Институте тяжёлых ионов
в Дармштадте, С. Хоффманном (S. Hofmann), В. Ниновым (V. Ninov), Ф. П. Хессбергером (F. P. Hessberger), П. Армбрустером (P. Armbruster), Х. Фолгером (H. Folger), Г. Мюнценбергом (G. Münzenberg) и другими. Название
Учёные GSI предложили для 112-го элемента название Copernicium (Cn) в честь Николая Коперника. 19 февраля 2010 года, в день рождения Коперника,ИЮПАК официально утвердил название элемента. Ранее для него предлагались названия штрассманий St, венусий Vs, фриший Fs, гейзенбергий Hb, а также лаврентий Lv, виксхаузий Wi, гельмгольций Hh.
Слайд 32Элемент периодической системы Менделеева №113- Унунтрий
Унунтрий (лат. Ununtrium, Uut) или эка-таллий — 113-й химический элемент III группыпериодической
В феврале 2004 года были опубликованы результаты экспериментов, проводившихся с 14 июля по 10 августа 2003 года, в результате которых был получен 113-й элемент. Исследования проводились в Объединённом институте ядерных исследований (Дубна, Россия) . Получение
Изотопы унунтрия были получены в результате α-распада изотопов унунпентия: а также в результате ядерных реакций:
Слайд 33Элемент периодической системы Менделеева №115- Унунпентий
Унунпе́нтий (лат. Ununpentium, Uup) или эка-висмут — 115-й химический элемент V группы периодической
В феврале 2004 года были опубликованы результаты экспериментов, проводившихся с 14 июля по 10 августа 2003 года, в результате которых был получен 115-ый элемент.Исследования проводились в Объединённом институте ядерных исследований (Дубна, Россия). Получение
Изотопы унунпентия были получены в результате ядерных реакций:
Слайд 34Элемент периодической системы Менделеева №117- Унунсептий
Унунсе́птий (лат. Ununseptium, Uus) или эка-астат — временное наименование для
Был получен в Объединённом институте ядерных исследований в Дубне, Россия в 2009—2010 годах. Для синтеза элемента использовались реакции:
Происхождение названия
Слово «унунсептий» образовано из корней латинских числительных и буквально обозначает что-то наподобие «одно-одно-семий» (числительное «117-й» строится совсем иначе). В дальнейшем название будет изменено.
Слайд 35Закрепим знания
1. В каком году был открыт периодический закон? (1 марта
2. Дайте современную формулировку периодического закона. (Свойства химических элементов, а также их соединений находятся в периодической зависимости от зарядов ядер атомов.)
3. Чем отличается современная формулировка периодического закона от данной Менделеевым? (За основу Менделеев брал атомный вес элемента.)
4. При создании периодической системы Д.И. Менделеев расположил два соседних элемента (какие?) V периода не в порядке возрастания атомного веса. Почему это пришлось сделать? (Te, I)
5. Можете ли вы привести дополнительные примеры подобных несоответствий? (Ar-K, Co-Ni)
Слайд 36Закрепление
1. Химические свойства вещества определяются тремя субатомными частицами. Две из них
Эти частицы называются______________, _________________ и _______________.
2. Из перечисленных ниже характеристик атомов элементов периодически изменяются:
а) заряд ядра атома;
б) относительная атомная масса;
в) число энергетических уровней в атоме;
г) число электронов на внешнем энергетическом уровне.
3. Атом какого из элементов легче всего отдает один электрон:
а) натрий, порядковый номер 11;
б) магний, порядковый номер 12;
в) алюминий, порядковый номер 13;
г) кремний, порядковый номер 14?
4. Число протонов в ядре равно:
а) числу нейтронов в ядре;
б) номеру группы;
в) числу электронов в атоме;
г) суммарному числу электронов и нейтронов?
5. Атом элемента имеет порядковый номер 13 и массовое число 27. Число валентных электронов у него равно:
а) 5; в) 3;
б) 2; г) 4.
Слайд 37закрепление
6. Массовое число изотопа равно:
а) числу протонов в ядре;
б) числу нейтронов
в) числу орбитальных электронов;
г) суммарному числу нейтронов и протонов.
7. Элемент с порядковым номером 38 должен обладать свойствами, сходными с:
а) платиной; в) кальцием;
б) свинцом; г) ртутью.
8. Неметаллические свойства элементов, расположенных в главных подгруппах периодической системы Д.И. Менделеева, наиболее ярко выражены у тех из них, которые находятся:
а) в верхней части подгруппы;
б) в нижней части подгруппы;
в) в середине подгруппы;
г) у всех элементов подгруппы выражены примерно в одинаковой степени.
9. Неизвестный элемент Э образует хлорид состава ЭCl3. Какая наиболее вероятная формула у его оксида:
а) ЭО2; в) Э2О3;
б) ЭО3; г) Э3О2.
10. Элементы IА группы периодической системы
а) называются щелочными металлами;
б) принимают электроны;
в) имеют атомы с числом электронов на один меньше, чем нужно для достижения электронной конфигурации инертного газа;
г) образуют высшие оксиды с общей формулой R2О3.
Слайд 39Подведение итогов урока
На уроке я узнал
Выполнил ____________заданий
Не понял___________
Было интересно:
Слайд 40Домашнее задание
Параграф 5, задания 2-4
Для подготовки к ГИА
1. Определите элемент по
протонов - 6, нейтронов - 6, электронов - 6. Элемент . . .
2. Изобразите схему строения атома кремния.
3. На основании положения элемента в периодической системе напишите его соединения, формы которых указаны ниже:
Элемент Гидрид Высший оксид Гидроксид


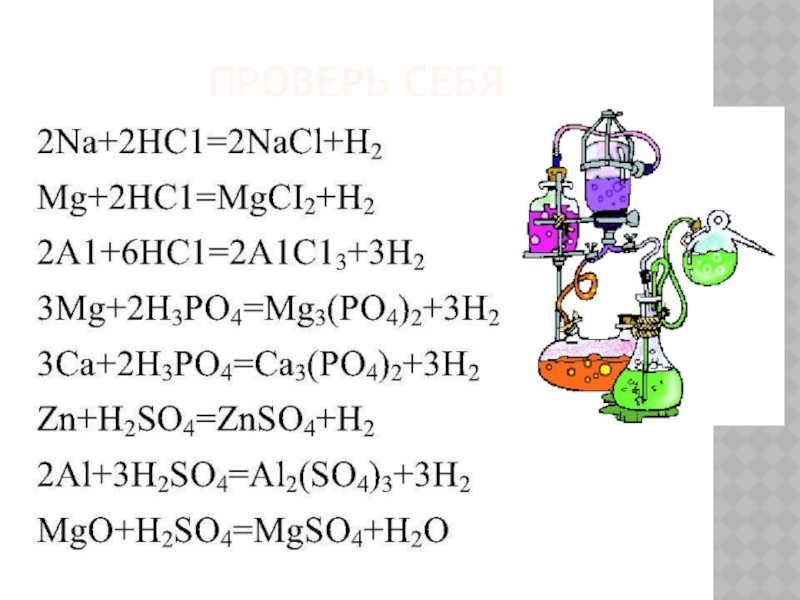























![Презентация по теме ПСХЭ Д. И.Менделеева 11 класс Элемент периодической системы Менделеева №113- Унунтрий Унунтрий (лат. Ununtrium, Uut) или эка-таллий — 113-й химический элемент III Элемент периодической системы Менделеева №113- Унунтрий Унунтрий (лат. Ununtrium, Uut) или эка-таллий — 113-й химический элемент III группыпериодической системы, атомный номер 113, атомная масса [284], наиболее устойчивыйизотоп 284Uut.](/img/thumbs/4f773297d318b5cb08bc37f05a4990a5-800x.jpg)


















