- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме Нитраты - соли азотной кислоты
Содержание
- 1. Презентация по теме Нитраты - соли азотной кислоты
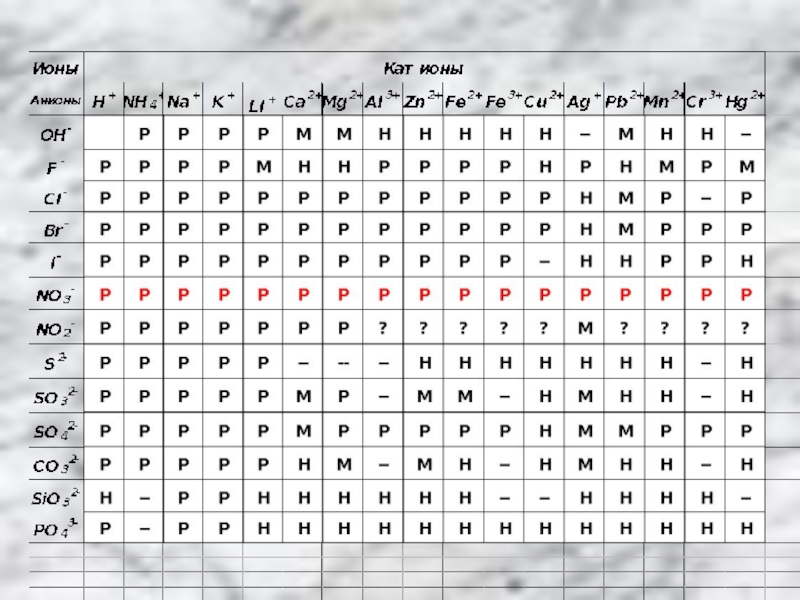
- 2. Состав нитратовКатион металлаНитрат -анионНапример: Ba2+(NO3)2- - нитрат бария
- 3. Техника безопасности при работе с нитратамиВсе нитраты
- 4. Слайд 4
- 5. Свойства нитратов, сходные с другими солямиНитраты –
- 6. Особые свойства нитратов – разложение при нагревании.
- 7. Разложение нитрата меди (II) Сu(N+5O3-2)2→ Сu
- 8. Разложение нитрата серебра (I)Ag+1N+5O3 -2 →
- 9. Электрохимический ряд напряжений металловПри нагревании нитраты разлагаются
- 10. По характеру химического разложения нитраты делятся на
- 11. Применение нитратовНитраты используются в медицинеНитраты используются в производстве взрывчатых веществБольшая часть азотных удобрений – нитраты
- 12. Качественная реакция на нитрат-ион 4KN+5O3 + Сu0
Состав нитратовКатион металлаНитрат -анионНапример: Ba2+(NO3)2- - нитрат бария
Слайд 3Техника безопасности при работе с нитратами
Все нитраты относятся к огневзрызоопасным веществам,
поэтому хранить их нужно отдельно от органических и неорганических веществ.
Все опыты с образованием оксида азота (IV) необходимо проводить в больших пробирках, закрытых ватными тампонами, смоченными щёлочью.
Все опыты с образованием оксида азота (IV) необходимо проводить в больших пробирках, закрытых ватными тампонами, смоченными щёлочью.
Слайд 5Свойства нитратов, сходные с другими солями
Нитраты – сильные электролиты, в водном
растворе диссоциируют на ионы:
Вa(NO3)2→Вa2+ + 2NO3-
Нитраты вступают в реакции ионного обмена.
Ba(NO3)2 + H2SO4 →BaSO4↓+ 2HNO3
Al(NO3)3 + 3NaOH → Al(OH)3 ↓ + 3NaNO3
AgNO3 + KCl → AgCl ↓ + KNO3
Вa(NO3)2→Вa2+ + 2NO3-
Нитраты вступают в реакции ионного обмена.
Ba(NO3)2 + H2SO4 →BaSO4↓+ 2HNO3
Al(NO3)3 + 3NaOH → Al(OH)3 ↓ + 3NaNO3
AgNO3 + KCl → AgCl ↓ + KNO3
Слайд 6Особые свойства нитратов – разложение при нагревании.
Разложение нитрата калия
KN+5O3-2 → KN+3O2
+ O20↑
окислитель N+5 + 2е- → N+3 2 2 восстановление
восстановитель 2O-2 - 4е- → O20 4 1 окисление
2KN+5O3-2 → 2KN+3O2 + O20↑
окислитель N+5 + 2е- → N+3 2 2 восстановление
восстановитель 2O-2 - 4е- → O20 4 1 окисление
2KN+5O3-2 → 2KN+3O2 + O20↑
Слайд 7Разложение
нитрата меди (II)
Сu(N+5O3-2)2→ Сu O + N+4O2↑+ O20 ↑
окислитель N+5 + 1е- → N+4 1 4 восстановление
восстановитель 2O-2 - 4е-→ O20 4 1 окисление
2Сu(N+5O3-2)2→ 2Сu O + 4N+4O2↑+ O20 ↑
восстановитель 2O-2 - 4е-→ O20 4 1 окисление
2Сu(N+5O3-2)2→ 2Сu O + 4N+4O2↑+ O20 ↑
Слайд 8Разложение
нитрата серебра (I)
Ag+1N+5O3 -2 → Ag 0 + N+4O 2↑+
O02↑
окислитель N+5+1е-→N+4 восстановление
окислитель Ag+1+1е-→Ag0 2 2 восстановление
восстановитель 2O-2 - 4е-→ O20 4 1 окисление
2Ag+1N+5O3 -2 → 2Ag 0 + 2N+4O 2↑+ O02↑
окислитель N+5+1е-→N+4 восстановление
окислитель Ag+1+1е-→Ag0 2 2 восстановление
восстановитель 2O-2 - 4е-→ O20 4 1 окисление
2Ag+1N+5O3 -2 → 2Ag 0 + 2N+4O 2↑+ O02↑
Слайд 9Электрохимический ряд напряжений металлов
При нагревании нитраты разлагаются тем полнее, чем правее
в электрохимическом ряду напряжений стоит металл, образующий соль
Слайд 10По характеру химического разложения нитраты делятся на три группы:
MeNO3
от Li до
Na
от Mg до Cu
после Cu
MeNO2+O2↑
MeO + NO2↑+ O2↑
Me+NO2↑+O2↑
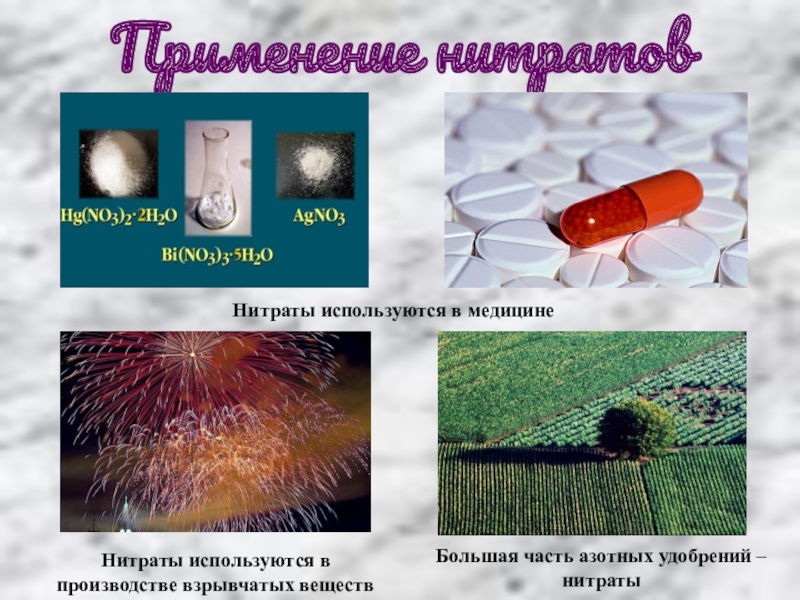
Слайд 11Применение нитратов
Нитраты используются в медицине
Нитраты используются в производстве взрывчатых веществ
Большая часть
азотных удобрений – нитраты
Слайд 12Качественная реакция на нитрат-ион
4KN+5O3 + Сu0 + 2H2SO4(к) →
Сu+2(NO3)2
+ 2N+4O2↑+ 2K2SO4 + 2H2O
окислитель N+5 + 1е- → N+4 1 2 восстановление
восстановитель Cu0 - 2е-→ Cu+2 2 1 окисление
окислитель N+5 + 1е- → N+4 1 2 восстановление
восстановитель Cu0 - 2е-→ Cu+2 2 1 окисление